- •КафедраКафедрабиоорганическойбиоорганическойхимиихим иБГМУБГМУ
- •Пептиды и белки представляют
- •Полипептид в общем виде
- •НАЗВАНИЯ НЕКОТОРЫХ АМИНОКИСЛОТНЫХ ОСТАТКОВ
- •Пептидная связь
- •В пептидной группе –CONH- атомы C, O, N в sp2 –гибридизации и лежат
- •Электронное строение предопределяет жесткую плоскостную
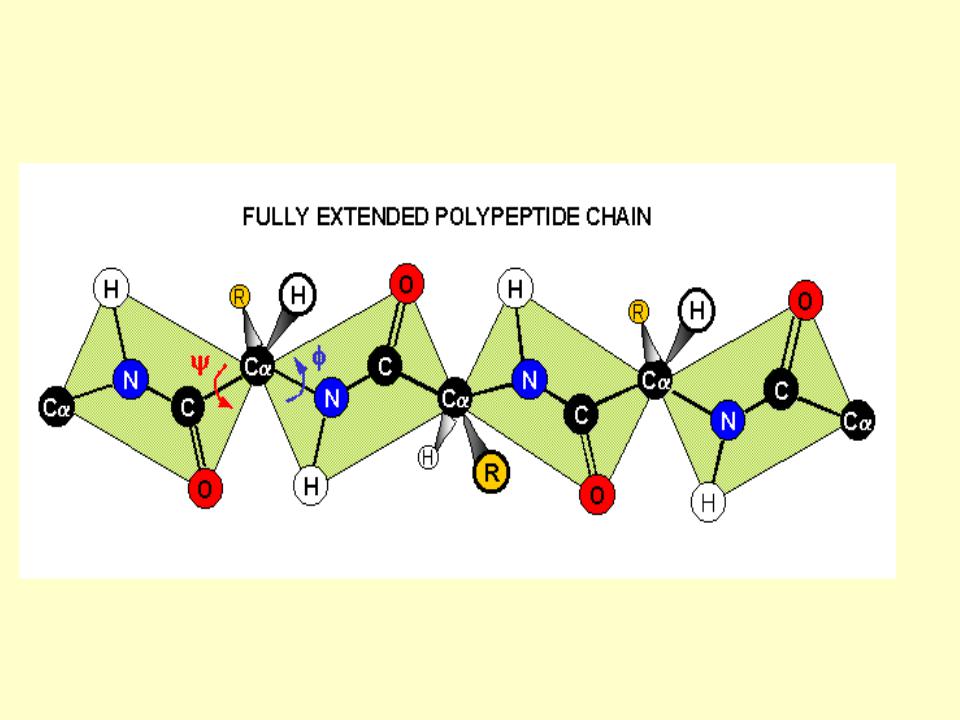
- •Вытянутая полипептидная цепь
- •Кислотно-основные свойства пептидов
- •Кислотно-основные свойства
- •Кислотно-основные свойства
- •Классификация и номенклатура пептидов
- •Биологическая и медицинская значимость пептидов
- •Классический синтез пептидов в растворе
- •Защищающие группы
- •Классический синтез дипептида ала-вал
- •продолжение синтеза
- •Твердофазный синтез пептидов
- •Основные функции пептидов
- •Строение окситоцина
- •Строение пенициллина
- •Фаллоидин из бледной поганки
- •Аспартам
- •Глутатион
- •глутатион
- •Нейропептиды
- •Инсулин
- •Препроинсулин
- •ВИДЫ ИНСУЛИНА
- •Белки
- •Силы и взаимодействия в структуре белков
- •Значение энергий связей и взаимодействий в белках
- •Уровни организации белковых молекул
- •Первичная структура белка – последовательность аминокислотных остатков, связанных пептидными связями
- •Вторичная структура –
- •АЛЬФА-СПИРАЛЬ
- •α-Спиральная конформация полипептидной цепи
- •Водородные
- •β-Структура (складчатый лист)
- •Конформация β-складчатого листа
- •Третичная структура – взаимное
- •В формировании третичной структуры белков участвуют типы связей:
- •ФОЛДИНГ
- •Фолдинг – физико-химический процесс формирования (пространственной укладки) полипептидной цепи, в ходе которого происходит
- •Шапероны (белки теплового шока)
- •Механизм:
- •Домены –области в третичной
- •Доменыд
- •ТРЕТИЧНАЯ СТРУКТУРА
- •Классы белков по третичной структуре
- •Четвертичная структура
- •Гемоглобин
- •Третичная структура миоглобина
- •Гем – производное протопорфирина
- •Кинетика насыщения гемоглобина кислородом
- •Денатурация
- •Факторы вызывающие денатурацию
- •Денатурация белка
- •Рибонуклеаза – фермент, гидролизующий РНК
- •отмывание реагентов
- •Классификация белков
- •По форме
- •по растворимости
- •Функции белков
- •Структурная (пластическая)
- •Каталитическая
- •Двигательная функция
- •Транспортная функция
- •Защитная функция
- •Регуляторная функция
- •Сигнальная функция
- •Энергетическая
- •Альфа - спираль
- •Ионное
- •СИЛЫ И ВЗАИМОДЕЙСТВИЯ
- •Ионное (электростатическое) взаимодействие
- •Третичная структура белка
- •Weak bonds and Structure
- •Строение пептида
- •Третичная структура α- субъединицы гемоглобина
- •Функции белка в организме

КафедраКафедрабиоорганическойбиоорганическойхимиихим иБГМУБГМУ
Тема лекции 10:
ПЕПТИДЫ, БЕЛКИ. УРОВНИ ОРГАНИЗАЦИИ БЕЛКОВЫХ МОЛЕКУЛ
Мемориал Л.Полинга в Колд Спринг Харбор

Пептиды и белки представляют
собой соединения, построенные из остатков -аминокислот,
соединенных пептидной (амидной связью)
Пептиды имеют в своей
структуре до 70 аминокислотных остатков

Полипептид в общем виде
|
|
|
|
|
O |
|
|
|
|
|
|
O |
|
|
|
|
|
|
O |
|
|
|
|
|
|
O |
|
|
|
|
|
|
O |
||||||||||||
HN |
|
|
CH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
C |
|
N |
|
|
CH |
|
C |
|
N |
|
|
CH |
|
C |
|
N |
|
CH |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
N |
|
CH |
|
C |
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R1 |
|
|
R2 |
|
|
R3 |
|
H |
|
R4 |
|
H |
|
R5 |
|||||||||||||||||||||||||||||
N-конец |
С-конец |
|
|
|
|
O |
|
|
|
|
|
O |
|
|
|
|
|
O |
|
|
||||||
H2N |
|
CH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
N |
|
CH |
|
C |
|
N |
|
CH |
|
C |
|
OH |
||||||||
|
|
|
|
|
|
|
|
|
||||||||||||||||
CH3 H CH2OH H CH2
аланилсерилтирозин
OH
Ala-Ser-Tyr

НАЗВАНИЯ НЕКОТОРЫХ АМИНОКИСЛОТНЫХ ОСТАТКОВ
Glu-глутамил
Gln-глутаминил
Asp-аспартил
Asn-аспарагинил
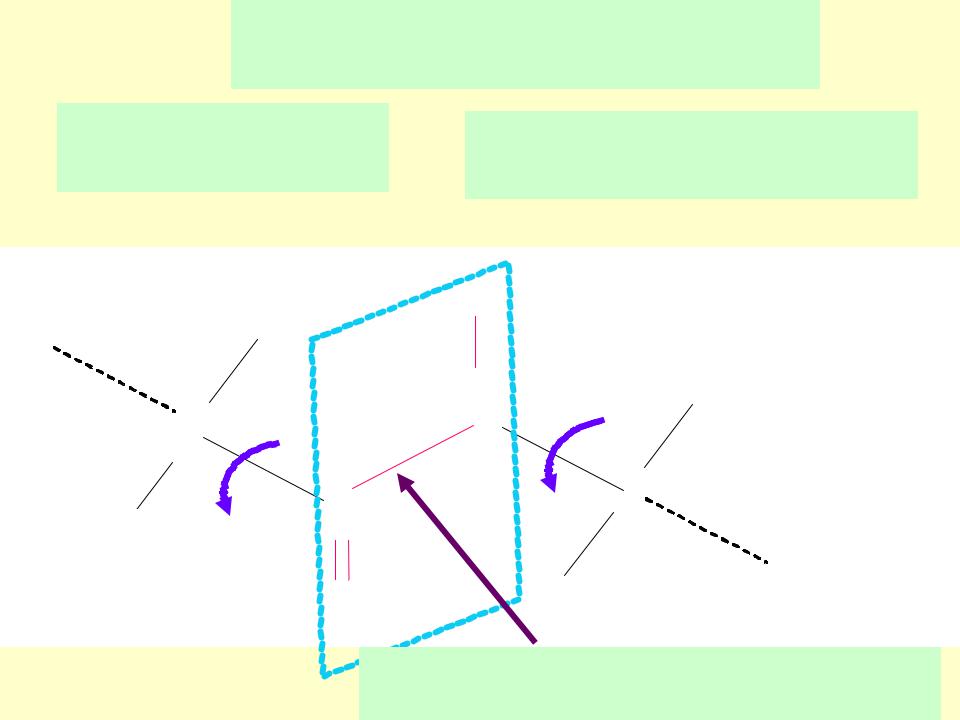
Пептидная связь
N,C - sp2 |
p-π-сопряжение |
H |
R |
H |
C-end |
|
0,132 нм |
N |
|||
С |
|
|||
|
|
|||
C |
|
C |
||
N-end |
|
|||
О |
H |
R |
||
|
|
вращение затруднено

В пептидной группе –CONH- атомы C, O, N в sp2 –гибридизации и лежат в одной плоскости
Неподеленная пара электронов атома N вступает в сопряжение с π- электронами двойной связи С=О (p-π- сопряжение)
Связь C–N становится короче , 0,132 нм против 0,147 нм; а связь С=О удлиняется до 0,124 нм против 0,121нм

Электронное строение предопределяет жесткую плоскостную
структуру пептидной группы.Барьер вращения равен 53-84 кДж/моль.
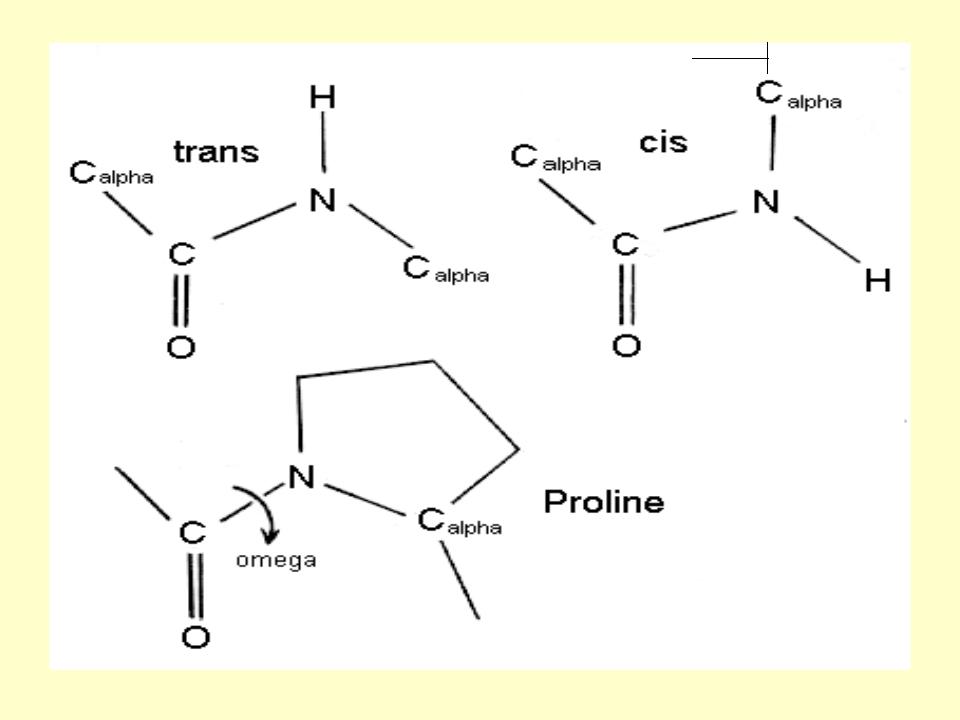
α-Атомы углерода находятся в
транс-положении
В полипептидной цепи плоскости пептидных групп расположены под
углом друг к другу и соединены между собой α-атомами углерода
|
0,38 нм |
|
|
|
|
0,28 нм |
|
||||||
|
|
|
|
|||
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R C =0,15нм