
- •2 Выбор технологических параметров процесса
- •2.1 Определение параметров конденсации
- •Далее средствами msExcelс помощью надстройки «Поиск решения» нужно подобрать истинную температуру начала конденсации при. В нашем случае она равна 50,00 °с.
- •2.2 Определение параметров вверху колонны
- •2.3 Определение параметров в зоне подачи сырья в колонну
- •2.4 Определение параметров в кубовой части колонны
- •3 Расчет минимального флегмового числа и числа теоретических тарелок
- •4 Оптимизация флегмового числа
- •5 Расчет числа действительных тарелок в колонне
- •6 Составление теплового баланса процесса ректификации и определение расхода греющего пара в кипятильнике
- •7 Определение диаметра колонны и расстояния между тарелками
- •8 Расчет гидравлического сопротивления тарелок с переливами
- •9 Проверка устойчивой работы тарелки
- •9.1 Укрепляющая часть
- •9.2 Исчерпывающая часть
- •10 Расчет высоты колонны
- •11 Выводы
Задание 28
Исходные данные:
1) Состав исходной смеси (питания), % мас.:
н-бутан – 30,00;
изопентан – 30,00;
н-пентан – 10,00;
н-гексан – 10,00;
н-гептан − 20,00.
2) Заданное содержание компонентов в дистилляте, % мас.:
н-гептан − 0,40
3) Заданное содержание компонентов в кубовом остатке, % мас.:
н-бутан − 0,00;
изопентан − 0,00;
н-пентан − 0,30;
н-гексан − 1,50.
4) Расход исходной смеси 15000 кг/ч.
В данной работе необходимо:
1) Составить материальный баланс процесса.
2) Выбрать режим работы колонны, выбрать подходящие холодный и горячий хладагенты.
3) Рассчитать по уравнениям Андервуда и Фенске минимальное флегмовое число и число теоретических тарелок в колонне.
4) Оптимизировать флегмовое число по методу Джиллиленда и найти оптимальное число теоретических тарелок, соответствующее этому флегмовому числу.
5) Рассчитать средний коэффициент полезного действия тарелки и определить действительное число тарелок.
6) Составить тепловой баланс процесса и определить расход греющего пара в кипятильнике.
7) Выбрать тип тарелки, определить диаметр обечайки колонны и расстояние между тарелками.
8) Проверить гидравлическое сопротивление и откорректировать расстояние между тарелками и диаметр колонны.
9) Выполнить эскиз тарельчатой ректификационной колонны в масштабе.
1 Расчет материального баланса ректификационной колонны
Материальный баланс составляется с целью определения количества и состава дистиллята и кубового остатка при заданной четкости разделения.
Для дальнейшего расчета необходимо выбрать пару ключевых компонентов: легкий ключевой компонент – н-гексан, тяжелый ключевой компонент – н-гептан.
В данном случае расчет материального баланса сводится к решению системы уравнений:
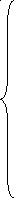
где
![]() – количество исходной смеси (питания),
кг/ч;
– количество исходной смеси (питания),
кг/ч;
![]() –количество
кубового остатка, кг/ч;
–количество
кубового остатка, кг/ч;
![]() –количество
дистиллята, кг/ч;
–количество
дистиллята, кг/ч;
![]() –содержание i-ого
компонента в питании, мас. дол.;
–содержание i-ого
компонента в питании, мас. дол.;
![]() –содержание i-ого
компонента в дистилляте, мас. дол.;
–содержание i-ого
компонента в дистилляте, мас. дол.;
![]() –содержание i-ого
компонента в кубовом остатке, мас. дол.
–содержание i-ого
компонента в кубовом остатке, мас. дол.
При подстановке в систему уравнений известных величин она упрощается до вида:
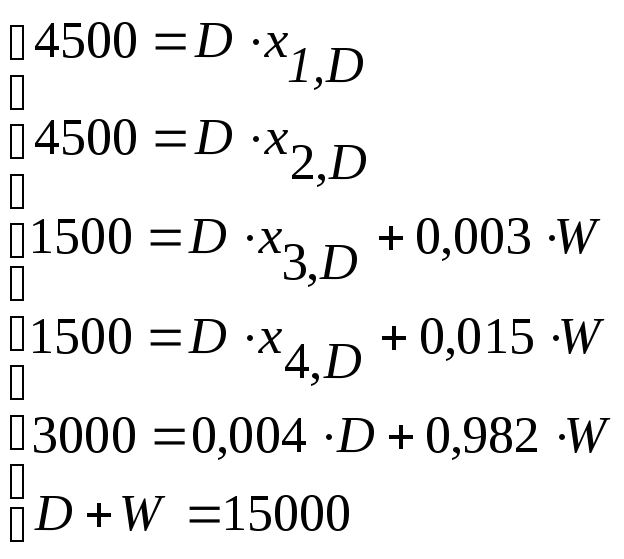
В результате расчета получаем:
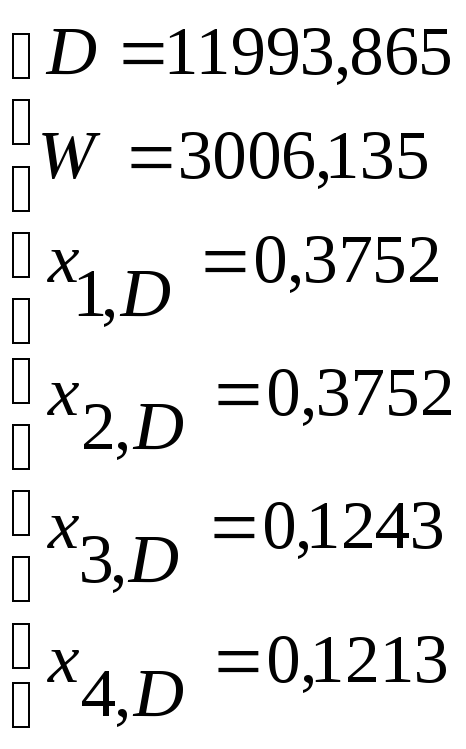
По рассчитанным значениям составов и количеств дистиллята и кубового остатка, а так же по известному составу питания составляем материальный баланс колонны, который представлен в таблице 1.
Таблица 1 – Материальный баланс процесса ректификации
|
Компонент |
Молярная масса, кг/кмоль |
Состав питания колонны | |||
|
массовый расход, кг/ч |
мас. доля |
мольный расход, кмоль/ч |
мол. доля | ||
|
н-бутан |
58,124 |
4500,00 |
0,3000 |
77,4207 |
0,3713 |
|
изопентан |
72,151 |
4500,00 |
0,3000 |
62,3692 |
0,2991 |
|
н-пентан |
72,151 |
1500,00 |
0,1000 |
20,7897 |
0,0997 |
|
н-гексан |
86,178 |
1500,00 |
0,1000 |
17,4058 |
0,0835 |
|
н-гептан |
98,189 |
3000,00 |
0,2000 |
30,5533 |
0,1465 |
|
Итого |
|
15000,00 |
1,0000 |
208,5388 |
1,0000 |
Продолжение таблицы 1
|
Компонент |
Состав дистиллята колонны | |||
|
массовый расход, кг/ч |
мас. доля |
мольный расход, кмоль/ч |
мол. доля | |
|
н-бутан |
4500,00 |
0,3752 |
77,4224 |
0,4354 |
|
изопентан |
4500,00 |
0,3752 |
62,3706 |
0,3507 |
|
н-пентан |
1490,84 |
0,1243 |
20,6627 |
0,1162 |
|
н-гексан |
1454,86 |
0,1213 |
16,8820 |
0,0949 |
|
н-гептан |
47,98 |
0,0040 |
0,4886 |
0,0027 |
|
Итого |
11993,87 |
1,0000 |
177,8263 |
1,0000 |
Окончание таблицы 1
|
Компонент |
Состав кубового остатка колонны | |||
|
массовый расход, кг/ч |
мас. доля |
мольный расход, кмоль/ч |
мол. доля | |
|
н-бутан |
0,00 |
0,0000 |
0,0000 |
0,0000 |
|
изопентан |
0,00 |
0,0000 |
0,0000 |
0,0000 |
|
н-пентан |
9,16 |
0,0030 |
0,1250 |
0,0041 |
|
н-гексан |
45,14 |
0,0150 |
0,5232 |
0,0170 |
|
н-гептан |
2952,02 |
0,9820 |
30,0647 |
0,9789 |
|
Итого |
3006,14 |
1,0000 |
30,7130 |
1,0000 |
Пересчет массовых долей компонентов смеси в мольные доли осуществляется по формуле:
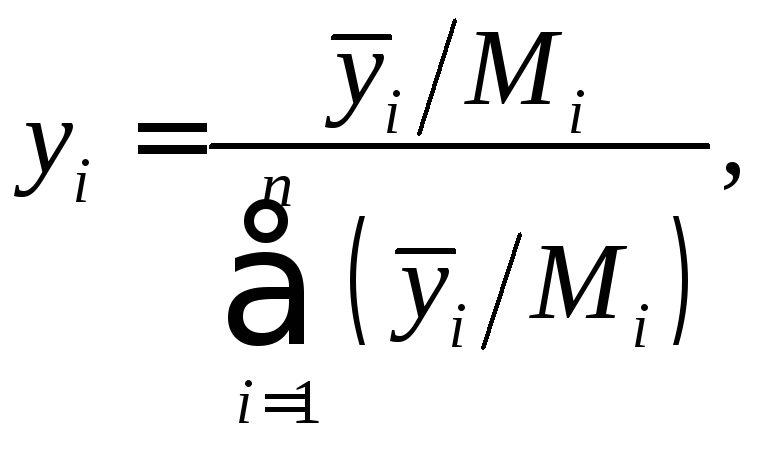 (1)
(1)
где
![]() – содержаниеi-го
компонента в паровой фазе, мол. дол.;
– содержаниеi-го
компонента в паровой фазе, мол. дол.;
![]() –содержание i-го
компонента в паровой фазе, мас. дол.;
–содержание i-го
компонента в паровой фазе, мас. дол.;
![]() –молярная масса
i-го
компонента, кг/кмоль.
–молярная масса
i-го
компонента, кг/кмоль.
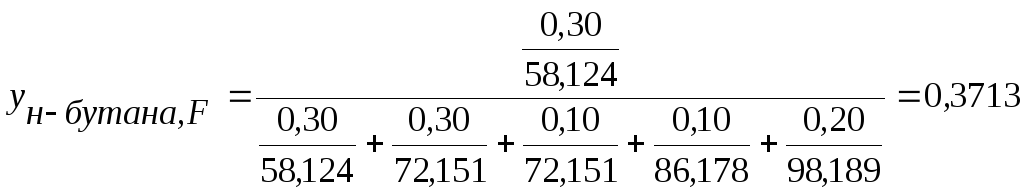
Расчет содержания остальных компонентов смеси в питании, дистилляте, кубовом остатке аналогичен, и результаты представлены в таблице 1.
2 Выбор технологических параметров процесса
2.1 Определение параметров конденсации
Выбираем в качестве хладагента промышленную оборотную воду с параметрами: начальная температура – 25 °С, конечная температура – 45 °С.
В таком случае температура конца конденсации составит:
![]() (2)
(2)
где
![]() – температура конца конденсации, °С;
– температура конца конденсации, °С;
![]() –конечная температура
хладагента, °С.
–конечная температура
хладагента, °С.
Принимаем температуру конца конденсации равной 50 °С.
По выбранной температуре рассчитываем давление конденсации с помощью уравнения изотермы жидкой фазы:
![]() (3)
(3)
где
![]() – содержаниеi-ого
компонента в дистилляте, мол. дол.;
– содержаниеi-ого
компонента в дистилляте, мол. дол.;
![]() –давление
насыщенного пара i-ого
компонента, МПа.
–давление
насыщенного пара i-ого
компонента, МПа.
Давление насыщенных паров компонентов в зависимости от температуры рассчитывается по уравнению Антуана [1]:
![]() (4)
(4)
где
![]() – давление насыщенных паровi-ого
компонента, мм рт. ст.;
– давление насыщенных паровi-ого
компонента, мм рт. ст.;
А, В, С – коэффициенты, индивидуальные для каждого вещества и работающие в определенном диапазоне температур;
t – температура процесса, °С.
Давление насыщенного пара изобутана по уравнению Антуана при температуре конца конденсации составит:
![]() мм рт. ст. = 0,4961 МПа.
мм рт. ст. = 0,4961 МПа.
Давления насыщенных паров остальных компонентов смеси рассчитываются аналогично и представлены в таблице 2.
Таблица 2 – Результаты расчета давления насыщенных паров компонентов смеси при температуре конца конденсации
|
Компонент |
Параметры уравнения Антуана
|
Давление
насыщенных паров
| ||
|
А, мм |
В |
С | ||
|
н-бутан |
6,9932 |
1030,3400 |
251,0410 |
0,4961 |
|
изопентан |
6,7896 |
1020,0120 |
233,0970 |
0,2049 |
|
н-пентан |
6,8737 |
1075,8160 |
233,3590 |
0,1592 |
|
н-гексан |
6,8777 |
1171,5300 |
224,3660 |
0,0540 |
|
н-гептан |
6,9002 |
1266,8710 |
216,7570 |
0,0189 |
Тогда давление конденсации составит:
|
|
МПа |
Далее рассчитываем температуру начала конденсации по уравнению изотермы паровой фазы:
![]() , (5)
, (5)
где ![]() – содержание i-ого
компонента в паре в верху колонны, мол.
дол.;
– содержание i-ого
компонента в паре в верху колонны, мол.
дол.;
ki – константа фазового равновесия i-ого компонента, которая рассчитывается по формуле:
![]() , (6)
, (6)
где
![]() – давление насыщенных паровi-ого
компонента смеси, МПа;
– давление насыщенных паровi-ого
компонента смеси, МПа;
![]() –давление конденсации,
МПа.
–давление конденсации,
МПа.
Константа фазового равновесия рассчитывается по формуле (6), при этом давления насыщенных паров, необходимые для ее расчета, определяются по уравнению Антуана (4) при температуре начала конденсации, которой предварительно необходимо задаться. Результаты расчета представлены в таблице 3.
Таблица 3 – Результаты расчета давления насыщенных паров и константы фазового равновесия при температуре начала конденсации
|
Компонент |
Параметры уравнения Антуана |
Давление
насыщенных паров
|
Константа
фазового равновесия
|
уiД/ki | ||
|
А, мм |
В |
С | ||||
|
н-бутан |
6,9932 |
1030,3400 |
251,0410 |
0,4961 |
2,5906 |
0,1681 |
|
изопентан |
6,7896 |
1020,0120 |
233,0970 |
0,2049 |
1,0698 |
0,3278 |
|
н-пентан |
6,8737 |
1075,8160 |
233,3590 |
0,1592 |
0,8313 |
0,1398 |
|
н-гексан |
6,8777 |
1171,5300 |
224,3660 |
0,0540 |
0,2822 |
0,3365 |
|
н-гептан |
6,9002 |
1266,8710 |
216,7570 |
0,0189 |
0,0986 |
0,0279 |
|
Сумма |
– |
– |
– |
– |
- |
1,0000 |
