
- •1. Алканы
- •Введение
- •1. Классификация органических соединений
- •2. Классификация органических реакций
- •3. Способы образования ковалентной связи
- •4. Гибридизация атомных орбиталей и форма органических молекул
- •4.1. Sp3-Гибридизация
- •4.2. Sр2-Гибридизация
- •4.3. Sp-Гибридизация
- •5. Алканы
- •Гомологический ряд алканов. Число структурных изомеров
- •5.1. Физические свойства
- •5.2. Химические свойства
- •5.2.1. Галогенирование
- •Зависимость реакционной способности галогенов от энергии связи h–Hal
- •5.2.2. Нитрование
- •5.3.4. Декарбоксилирование карбоновых кислот
- •6.2. Плоскополяризованный свет. Оптическая активность
- •6.3. Строение молекул и оптическая активность
- •6.4. Обозначение конфигураций
- •7. Циклоалканы
- •7.1 Номенклатура. Изомерия
- •7.2. Физические свойства
- •7.3. Типы напряжения
- •7.4. Строение
- •Теплоты сгорания и энергии напряжения циклоалканов
- •7.4.1. Особенности пространственного строения некоторых циклоалканов
- •7.5. Химические свойства
- •7.6. Способы получения
- •8.1. Физические свойства
- •Физические свойства алкенов
- •8.2. Химические свойства
- •8.2.1. Присоединение галогенов
- •8.2.1.1. Механизм реакции
- •8.2.1.2. Реакционная способность галогенов в реакции АdЕ
- •8.2.2. Присоединение галогеноводородов
- •8.2.2.1. Механизм реакции
- •8.2.2.2. Направление электрофильного присоединения
- •8.2.2.3. Реакционная способность и селективность
- •8.2.2.4. Перегруппировка
- •Механизм реакции
- •8.2.3. Присоединение бромистого водорода в присутствии
- •1. Инициирование:
- •2. Рост цепи:
- •3. Обрыв цепи:
- •8.2.4. Присоединение серной кислоты
- •8.2.5. Гидратация алкенов. Присоединение спиртов
- •8.2.6. Гидроборирование алкенов
- •8.2.7. Алкилирование алкенов
- •8.2.8. Гидрирование. Теплота гидрирования
- •8.2.9. Теплота гидрирования и устойчивость алкенов
- •8.2.10. Окисление
- •8.2.11. Полимеризация алкенов
- •8.2.12. Реакция аллильного замещения. Галогенирование
- •8.3. Способы получения алкенов
- •9.1. Устойчивость сопряженных диенов
- •9.2. Химические свойства
- •9.2.1. Электрофильное присоединение
- •9.2.2. 1,2- И 1,4-Присоединение. Кинетический контроль, термодинамический контроль
- •9.2.3. Диеновый синтез. Реакция Дильса-Альдера
- •9.2.4. Полимеризация
- •9.3. Способы получения
- •10. Алкины
- •Характеристики химических связей в молекуле алкинов
- •10.1. Физические свойства
- •10.2. Химические свойства
- •10.2.1. Реакции присоединеня
- •10.2.1.1. Каталитическое гидрирование и восстановление
- •10.2.1.2. Реакции электрофильного присоединения Галогенирование
- •Гидрогалогенирование
- •Гидратация
- •10.2.1.3. Нуклеофильное присоединение
- •10.2.2. Кислотность алкинов
- •Константы кислотности некоторых соединений
- •10.2.3. Взаимодействие алкинов с карбонильными соединениями
- •10.2.4. Окисление алкинов
- •10.2.5. Радикальное присоединение бромоводорода
- •10.3. Способы получения
- •11. Арены
- •11.1. Сравнение свойств бензола со свойствами алкенов
- •11.2. Теплота гидрирования. Энергия резонанса
- •11.3. Строение бензола
- •11.4. Ароматичность
- •11.5. Физические свойства
- •Физические свойства аренов
- •11.6. Химические свойства
- •11.6.1. Электрофильное замещение
- •11.6.2. Свободнорадикальное замещение в боковой цепи аренов
- •11.6.3. Реакции окисления
- •11.7. Методы синтеза аренов
- •12.1. Влияние заместителей на реакционную способность бензольного кольца
- •12.2. Влияние заместителя на выбор места электрофильной атаки
- •13. Многоядерные ароматические соединения
- •13.1. Нафталин
- •13.2. Антрацен и фенантрен
- •14. Гетероциклические соединения
- •14.1. Пятичленные гетероциклы
- •14.1.1. Строение
- •14.1.2. Химические свойства
- •14.1.3. Способы получения
- •14.2. Пиридин
- •14.2.1. Строение пиридина
- •14.2.2. Химические свойства
- •14.3. Хинолин
- •15. Галогеналканы
- •15.1. Нуклеофильное замещение
- •15.1.1. Бимолекулярное нуклеофильное замещение
- •15.1.2. Мономолекулярное нуклеофильное замещение
- •15.1.3. Сравнение реакций sn 1 и sn 2
- •15.2. Реакции отщепления (элиминирование)
- •15.2.1. Бимолекулярное отщепление е2
- •15.2.2. Мономолекулярное отщепление е1
- •15.2.3. Сравнение реакций нуклеофильного замещения и элиминирования
- •15.3. Методы синтеза галогеналканов
- •16.2. Нуклеофильное замещение, протекающее через стадию образования дегидробензола, - отщепление - присоединение
- •16.3. Бимолекулярное нуклеофильное замещение sn2Ar
- •16.4. Ориентация при нуклеофильном замещении в ароматическом кольце
- •17. Магнийорганические соединения
- •17.1. Получение и строение магнийорганических соединений
- •17.2. Синтез спиртов и кислот
- •Библиографический список
- •Оглавление
- •Часть 1
6.2. Плоскополяризованный свет. Оптическая активность
Свет представляет собой волну, электромагнитные колебания которой происходят в различных плоскостях. Плоскополяризованный свет - это свет, колебания которого совершаются только в одной плоскости. Обычный свет превращают в плоскополяризованный, пропуская его через поляризатор - призму Николя.
Вещество, которое вращает плоскость поляризованного света, является оптически активным или оптически деятельным.
Оптическую активность вещества можно обнаружить и измерить с помощью поляриметра.
Два энантиомера вращают плоскость поляризованного света на одинаковый угол, но в противоположных направлениях.
6.3. Строение молекул и оптическая активность
Проходя через отдельную молекулу, луч поляризованного света взаимодействует с заряженными частями молекулы. Плоскость его при этом поворачивается. В огромном числе беспорядочно ориентированных молекул вещества, не обладающего хиральностью, для каждой молекулы, взаимодействующей с лучом, найдется такая же молекула, которая будет ориентирована, как зеркальное изображение первой. Она, взаимодействуя с лучом, поворачивает плоскость поляризованного света на такой же по величине угол с противоположным знаком, т.е. компенсирует эффект первой. В результате вращения плоскости поляризованного света не наблюдается, вещество оптически неактивно. Таким образом, отдельная молекула взаимодействует с лучом света, но соединение в целом оказывается оптически недеятельным.
Если вещество обладает хиральностью и состоит из единого энантиомера, то ни одна молекула не может быть зеркальным изображением другой. Зеркальное изображение - это другое вещество, его энантиомер. Вращение поляризованного света отдельными молекулами не компенсируется друг другом, и в результате наблюдается оптическая активность.
6.4. Обозначение конфигураций
Для этой цели наиболее широко используют символы R и S. Эта система обозначений предложена Р. Каном (Химическое общество, Лондон), К. Ингольдом (Университетский колледж, Лондон) и В. Прелогом (Федеральная высшая техническая школа, Цюрих).
Согласно этой системе, сначала определяют старшинство, или последовательность, заместителей, т. е. четырех атомов или групп, связанных с асимметрическим атомом углерода, исходя из правила старшинства.
Правило старшинства 1. Если с асимметрическим атомом углерода связаны четыре различных атома, то старшинство зависит от атомного номера, причем более старшим будет атом с большим атомным номером. Если два атома являются изотопами одного элемента, то преимущество имеет атом с большим массовым числом. Например, в хлориодметансульфокислоте атомы, согласно их старшинству, располагаются в следующей последовательности: I > С1 > S > Н; в -дейтероэтилбромиде – Вг > С > О > Н.

Правило старшинства 2. Если относительное старшинство групп нельзя определить с помощью правила 1, то необходимо провести аналогичное сравнение для следующих атомов в группах (и так далее, если необходимо, двигаясь дальше от асимметрического атома углерода). Иначе говоря, если асимметрический атом углерода связан с одинаковыми атомами, то следует сравнить заместители, связанные с каждым из этих первых атомов. Например, рассмотрим втор-бутилхлорид, в котором с асимметрическим атомом углерода связаны два углеродных атома. В СН3-группе следующими атомами являются Н, Н и Н; в С2Н5-группе – С, Н, Н.

Поскольку углерод имеет больший атомный номер, чем водород, то С2Н5 старше. Таким образом, во втор-бутилхлориде заместители, согласно своему старшинству, располагаются следующим образом: С1 > С2Н5 > СН3 > Н.
В З-хлор-2-метилпентане атомы С, С и Н изопропильной группы старше С, Н и Н этильной группы и полная последовательность заместителей будет следующей: С1 > изопропил > этил > Н.
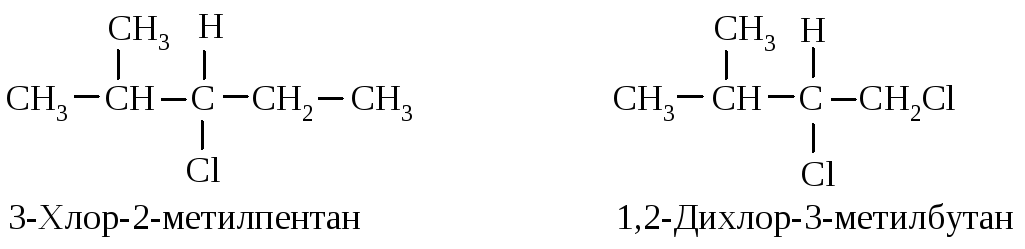
В 1,2-дихлор-З-метилбутане группа СН2Cl старше (С1, Н, Н) изопропильной (С, С, Н). Хлор имеет больший атомный номер, чем углерод, и то, что имеется два атома углерода и только один С1, не имеет значения. (Один больший номер значит больше, чем два или три меньших.)
Правило старшинства 3. Атом, связанный двойной или тройной связью, считается соответственно за два или три атома. Таким образом,

Например, в глицериновом альдегиде ОН-группа является старшей; СНО (О, О, Н) старше СН2ОН (О, Н, Н). Полная последовательность заместителей будет –ОН > –СНО > –СН2ОН > –Н.

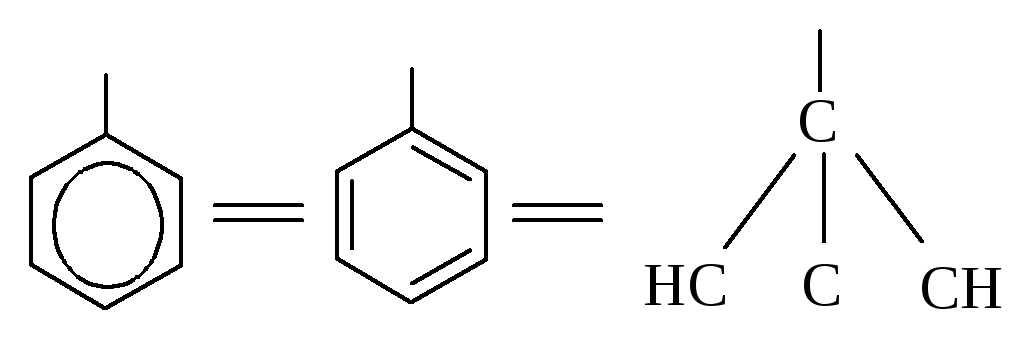
Фенильная группа С6Н5 рассматривается в виде одной из структур Кекуле:
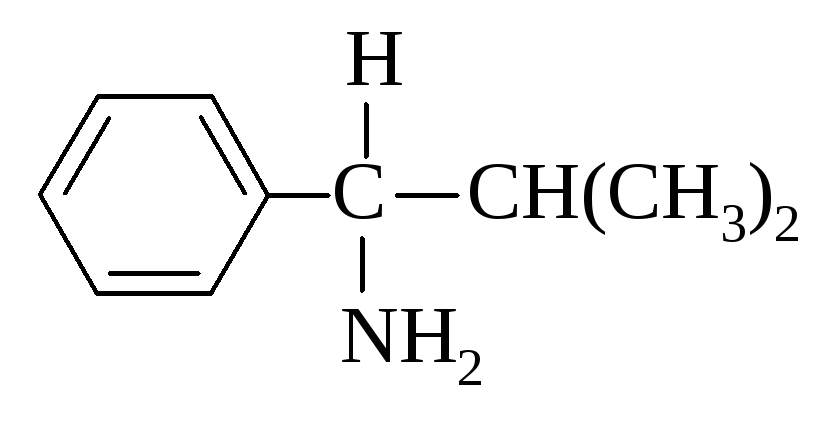
В 1-амино-2-метил-1-фенилпропане, например, фенильная группа (С, С, С) старше изопропильной (С, С, Н), но младше, чем N, который имеет больший атомный номер. Последовательность будет NН2 > С6Н5 > С3Н7 > Н.
[Согласно
правилу, оба атома кратной связи
удваиваются (или утраиваются),
так что С=О становится
![]() .
Это более простое,
но менее
точное правило достаточно для
рассматриваемых примеров.]
.
Это более простое,
но менее
точное правило достаточно для
рассматриваемых примеров.]
Например, в случае СНСlВгI с асимметрическим атомом углерода связаны четыре различных атома, и старшинство их зависит только от атомного номера, причем, чем больше атомный номер, тем старше заместитель. Таким образом, в порядке уменьшения их старшинства атомы располагаются в следующем порядке: I > Вг > С1 > Н.

Затем молекулу располагают, так, чтобы младшая группа была направлена от наблюдателя, и рассматривают расположение оставшихся групп. Если старшинство этих групп уменьшается по часовой стрелке, то конфигурацию обозначают символом R (от латинского rectus – правый); если же старшинство этих групп уменьшается против часовой стрелки, то конфигурацию обозначают символом S (от латинского sinister – левый).
Таким образом, конфигурации I и II выглядят следующим образом:

и обозначаются соответственно символами R и S.
Полное название оптически активного соединения отражает и конфигурацию и направление вращения, как, например, (S)-(+)-втор-бутилхлорид. Рацемическую модификацию можно обозначить символом R,S, например (R,S)-втор-бутилхлорид.
Конечно, нельзя путать направление оптического вращения соединения (такого же физического свойства реального вещества, как температура кипения или плавления) с направлением нашего взгляда, когда мы мысленно располагаем молекулу каким-то определенным условным образом. Пока для определенного соединения экспериментально не установлена связь между конфигурацией и знаком вращения, нельзя сказать, знак (+) или (–) соответствует (R)- или (S)-конфигурации.
