
- •1. Алканы
- •Введение
- •1. Классификация органических соединений
- •2. Классификация органических реакций
- •3. Способы образования ковалентной связи
- •4. Гибридизация атомных орбиталей и форма органических молекул
- •4.1. Sp3-Гибридизация
- •4.2. Sр2-Гибридизация
- •4.3. Sp-Гибридизация
- •5. Алканы
- •Гомологический ряд алканов. Число структурных изомеров
- •5.1. Физические свойства
- •5.2. Химические свойства
- •5.2.1. Галогенирование
- •Зависимость реакционной способности галогенов от энергии связи h–Hal
- •5.2.2. Нитрование
- •5.3.4. Декарбоксилирование карбоновых кислот
- •6.2. Плоскополяризованный свет. Оптическая активность
- •6.3. Строение молекул и оптическая активность
- •6.4. Обозначение конфигураций
- •7. Циклоалканы
- •7.1 Номенклатура. Изомерия
- •7.2. Физические свойства
- •7.3. Типы напряжения
- •7.4. Строение
- •Теплоты сгорания и энергии напряжения циклоалканов
- •7.4.1. Особенности пространственного строения некоторых циклоалканов
- •7.5. Химические свойства
- •7.6. Способы получения
- •8.1. Физические свойства
- •Физические свойства алкенов
- •8.2. Химические свойства
- •8.2.1. Присоединение галогенов
- •8.2.1.1. Механизм реакции
- •8.2.1.2. Реакционная способность галогенов в реакции АdЕ
- •8.2.2. Присоединение галогеноводородов
- •8.2.2.1. Механизм реакции
- •8.2.2.2. Направление электрофильного присоединения
- •8.2.2.3. Реакционная способность и селективность
- •8.2.2.4. Перегруппировка
- •Механизм реакции
- •8.2.3. Присоединение бромистого водорода в присутствии
- •1. Инициирование:
- •2. Рост цепи:
- •3. Обрыв цепи:
- •8.2.4. Присоединение серной кислоты
- •8.2.5. Гидратация алкенов. Присоединение спиртов
- •8.2.6. Гидроборирование алкенов
- •8.2.7. Алкилирование алкенов
- •8.2.8. Гидрирование. Теплота гидрирования
- •8.2.9. Теплота гидрирования и устойчивость алкенов
- •8.2.10. Окисление
- •8.2.11. Полимеризация алкенов
- •8.2.12. Реакция аллильного замещения. Галогенирование
- •8.3. Способы получения алкенов
- •9.1. Устойчивость сопряженных диенов
- •9.2. Химические свойства
- •9.2.1. Электрофильное присоединение
- •9.2.2. 1,2- И 1,4-Присоединение. Кинетический контроль, термодинамический контроль
- •9.2.3. Диеновый синтез. Реакция Дильса-Альдера
- •9.2.4. Полимеризация
- •9.3. Способы получения
- •10. Алкины
- •Характеристики химических связей в молекуле алкинов
- •10.1. Физические свойства
- •10.2. Химические свойства
- •10.2.1. Реакции присоединеня
- •10.2.1.1. Каталитическое гидрирование и восстановление
- •10.2.1.2. Реакции электрофильного присоединения Галогенирование
- •Гидрогалогенирование
- •Гидратация
- •10.2.1.3. Нуклеофильное присоединение
- •10.2.2. Кислотность алкинов
- •Константы кислотности некоторых соединений
- •10.2.3. Взаимодействие алкинов с карбонильными соединениями
- •10.2.4. Окисление алкинов
- •10.2.5. Радикальное присоединение бромоводорода
- •10.3. Способы получения
- •11. Арены
- •11.1. Сравнение свойств бензола со свойствами алкенов
- •11.2. Теплота гидрирования. Энергия резонанса
- •11.3. Строение бензола
- •11.4. Ароматичность
- •11.5. Физические свойства
- •Физические свойства аренов
- •11.6. Химические свойства
- •11.6.1. Электрофильное замещение
- •11.6.2. Свободнорадикальное замещение в боковой цепи аренов
- •11.6.3. Реакции окисления
- •11.7. Методы синтеза аренов
- •12.1. Влияние заместителей на реакционную способность бензольного кольца
- •12.2. Влияние заместителя на выбор места электрофильной атаки
- •13. Многоядерные ароматические соединения
- •13.1. Нафталин
- •13.2. Антрацен и фенантрен
- •14. Гетероциклические соединения
- •14.1. Пятичленные гетероциклы
- •14.1.1. Строение
- •14.1.2. Химические свойства
- •14.1.3. Способы получения
- •14.2. Пиридин
- •14.2.1. Строение пиридина
- •14.2.2. Химические свойства
- •14.3. Хинолин
- •15. Галогеналканы
- •15.1. Нуклеофильное замещение
- •15.1.1. Бимолекулярное нуклеофильное замещение
- •15.1.2. Мономолекулярное нуклеофильное замещение
- •15.1.3. Сравнение реакций sn 1 и sn 2
- •15.2. Реакции отщепления (элиминирование)
- •15.2.1. Бимолекулярное отщепление е2
- •15.2.2. Мономолекулярное отщепление е1
- •15.2.3. Сравнение реакций нуклеофильного замещения и элиминирования
- •15.3. Методы синтеза галогеналканов
- •16.2. Нуклеофильное замещение, протекающее через стадию образования дегидробензола, - отщепление - присоединение
- •16.3. Бимолекулярное нуклеофильное замещение sn2Ar
- •16.4. Ориентация при нуклеофильном замещении в ароматическом кольце
- •17. Магнийорганические соединения
- •17.1. Получение и строение магнийорганических соединений
- •17.2. Синтез спиртов и кислот
- •Библиографический список
- •Оглавление
- •Часть 1
Зависимость реакционной способности галогенов от энергии связи h–Hal
|
Энергия связи H–Hal, кДж/моль |
H–F 560 |
|
H–Cl 431 |
|
H–Br 364 |
|
H–I 297 |
|
Реакционная способность |
F2 |
> |
Cl2 |
> |
Br2 |
> |
(I2) не реагирует |
Галогенирование высших алканов. Механизм
Галогенирование алканов протекает по такому же механизму, как и галогенирование метана.
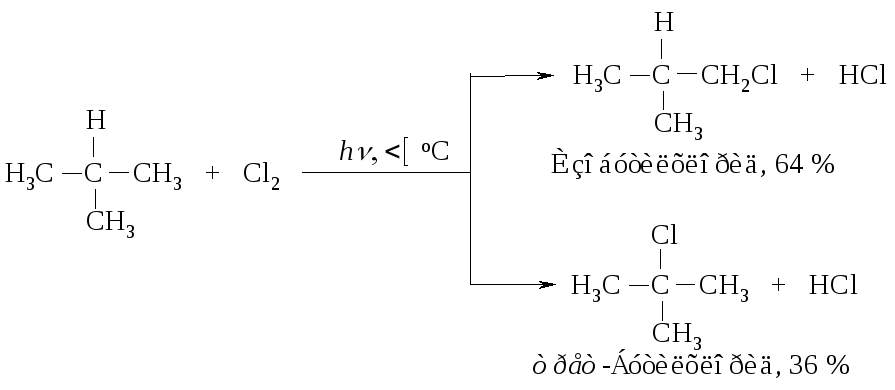
Рассмотрим механизм хлорирования изобутана.
![]()

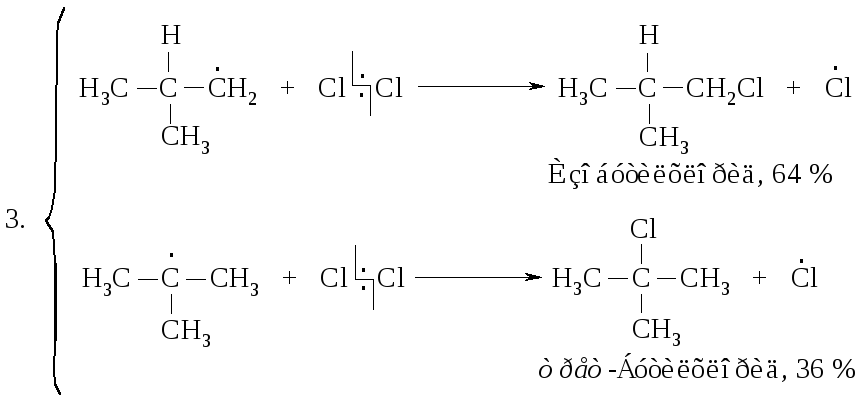
Затем (2), (3), (2), (3)... до обрыва цепи. Стадии обрыва цепи напишите самостоятельно.
Бромирование изобутана приводит к соответствующим бромидам, но в другом соотношении.
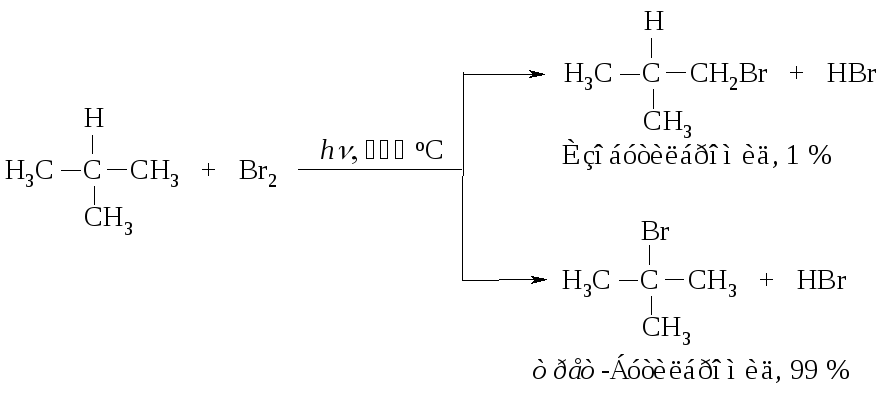
Объясните, почему для реакции бромирования необходима более высокая температура.
Частота столкновений атома галогена с молекулой изобутана одна и та же для обоих превращений. В молекуле изобутана девять первичных и только один третичный. Если бы все атомы водорода обладали одинаковой реакционной способностью по отношению к атому галогена, то первичные атомы реагировали бы в девять раз чаще, чем третичные. Фактор вероятности благоприятствует образованию изобутилхлорида и трет-бутилхлорида в соотношении 9:1. Экспериментальные данные дают соотношение 1,8:1 или 9:5. Это означает, что результативных столкновений атомов хлора с третичным атомом водорода в пять раз больше, чем с первичным. Следовательно, энергия активации для отщепления третичного атома меньше, чем для отщепления первичного.
Образование третичного радикала более экзотермично, протекает с меньшей энергией активации. Это связано с меньшей затратой энергии на разрыв третичной связи C–H по сравнению с первичной связью C–H.
Подобным образом сравнение количеств изомеров, образующихся при хлорировании алканов, содержащих первичные и вторичные атомы водорода, позволяет сделать вывод о том, что вторичный радикал образуется легче, чем первичный.
Следовательно, относительная легкость отщепления атомов водорода такова: третичный > вторичный > первичный > Н–СН3.
Ряд легкости образования радикалов изменяется в порядке: третичный вторичный первичный CH3.
Сопоставление энергий, необходимых для отрыва третичного, вторичного, первичного и HCH3 атомов водорода от молекулы R-H, показывает: для отрыва третичного атома водорода требуется меньше энергии, чем для отрыва вторичного и т.д. Это означает, что устойчивость третичного радикала по отношению к его родоначальному углеводороду выше устойчивости вторичного радикала и т.д. Отсюда выводим ряд устойчивости радикалов: третичный вторичный первичный СН3.
Легкость образования радикалов соответствует порядку изменения устойчивости радикалов. Чем устойчивее радикал, тем легче он образуется.
Различная устойчивость радикалов обусловлена делокализацией неспаренного электрона в результате его взаимодействия с электронами СН-связей соседних атомов углерода.
Бромирование протекает с высокой избирательностью, относительные скорости замещения первичного, вторичного и третичного атомов водорода имеют такие значения: 1:82:1600. При атаке молекулы углеводорода малореакционноспособным атомом брома переходное состояние достигается поздно, оно имеет радикальный характер. Факторы, стабилизирующие свободные радикалы, в такой же степени стабилизируют переходные состояния, а это означает, что различие в энергиях активации и скоростях образования первичного, вторичного и третичного радикалов достаточно большое.
При атаке молекулы углеводорода реакционноспособным атомом хлора переходное состояние достигается рано, алкильная группа имеет незначительный свободнорадикальный характер. Факторы, стабилизирующие радикалы, не проявляются в заметной степени в переходном состоянии, следовательно, различие в энергиях активации и скоростях образования первичного, вторичного и третичного радикалов невелико (относительные скорости 1:3,8:5). Реакция протекает с низкой степенью селективности.
Чем меньше реакционная способность реагента, тем больше его избирательность.
Расчет состава продуктов галогенирования алканов.
![]()
Общая активность первичных атомов водорода равна 16=6, вторичных составляет 3,84=15,2. Активность всех атомов водорода равна 6+15,2=21,2 и принимается за 100 %. Массовая доля 1-хлорбутана в продуктах реакции составляет 6:21,2100=28,3 %, массовая доля 2-хлорбутана равна 15,2:21,2100= 71,7 %.
Расчет относительной реакционной способности первичного и вторичного атомов водорода:
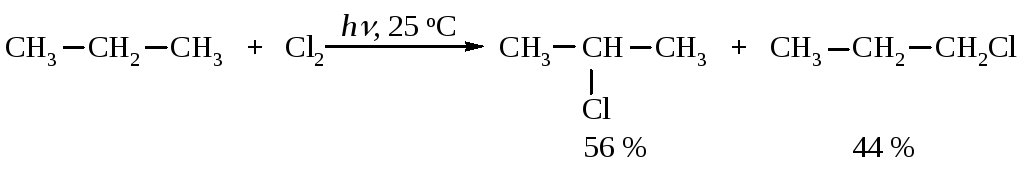
Отношение активностей первичного и вторичного атомов водорода 44/6: 56/2=7,33/28=1/3,8.
