- •1. Алканы
- •Введение
- •1. Классификация органических соединений
- •2. Классификация органических реакций
- •3. Способы образования ковалентной связи
- •4. Гибридизация атомных орбиталей и форма органических молекул
- •4.1. Sp3-Гибридизация
- •4.2. Sр2-Гибридизация
- •4.3. Sp-Гибридизация
- •5. Алканы
- •Гомологический ряд алканов. Число структурных изомеров
- •5.1. Физические свойства
- •5.2. Химические свойства
- •5.2.1. Галогенирование
- •Зависимость реакционной способности галогенов от энергии связи h–Hal
- •5.2.2. Нитрование
- •5.3.4. Декарбоксилирование карбоновых кислот
- •6.2. Плоскополяризованный свет. Оптическая активность
- •6.3. Строение молекул и оптическая активность
- •6.4. Обозначение конфигураций
- •7. Циклоалканы
- •7.1 Номенклатура. Изомерия
- •7.2. Физические свойства
- •7.3. Типы напряжения
- •7.4. Строение
- •Теплоты сгорания и энергии напряжения циклоалканов
- •7.4.1. Особенности пространственного строения некоторых циклоалканов
- •7.5. Химические свойства
- •7.6. Способы получения
- •8.1. Физические свойства
- •Физические свойства алкенов
- •8.2. Химические свойства
- •8.2.1. Присоединение галогенов
- •8.2.1.1. Механизм реакции
- •8.2.1.2. Реакционная способность галогенов в реакции АdЕ
- •8.2.2. Присоединение галогеноводородов
- •8.2.2.1. Механизм реакции
- •8.2.2.2. Направление электрофильного присоединения
- •8.2.2.3. Реакционная способность и селективность
- •8.2.2.4. Перегруппировка
- •Механизм реакции
- •8.2.3. Присоединение бромистого водорода в присутствии
- •1. Инициирование:
- •2. Рост цепи:
- •3. Обрыв цепи:
- •8.2.4. Присоединение серной кислоты
- •8.2.5. Гидратация алкенов. Присоединение спиртов
- •8.2.6. Гидроборирование алкенов
- •8.2.7. Алкилирование алкенов
- •8.2.8. Гидрирование. Теплота гидрирования
- •8.2.9. Теплота гидрирования и устойчивость алкенов
- •8.2.10. Окисление
- •8.2.11. Полимеризация алкенов
- •8.2.12. Реакция аллильного замещения. Галогенирование
- •8.3. Способы получения алкенов
- •9.1. Устойчивость сопряженных диенов
- •9.2. Химические свойства
- •9.2.1. Электрофильное присоединение
- •9.2.2. 1,2- И 1,4-Присоединение. Кинетический контроль, термодинамический контроль
- •9.2.3. Диеновый синтез. Реакция Дильса-Альдера
- •9.2.4. Полимеризация
- •9.3. Способы получения
- •10. Алкины
- •Характеристики химических связей в молекуле алкинов
- •10.1. Физические свойства
- •10.2. Химические свойства
- •10.2.1. Реакции присоединеня
- •10.2.1.1. Каталитическое гидрирование и восстановление
- •10.2.1.2. Реакции электрофильного присоединения Галогенирование
- •Гидрогалогенирование
- •Гидратация
- •10.2.1.3. Нуклеофильное присоединение
- •10.2.2. Кислотность алкинов
- •Константы кислотности некоторых соединений
- •10.2.3. Взаимодействие алкинов с карбонильными соединениями
- •10.2.4. Окисление алкинов
- •10.2.5. Радикальное присоединение бромоводорода
- •10.3. Способы получения
- •11. Арены
- •11.1. Сравнение свойств бензола со свойствами алкенов
- •11.2. Теплота гидрирования. Энергия резонанса
- •11.3. Строение бензола
- •11.4. Ароматичность
- •11.5. Физические свойства
- •Физические свойства аренов
- •11.6. Химические свойства
- •11.6.1. Электрофильное замещение
- •11.6.2. Свободнорадикальное замещение в боковой цепи аренов
- •11.6.3. Реакции окисления
- •11.7. Методы синтеза аренов
- •12.1. Влияние заместителей на реакционную способность бензольного кольца
- •12.2. Влияние заместителя на выбор места электрофильной атаки
- •13. Многоядерные ароматические соединения
- •13.1. Нафталин
- •13.2. Антрацен и фенантрен
- •14. Гетероциклические соединения
- •14.1. Пятичленные гетероциклы
- •14.1.1. Строение
- •14.1.2. Химические свойства
- •14.1.3. Способы получения
- •14.2. Пиридин
- •14.2.1. Строение пиридина
- •14.2.2. Химические свойства
- •14.3. Хинолин
- •15. Галогеналканы
- •15.1. Нуклеофильное замещение
- •15.1.1. Бимолекулярное нуклеофильное замещение
- •15.1.2. Мономолекулярное нуклеофильное замещение
- •15.1.3. Сравнение реакций sn 1 и sn 2
- •15.2. Реакции отщепления (элиминирование)
- •15.2.1. Бимолекулярное отщепление е2
- •15.2.2. Мономолекулярное отщепление е1
- •15.2.3. Сравнение реакций нуклеофильного замещения и элиминирования
- •15.3. Методы синтеза галогеналканов
- •16.2. Нуклеофильное замещение, протекающее через стадию образования дегидробензола, - отщепление - присоединение
- •16.3. Бимолекулярное нуклеофильное замещение sn2Ar
- •16.4. Ориентация при нуклеофильном замещении в ароматическом кольце
- •17. Магнийорганические соединения
- •17.1. Получение и строение магнийорганических соединений
- •17.2. Синтез спиртов и кислот
- •Библиографический список
- •Оглавление
- •Часть 1
5. Алканы
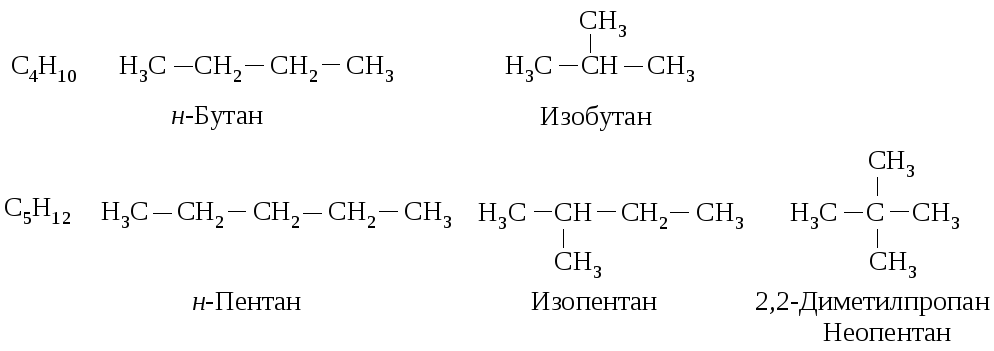
Алканами называются углеводороды с открытой цепью, имеющие общую формулу CnH2n+2 и содержащие только простые углерод-углеродные связи. Алканы образуют гомологический ряд, в котором каждый член отличается от предыдущего на постоянную структурную единицу (CH2) , называемую гомологической разностью.
Таблица 5.1
Гомологический ряд алканов. Число структурных изомеров
|
Число атомов |
Название, формула |
Число изомеров | |
|
1 |
Метан |
СН4 |
1 |
|
2 |
Этан |
C2H6 |
1 |
|
3 |
Пропан |
C3H8 |
1 |
|
4 |
Бутан |
С4Н10 |
2 |
|
5 |
Пентан |
С5Н12 |
3 |
|
6 |
Гексан |
С6Н14 |
5 |
|
7 |
Гептан |
С7Н16 |
9 |
|
8 |
Октан |
С8Н18 |
18 |
|
9 |
Нонан |
С9Н20 |
35 |
|
10 |
Декан |
С10Н22 |
75 |
Изомеры - это соединения, имеющие одинаковый состав, но различное строение и вследствие этого разные физико-химические свойства.
Существуют структурные и пространственные изомеры (стереоизомеры).
Структурные изомеры - это соединения, имеющие одинаковый состав, но различную последовательность связывания атомов.
Пространственными изомерами называются соединения, в которых одинаковые состав и способ связывания атомов, но различное расположение атомов в пространстве.
Первые три члена гомологического ряда не имеют изомеров. Число структурных изомеров последующих гомологов, начиная с бутана, растет очень быстро с увеличением атомов углерода в молекуле (см. табл. 5.1). Эмпирической формуле С4Н10 соответствуют два структурных изомера, а формуле С5Н10 – три
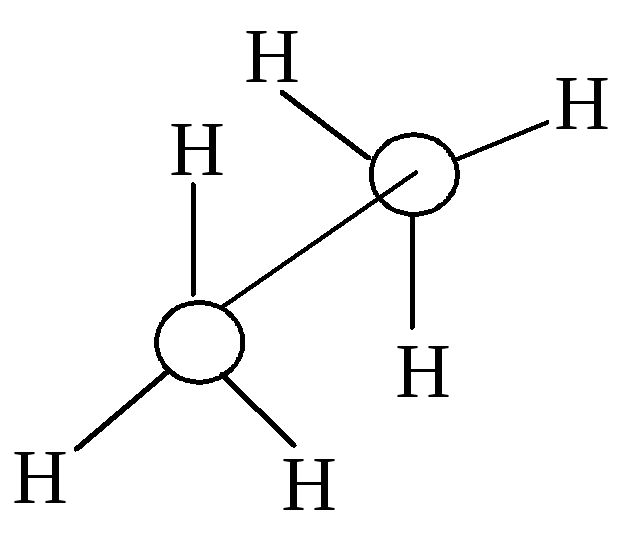
Атом углерода в метане находится в sp3 - гибридном состоянии. Гибридные орбитали имеют большую степень направленности, чем негибридизованные s- и р- орбитали, и в результате большего перекрывания с орбиталями соседнего атома дают более прочные -связи; sp3-гибридные орбитали эквивалентны, направлены к вершинам правильного тетраэдра, угол между орбиталями 109,5, это обеспечивает минимальное отталкивание между ними. Экспериментальные данные подтверждают: метан имеет тетраэдрическую структуру, все связи углерод - водород одинаковой длины - 10.910-2 нм. Для разрыва CH связи в метане требуется 102 ккал/моль (427103 Дж/моль).
В молекуле этана -связь между атомами углерода Н3ССН3 обладает цилиндрической симметрией. Поэтому в молекуле этана две метильные группы вращаются вокруг углерод - углеродной связи почти свободно.
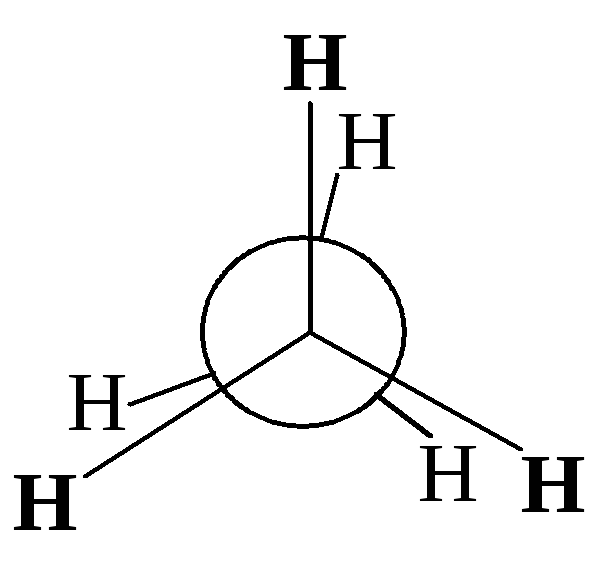
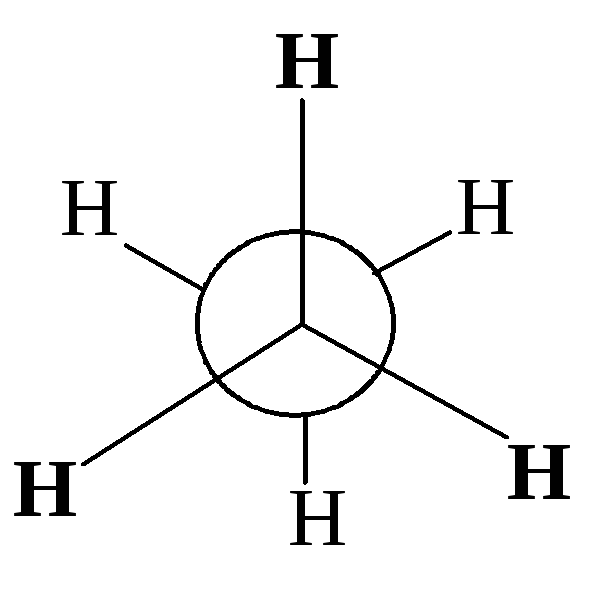
Различные расположения групп и атомов в пространстве, возникающие в результате поворота одного атома относительно другого вдоль линии связи, соединяющей эти атомы, называются конформациями.
Однако вращение одной метильной группы относительно другой не совсем свободно. Потенциальная энергия молекулы минимальна для заторможенной конформации II, при вращении метильной группы она возрастает и достигает максимума для заслонённой конформации I. Избыток энергии заслонённой конформации по сравнению с заторможенной называют энергией торсионного напряжения. Для молекулы этана эта энергия равна 13·103 Дж/моль (рис. 1.1).
|
|
|
|
|
|
|
Заслоненная конформация этана (I) |
Заторможенная конформация этана (II) |
Считают, что избыток энергии появляется вследствие отталкивания электронных облаков углерод-водородных связей в тот момент, когда они проходят мимо друг друга. Поскольку при комнатной температуре энергия некоторых столкновений молекул может достигать 86·103 Дж/моль, то барьер в 13·103 Дж/моль легко преодолевается. Вращение в этане рассматривают как свободное.
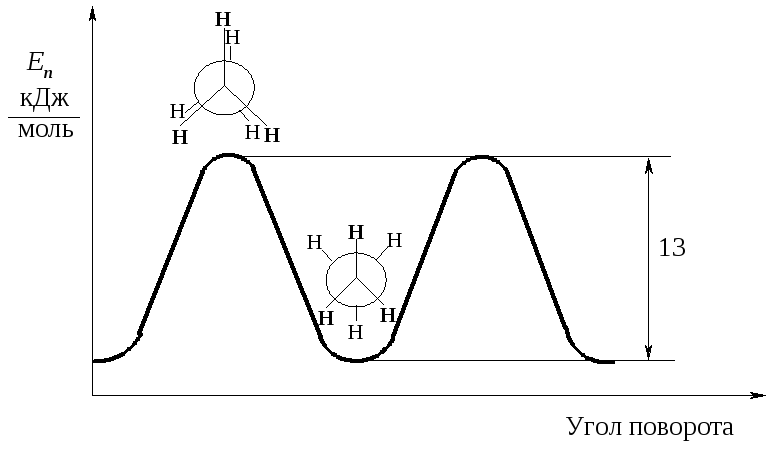
Рис. 5.1. Энергетический профиль вращения групп CH3 в молекуле этана вокруг связи углерод-углерод
Конформации, соответствующие энергетическим минимумам, называют конформационными изомерами или конформерами. В более сложных молекулах число конформеров может быть достаточно большим.