
- •1. Алканы
- •Введение
- •1. Классификация органических соединений
- •2. Классификация органических реакций
- •3. Способы образования ковалентной связи
- •4. Гибридизация атомных орбиталей и форма органических молекул
- •4.1. Sp3-Гибридизация
- •4.2. Sр2-Гибридизация
- •4.3. Sp-Гибридизация
- •5. Алканы
- •Гомологический ряд алканов. Число структурных изомеров
- •5.1. Физические свойства
- •5.2. Химические свойства
- •5.2.1. Галогенирование
- •Зависимость реакционной способности галогенов от энергии связи h–Hal
- •5.2.2. Нитрование
- •5.3.4. Декарбоксилирование карбоновых кислот
- •6.2. Плоскополяризованный свет. Оптическая активность
- •6.3. Строение молекул и оптическая активность
- •6.4. Обозначение конфигураций
- •7. Циклоалканы
- •7.1 Номенклатура. Изомерия
- •7.2. Физические свойства
- •7.3. Типы напряжения
- •7.4. Строение
- •Теплоты сгорания и энергии напряжения циклоалканов
- •7.4.1. Особенности пространственного строения некоторых циклоалканов
- •7.5. Химические свойства
- •7.6. Способы получения
- •8.1. Физические свойства
- •Физические свойства алкенов
- •8.2. Химические свойства
- •8.2.1. Присоединение галогенов
- •8.2.1.1. Механизм реакции
- •8.2.1.2. Реакционная способность галогенов в реакции АdЕ
- •8.2.2. Присоединение галогеноводородов
- •8.2.2.1. Механизм реакции
- •8.2.2.2. Направление электрофильного присоединения
- •8.2.2.3. Реакционная способность и селективность
- •8.2.2.4. Перегруппировка
- •Механизм реакции
- •8.2.3. Присоединение бромистого водорода в присутствии
- •1. Инициирование:
- •2. Рост цепи:
- •3. Обрыв цепи:
- •8.2.4. Присоединение серной кислоты
- •8.2.5. Гидратация алкенов. Присоединение спиртов
- •8.2.6. Гидроборирование алкенов
- •8.2.7. Алкилирование алкенов
- •8.2.8. Гидрирование. Теплота гидрирования
- •8.2.9. Теплота гидрирования и устойчивость алкенов
- •8.2.10. Окисление
- •8.2.11. Полимеризация алкенов
- •8.2.12. Реакция аллильного замещения. Галогенирование
- •8.3. Способы получения алкенов
- •9.1. Устойчивость сопряженных диенов
- •9.2. Химические свойства
- •9.2.1. Электрофильное присоединение
- •9.2.2. 1,2- И 1,4-Присоединение. Кинетический контроль, термодинамический контроль
- •9.2.3. Диеновый синтез. Реакция Дильса-Альдера
- •9.2.4. Полимеризация
- •9.3. Способы получения
- •10. Алкины
- •Характеристики химических связей в молекуле алкинов
- •10.1. Физические свойства
- •10.2. Химические свойства
- •10.2.1. Реакции присоединеня
- •10.2.1.1. Каталитическое гидрирование и восстановление
- •10.2.1.2. Реакции электрофильного присоединения Галогенирование
- •Гидрогалогенирование
- •Гидратация
- •10.2.1.3. Нуклеофильное присоединение
- •10.2.2. Кислотность алкинов
- •Константы кислотности некоторых соединений
- •10.2.3. Взаимодействие алкинов с карбонильными соединениями
- •10.2.4. Окисление алкинов
- •10.2.5. Радикальное присоединение бромоводорода
- •10.3. Способы получения
- •11. Арены
- •11.1. Сравнение свойств бензола со свойствами алкенов
- •11.2. Теплота гидрирования. Энергия резонанса
- •11.3. Строение бензола
- •11.4. Ароматичность
- •11.5. Физические свойства
- •Физические свойства аренов
- •11.6. Химические свойства
- •11.6.1. Электрофильное замещение
- •11.6.2. Свободнорадикальное замещение в боковой цепи аренов
- •11.6.3. Реакции окисления
- •11.7. Методы синтеза аренов
- •12.1. Влияние заместителей на реакционную способность бензольного кольца
- •12.2. Влияние заместителя на выбор места электрофильной атаки
- •13. Многоядерные ароматические соединения
- •13.1. Нафталин
- •13.2. Антрацен и фенантрен
- •14. Гетероциклические соединения
- •14.1. Пятичленные гетероциклы
- •14.1.1. Строение
- •14.1.2. Химические свойства
- •14.1.3. Способы получения
- •14.2. Пиридин
- •14.2.1. Строение пиридина
- •14.2.2. Химические свойства
- •14.3. Хинолин
- •15. Галогеналканы
- •15.1. Нуклеофильное замещение
- •15.1.1. Бимолекулярное нуклеофильное замещение
- •15.1.2. Мономолекулярное нуклеофильное замещение
- •15.1.3. Сравнение реакций sn 1 и sn 2
- •15.2. Реакции отщепления (элиминирование)
- •15.2.1. Бимолекулярное отщепление е2
- •15.2.2. Мономолекулярное отщепление е1
- •15.2.3. Сравнение реакций нуклеофильного замещения и элиминирования
- •15.3. Методы синтеза галогеналканов
- •16.2. Нуклеофильное замещение, протекающее через стадию образования дегидробензола, - отщепление - присоединение
- •16.3. Бимолекулярное нуклеофильное замещение sn2Ar
- •16.4. Ориентация при нуклеофильном замещении в ароматическом кольце
- •17. Магнийорганические соединения
- •17.1. Получение и строение магнийорганических соединений
- •17.2. Синтез спиртов и кислот
- •Библиографический список
- •Оглавление
- •Часть 1
16.3. Бимолекулярное нуклеофильное замещение sn2Ar
Присутствие нитрогруппы в орто- или пара-положении к хлору резко увеличивает его подвижность.



Другие электроноакцепторные группы, расположенные в орто-, пара-положениях, подобно нитрогруппе, активируют галоген. Наоборот, электронодонорные группы будут дезактивировать ароматическое кольцо в реакциях нуклеофильного замещения.
Бимолекулярное нуклеофильное замещение в ароматическом ядре включает две стадии. Первая стадия - медленная: атака нуклеофильного реагента по атому углерода, связанному с галогеном, и образование -комплекса - карбаниона.
В карбанионе шесть π-электронов делокализованы на р-орбиталях пяти атомов углерода, находящихся в sp2 - гибридном состоянии; избыточная электронная плотность распределена между углеродами в орто-, пара-положениях кольца относительно sp3 - гибридизированного атома углерода (I, II и III структуры) и кислородом нитрогуппы (IV) .
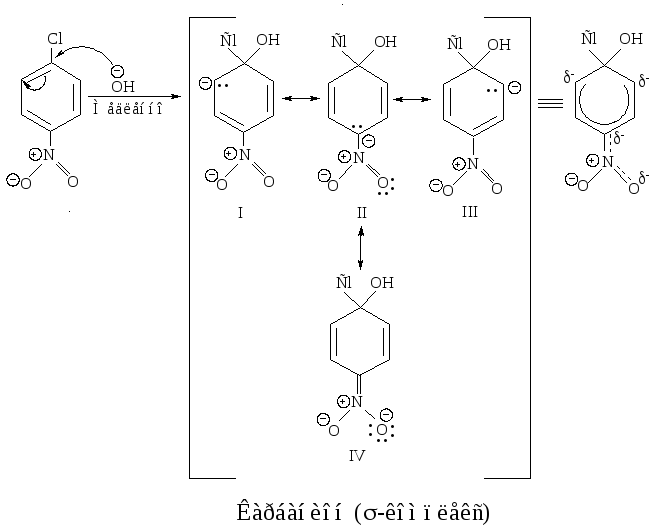
Вторая стадия - быстрая: отщепление аниона галогена, восстановление ароматического шести--электронного секстета.

16.4. Ориентация при нуклеофильном замещении в ароматическом кольце
В медленной стадии нуклеофильного замещения в ароматическом кольце образуются орто-, пара- и мета--комплексы (карбанионы). Сравним распределение отрицательного заряда в пара- и мета--комплексах (орто--комплекс полностью аналогичен пара--комплексу)


В пара--комплексе отрицательный заряд распределен между тремя атомами углерода (граничные структуры I, II, III) и атомом кислорода нитрогруппы (структура IV), так как нитрогруппа связана с атомом углерода, несущим отрицательный заряд. В мета--комплексе нитрогруппа не принимает участия в распределении отрицательного заряда, так как она не связана с атомом углерода, несущим отрицательный заряд, следовательно, в мета--комплексе отрицательный заряд распределен в меньшей степени (структуры V, VI, VII), чем в пара--комплексе, поэтому он образуется медленнее, чем пара--комплекс.
В ориентации при нуклеофильном и электрофильном замещении в ароматическом ряду много общего: заместитель оказывает наиболее сильное влияние на скорость замещения, если он находится в орто- или пара-положениях к месту атаки, так как именно в этих положениях возникает максимальный заряд в промежуточном ионе.
17. Магнийорганические соединения
17.1. Получение и строение магнийорганических соединений
При взаимодействии металлического магния с раствором галогенпроизводного углеводорода в сухом диэтиловом эфире C2H5-O-C2H5 образуется магнийорганическое соединение - реактив Гриньяра. В магнийорганических соединениях связь углерод-магний сильно поляризована.
![]()
![]()
Реактив Гриньяра можно рассматривать как соль очень слабой кислоты - алкана R-H. Соединения, в которых водород связан с кислородом, азотом или углеродом при тройной связи, будут более сильными кислотами, чем алкан, и будут разлагать магнийорганические соединения.

В синтезах с использованием магнийорганических соединений в качестве растворителя используют диэтиловый эфир, высушенный и очищенный от этилового спирта, из которого он был получен (абсолютный эфир). Диэтиловый эфир обладает способностью сольватировать реактив Гриньяра, выступая по отношению к нему как основание.

