- •1. Алканы
- •Введение
- •1. Классификация органических соединений
- •2. Классификация органических реакций
- •3. Способы образования ковалентной связи
- •4. Гибридизация атомных орбиталей и форма органических молекул
- •4.1. Sp3-Гибридизация
- •4.2. Sр2-Гибридизация
- •4.3. Sp-Гибридизация
- •5. Алканы
- •Гомологический ряд алканов. Число структурных изомеров
- •5.1. Физические свойства
- •5.2. Химические свойства
- •5.2.1. Галогенирование
- •Зависимость реакционной способности галогенов от энергии связи h–Hal
- •5.2.2. Нитрование
- •5.3.4. Декарбоксилирование карбоновых кислот
- •6.2. Плоскополяризованный свет. Оптическая активность
- •6.3. Строение молекул и оптическая активность
- •6.4. Обозначение конфигураций
- •7. Циклоалканы
- •7.1 Номенклатура. Изомерия
- •7.2. Физические свойства
- •7.3. Типы напряжения
- •7.4. Строение
- •Теплоты сгорания и энергии напряжения циклоалканов
- •7.4.1. Особенности пространственного строения некоторых циклоалканов
- •7.5. Химические свойства
- •7.6. Способы получения
- •8.1. Физические свойства
- •Физические свойства алкенов
- •8.2. Химические свойства
- •8.2.1. Присоединение галогенов
- •8.2.1.1. Механизм реакции
- •8.2.1.2. Реакционная способность галогенов в реакции АdЕ
- •8.2.2. Присоединение галогеноводородов
- •8.2.2.1. Механизм реакции
- •8.2.2.2. Направление электрофильного присоединения
- •8.2.2.3. Реакционная способность и селективность
- •8.2.2.4. Перегруппировка
- •Механизм реакции
- •8.2.3. Присоединение бромистого водорода в присутствии
- •1. Инициирование:
- •2. Рост цепи:
- •3. Обрыв цепи:
- •8.2.4. Присоединение серной кислоты
- •8.2.5. Гидратация алкенов. Присоединение спиртов
- •8.2.6. Гидроборирование алкенов
- •8.2.7. Алкилирование алкенов
- •8.2.8. Гидрирование. Теплота гидрирования
- •8.2.9. Теплота гидрирования и устойчивость алкенов
- •8.2.10. Окисление
- •8.2.11. Полимеризация алкенов
- •8.2.12. Реакция аллильного замещения. Галогенирование
- •8.3. Способы получения алкенов
- •9.1. Устойчивость сопряженных диенов
- •9.2. Химические свойства
- •9.2.1. Электрофильное присоединение
- •9.2.2. 1,2- И 1,4-Присоединение. Кинетический контроль, термодинамический контроль
- •9.2.3. Диеновый синтез. Реакция Дильса-Альдера
- •9.2.4. Полимеризация
- •9.3. Способы получения
- •10. Алкины
- •Характеристики химических связей в молекуле алкинов
- •10.1. Физические свойства
- •10.2. Химические свойства
- •10.2.1. Реакции присоединеня
- •10.2.1.1. Каталитическое гидрирование и восстановление
- •10.2.1.2. Реакции электрофильного присоединения Галогенирование
- •Гидрогалогенирование
- •Гидратация
- •10.2.1.3. Нуклеофильное присоединение
- •10.2.2. Кислотность алкинов
- •Константы кислотности некоторых соединений
- •10.2.3. Взаимодействие алкинов с карбонильными соединениями
- •10.2.4. Окисление алкинов
- •10.2.5. Радикальное присоединение бромоводорода
- •10.3. Способы получения
- •11. Арены
- •11.1. Сравнение свойств бензола со свойствами алкенов
- •11.2. Теплота гидрирования. Энергия резонанса
- •11.3. Строение бензола
- •11.4. Ароматичность
- •11.5. Физические свойства
- •Физические свойства аренов
- •11.6. Химические свойства
- •11.6.1. Электрофильное замещение
- •11.6.2. Свободнорадикальное замещение в боковой цепи аренов
- •11.6.3. Реакции окисления
- •11.7. Методы синтеза аренов
- •12.1. Влияние заместителей на реакционную способность бензольного кольца
- •12.2. Влияние заместителя на выбор места электрофильной атаки
- •13. Многоядерные ароматические соединения
- •13.1. Нафталин
- •13.2. Антрацен и фенантрен
- •14. Гетероциклические соединения
- •14.1. Пятичленные гетероциклы
- •14.1.1. Строение
- •14.1.2. Химические свойства
- •14.1.3. Способы получения
- •14.2. Пиридин
- •14.2.1. Строение пиридина
- •14.2.2. Химические свойства
- •14.3. Хинолин
- •15. Галогеналканы
- •15.1. Нуклеофильное замещение
- •15.1.1. Бимолекулярное нуклеофильное замещение
- •15.1.2. Мономолекулярное нуклеофильное замещение
- •15.1.3. Сравнение реакций sn 1 и sn 2
- •15.2. Реакции отщепления (элиминирование)
- •15.2.1. Бимолекулярное отщепление е2
- •15.2.2. Мономолекулярное отщепление е1
- •15.2.3. Сравнение реакций нуклеофильного замещения и элиминирования
- •15.3. Методы синтеза галогеналканов
- •16.2. Нуклеофильное замещение, протекающее через стадию образования дегидробензола, - отщепление - присоединение
- •16.3. Бимолекулярное нуклеофильное замещение sn2Ar
- •16.4. Ориентация при нуклеофильном замещении в ароматическом кольце
- •17. Магнийорганические соединения
- •17.1. Получение и строение магнийорганических соединений
- •17.2. Синтез спиртов и кислот
- •Библиографический список
- •Оглавление
- •Часть 1
4.1. Sp3-Гибридизация
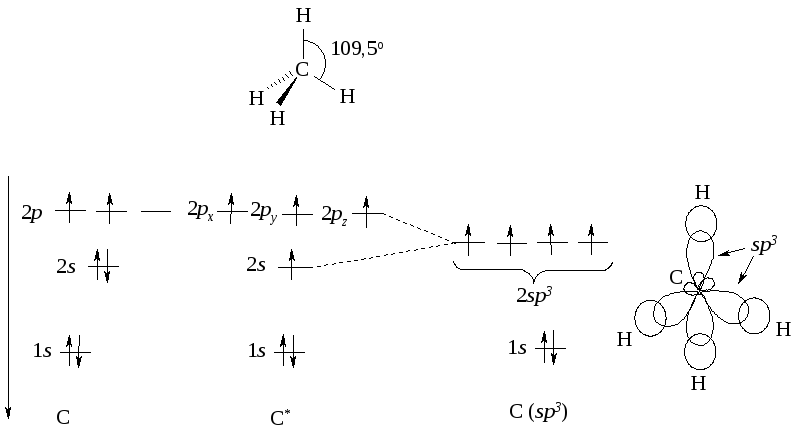
Если число связей и НЭП у атома в молекуле или частице равно четырем, то атом стремится к их тетраэдрической ориентации. В этой ориентации отталкивание электронов связей и НЭП является минимальным, а для атома характерна sp3-гибридизация его орбиталей. В соответствии с этим четыре С-Н-связи метана образуют тетраэдр; они направлены под углом 109,5° одна к другой, а атом углерода находится в sp3-гибридизации. Схема формирования sp3-гибридных орбиталей атома углерода в молекуле метана представлена на рис. 4.1.
|
Потенциал ионизации |
|
Рис. 4.1. Схема формирования sр3-гибридных орбиталей атома углерода и атомноорбитальная модель метана
Четыре гибридные орбитали атома углерода, перекрывающиеся в молекуле метана с s-орбиталями атомов водорода, образуюторбитали. Связи, возникшие в результате перекрывания орбиталей вдоль линии, соединяющей ядра атомов, называют -связями. Электроны С-Н-связей в молекуле метана находятся, таким образом, на -орбиталях.
Состояние, близкое к состоянию sр3-гибридизованного атома углерода, характерно и для атомов других элементов, имеющих в органических молекулах число связей и НЭП, равное четырем (H2O, NH3, триэтиламин - N(CH3)3, ион триэтиламмония - NH(СН3)3.
4.2. Sр2-Гибридизация
Если число связей и НЭП у атома в молекуле или частице равно трем, то атом стремится к их тригональной ориентации. В этой ориентации отталкивание электронов связей и НЭП является минимальным, а для атома характерна sp2-гибридизация его орбиталей.
|
Потенциал ионизации |
|
Рис. 4.2. Схема формирования sр2-гибридных орбиталей атома углерода и атомноорбитальная модель этилена
В соответствии с этим правилом все атомы в молекуле этилена лежат в одной плоскости, углы между связями равны 120°, а атомы углерода находятся в sр2-гибридизации.
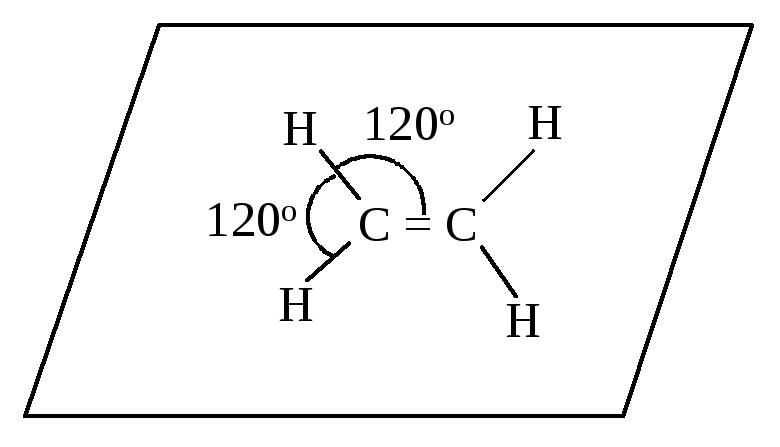
На рис. 4.2 показаны формирование sp2-гибридных АО атома углерода и атомно-орбитальная модель этилена.
Связи, находящиеся в плоскости молекулы этилена, являются -связями. 2рz-Орбитали атомов углерода перпендикулярны плоскости молекулы; они не-гибридизированы и образуют π-связъ. Тригональная направленность связей и НЭП характерна и для других функциональных групп, содержащих двойные связи; в каждой из них соответствующие атомы находятся в sp2-гибридизации.
4.3. Sp-Гибридизация
Если число связей и НЭП у атома в молекуле или частице равно двум, то атом стремится к их дигональной ориентации. В этой ориентации отталкивание электронов связей и НЭП является минимальным, а для атома характерна sp-гибридизация его орбиталей.
В соответствии с этим правилом все атомы в молекуле ацетилена лежат на одной прямой, углы между связями равны 180°, а атомы углерода находятся в sp-гибридизации.

На рис. 4.3 показаны схема sp-гибридизации атома углерода и атомно-орбитальная модель ацетилена.
|
Потенциал ионизации |
|
Рис. 4.3. Схема формирования sp-гибридных орбиталей атома углерода и атомно-орбиталышя модель ацетилена
И в других линейных молекулах, содержащих тройные связи, -связи образованы sp-орбиталями, находящимися на оси молекулы, а π-связи образованы 2ру - и 2рz-орбиталями, перпендикулярными оси молекулы (циановодород H-C≡N, нитрилы R-C≡N).