
- •1. Алканы
- •Введение
- •1. Классификация органических соединений
- •2. Классификация органических реакций
- •3. Способы образования ковалентной связи
- •4. Гибридизация атомных орбиталей и форма органических молекул
- •4.1. Sp3-Гибридизация
- •4.2. Sр2-Гибридизация
- •4.3. Sp-Гибридизация
- •5. Алканы
- •Гомологический ряд алканов. Число структурных изомеров
- •5.1. Физические свойства
- •5.2. Химические свойства
- •5.2.1. Галогенирование
- •Зависимость реакционной способности галогенов от энергии связи h–Hal
- •5.2.2. Нитрование
- •5.3.4. Декарбоксилирование карбоновых кислот
- •6.2. Плоскополяризованный свет. Оптическая активность
- •6.3. Строение молекул и оптическая активность
- •6.4. Обозначение конфигураций
- •7. Циклоалканы
- •7.1 Номенклатура. Изомерия
- •7.2. Физические свойства
- •7.3. Типы напряжения
- •7.4. Строение
- •Теплоты сгорания и энергии напряжения циклоалканов
- •7.4.1. Особенности пространственного строения некоторых циклоалканов
- •7.5. Химические свойства
- •7.6. Способы получения
- •8.1. Физические свойства
- •Физические свойства алкенов
- •8.2. Химические свойства
- •8.2.1. Присоединение галогенов
- •8.2.1.1. Механизм реакции
- •8.2.1.2. Реакционная способность галогенов в реакции АdЕ
- •8.2.2. Присоединение галогеноводородов
- •8.2.2.1. Механизм реакции
- •8.2.2.2. Направление электрофильного присоединения
- •8.2.2.3. Реакционная способность и селективность
- •8.2.2.4. Перегруппировка
- •Механизм реакции
- •8.2.3. Присоединение бромистого водорода в присутствии
- •1. Инициирование:
- •2. Рост цепи:
- •3. Обрыв цепи:
- •8.2.4. Присоединение серной кислоты
- •8.2.5. Гидратация алкенов. Присоединение спиртов
- •8.2.6. Гидроборирование алкенов
- •8.2.7. Алкилирование алкенов
- •8.2.8. Гидрирование. Теплота гидрирования
- •8.2.9. Теплота гидрирования и устойчивость алкенов
- •8.2.10. Окисление
- •8.2.11. Полимеризация алкенов
- •8.2.12. Реакция аллильного замещения. Галогенирование
- •8.3. Способы получения алкенов
- •9.1. Устойчивость сопряженных диенов
- •9.2. Химические свойства
- •9.2.1. Электрофильное присоединение
- •9.2.2. 1,2- И 1,4-Присоединение. Кинетический контроль, термодинамический контроль
- •9.2.3. Диеновый синтез. Реакция Дильса-Альдера
- •9.2.4. Полимеризация
- •9.3. Способы получения
- •10. Алкины
- •Характеристики химических связей в молекуле алкинов
- •10.1. Физические свойства
- •10.2. Химические свойства
- •10.2.1. Реакции присоединеня
- •10.2.1.1. Каталитическое гидрирование и восстановление
- •10.2.1.2. Реакции электрофильного присоединения Галогенирование
- •Гидрогалогенирование
- •Гидратация
- •10.2.1.3. Нуклеофильное присоединение
- •10.2.2. Кислотность алкинов
- •Константы кислотности некоторых соединений
- •10.2.3. Взаимодействие алкинов с карбонильными соединениями
- •10.2.4. Окисление алкинов
- •10.2.5. Радикальное присоединение бромоводорода
- •10.3. Способы получения
- •11. Арены
- •11.1. Сравнение свойств бензола со свойствами алкенов
- •11.2. Теплота гидрирования. Энергия резонанса
- •11.3. Строение бензола
- •11.4. Ароматичность
- •11.5. Физические свойства
- •Физические свойства аренов
- •11.6. Химические свойства
- •11.6.1. Электрофильное замещение
- •11.6.2. Свободнорадикальное замещение в боковой цепи аренов
- •11.6.3. Реакции окисления
- •11.7. Методы синтеза аренов
- •12.1. Влияние заместителей на реакционную способность бензольного кольца
- •12.2. Влияние заместителя на выбор места электрофильной атаки
- •13. Многоядерные ароматические соединения
- •13.1. Нафталин
- •13.2. Антрацен и фенантрен
- •14. Гетероциклические соединения
- •14.1. Пятичленные гетероциклы
- •14.1.1. Строение
- •14.1.2. Химические свойства
- •14.1.3. Способы получения
- •14.2. Пиридин
- •14.2.1. Строение пиридина
- •14.2.2. Химические свойства
- •14.3. Хинолин
- •15. Галогеналканы
- •15.1. Нуклеофильное замещение
- •15.1.1. Бимолекулярное нуклеофильное замещение
- •15.1.2. Мономолекулярное нуклеофильное замещение
- •15.1.3. Сравнение реакций sn 1 и sn 2
- •15.2. Реакции отщепления (элиминирование)
- •15.2.1. Бимолекулярное отщепление е2
- •15.2.2. Мономолекулярное отщепление е1
- •15.2.3. Сравнение реакций нуклеофильного замещения и элиминирования
- •15.3. Методы синтеза галогеналканов
- •16.2. Нуклеофильное замещение, протекающее через стадию образования дегидробензола, - отщепление - присоединение
- •16.3. Бимолекулярное нуклеофильное замещение sn2Ar
- •16.4. Ориентация при нуклеофильном замещении в ароматическом кольце
- •17. Магнийорганические соединения
- •17.1. Получение и строение магнийорганических соединений
- •17.2. Синтез спиртов и кислот
- •Библиографический список
- •Оглавление
- •Часть 1
14.1.2. Химические свойства
Пиррол, фуран и тиофен, как и другие ароматические соединения, вступают в реакции электрофильного замещения: нитрование, сульфирование, галогенирование, ацилирование по Фриделю-Крафтсу.
Пиррол и фуран более реакционноспособные соединения, чем бензол, и сходны с наиболее активными производными бензола: аминами и фенолами. Тиофен менее реакционноспособен, чем пиррол и фуран, но более активен, чем бензол.
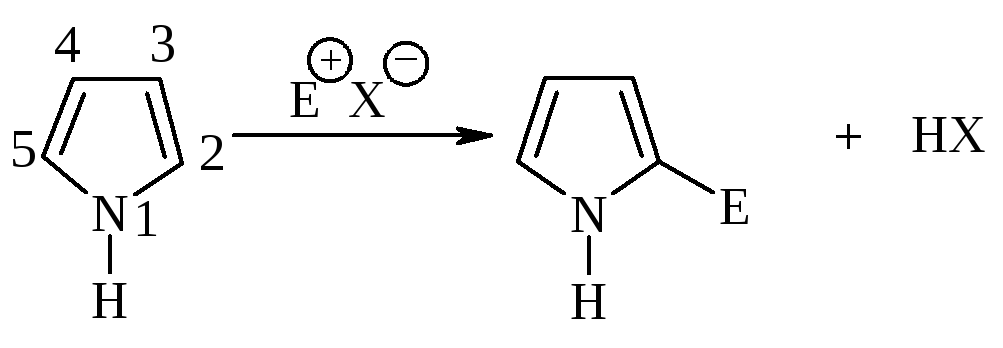
Электрофильное замещение происходит в положение 2.
В реакции электрофильного замещения лимитирующей стадией является стадия образования -комплекса в результате присоединения электрофильного реагента к атому углерода кольца.
Реакции электрофильного замещения в пирроле представлены на рис. 14.1.
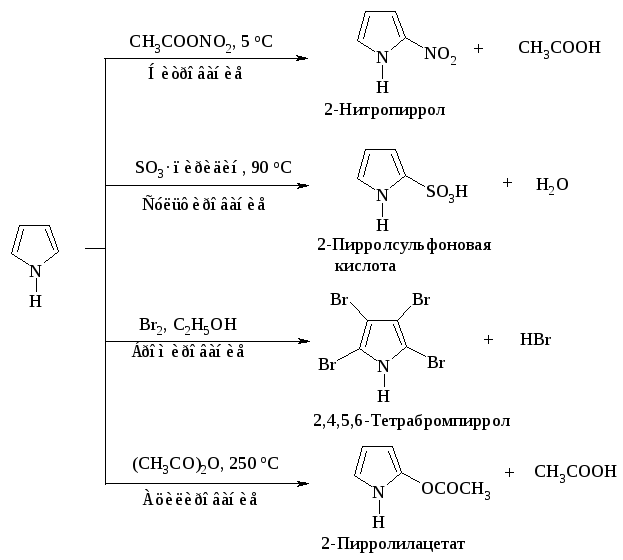
Рис. 14.1. Реакции электрофильного замещения в пирроле
Нитрование и сульфирование пиррола из-за чувствительности к протонным кислотам (это свойство называется ацидофобностью) проводят в отсутствие протонных кислот. Реакция бромирования и ацилирования по Фриделю-Крафту протекает без участия катализатора.
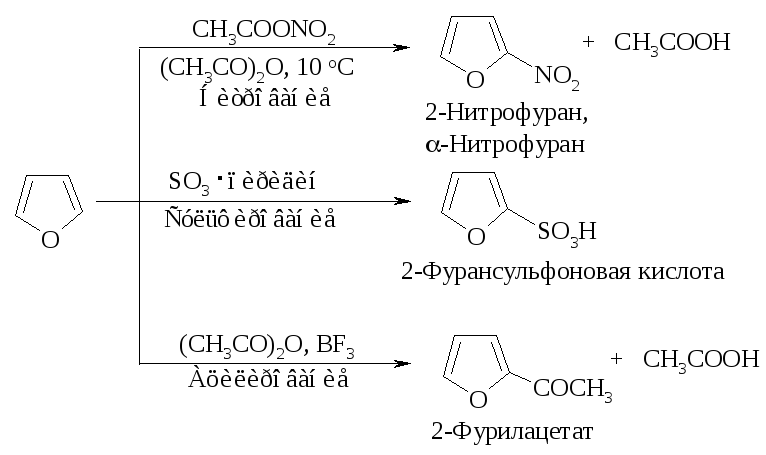
Фуран в реакциях электрофильного замещения напоминает пиррол. Как и пиррол, он является ацидофобным соединением: в присутствии протонных кислот кольцо фурана раскрывается. Хлорирование и бромирование фурана протекает очень бурно и с трудом поддается контролю. Ацилирование требует применения в качестве катализатора мягкой кислоты Льюиса.
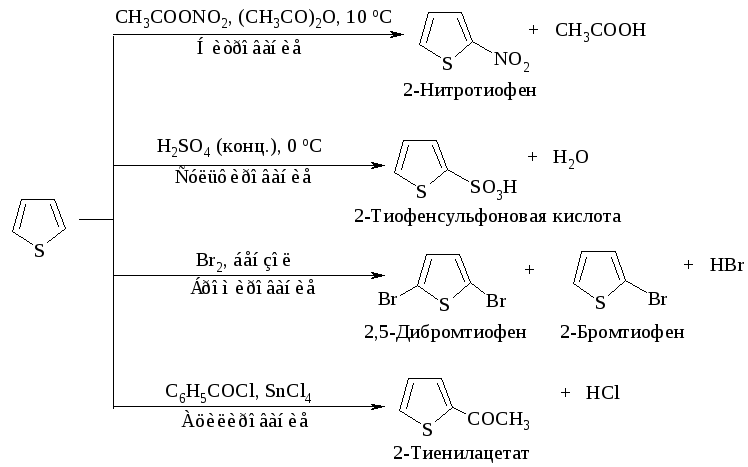
Тиофен менее реакционноспособен по сравнению с фураном и пирролом, он может сульфироваться в условиях высокой кислотности. Бромирование может проводиться направленно с образованием 2-бром- и 2,4-дибромтиофена.
14.1.3. Способы получения
Некоторые замещенные фурана, тиофена и пиррола могут быть получены из ациклических соединений через реакцию циклизации, например:
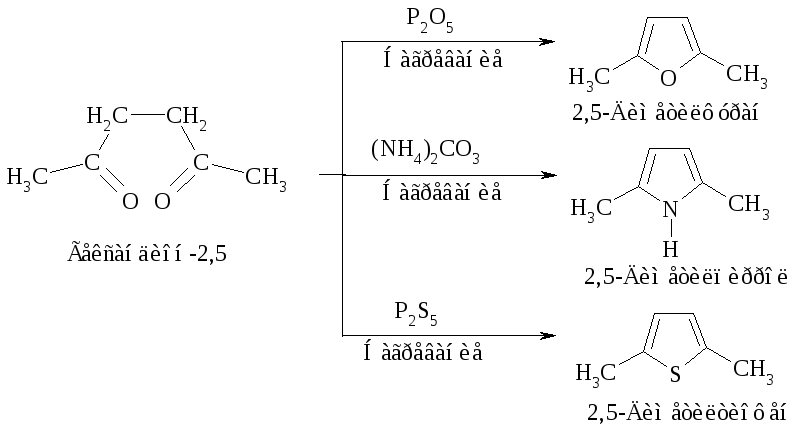
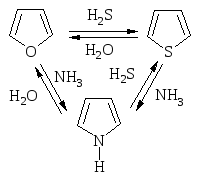
Фуран, тиофен, пиррол могут взаимно превращаться друг в друга (Ю.К. Юрьев) в токе Н2О, Н2S и NH3 соответственно при температуре 400-500 оС в присутствии Al2O3.
14.2. Пиридин
Пиридин является шестичленным ароматическим гетероциклом.
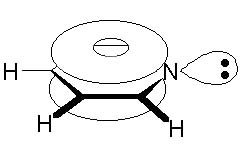
14.2.1. Строение пиридина
В пиридине атом азота, как и все атомы углерода, находится в sp2-cостоянии. Каждый из пяти атомов углерода и атом азота связаны с соседними атомами кольца с помощью двух sp2-гибридизованных орбиталей, третья sp2-гибридизованная орбиталь атома углерода затрачивается на образование связи с атомом водорода, а на третьей sp2-гибридизованной орбитали атома азота находится пара электронов. Пять негибридизованных р-облаков атомов углерода и одно р-облако атома азота, перекрываясь, образуют единую -электронную систему: два облака - над и под плоскостью кольца.
В плоском шестиугольнике пиридина все углерод-углеродные связи имеют одинаковую длину (13,9·10-2 нм), промежуточную между длиной простой Csp2–Csp2 (14,8·10-2 нм) и двойной C=C связей (13,4·10-2 нм). Обе связи азот-углерод также имеют одинаковую длину (13,7·10-2 нм), меньшую, чем длина простой связи С-N (14,7·10-2 нм), но большую, чем длина двойной связи С=N (12,8·10-2 нм).
Делокализация шести р-электронов кольца пиридина обусловливает значительную устойчивость -электронного облака. Действительно, теплота сгорания пиридина указывает на существенную энергию резонанса 96 кДж/моль.
Строение пиридина можно изобразить резонансным гибридом граничных структур I-V.
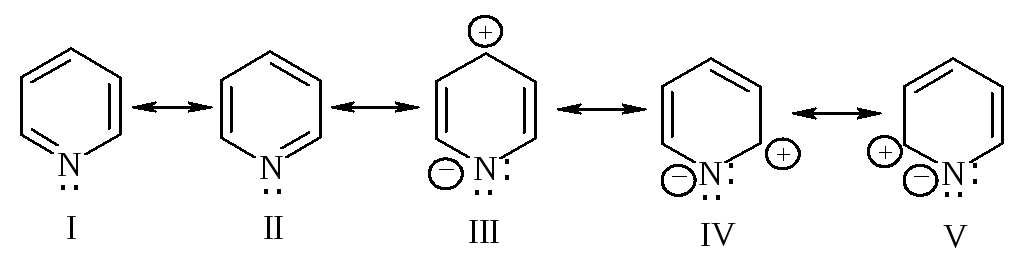
Биполярные структуры III-V вносят значительный вклад в резонансный гибрид, так как дипольный момент пиридина, равный 7,4510-30 Клм (2,26 Д), значительно больше, чем дипольный момент пиперидина 3,8610-30 Клм (1,17 Д).
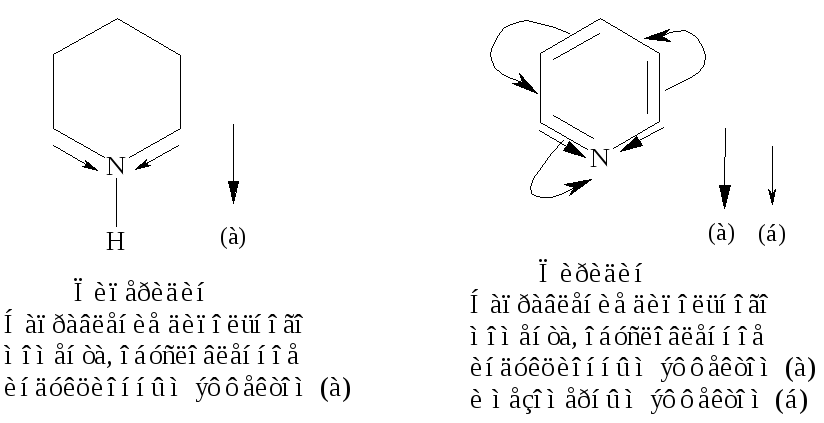
Для пиридина, как для ароматического соединения, характерны реакции электрофильного замещения, в которых сохраняется устойчивая -электронная система.
