
- •1. Алканы
- •Введение
- •1. Классификация органических соединений
- •2. Классификация органических реакций
- •3. Способы образования ковалентной связи
- •4. Гибридизация атомных орбиталей и форма органических молекул
- •4.1. Sp3-Гибридизация
- •4.2. Sр2-Гибридизация
- •4.3. Sp-Гибридизация
- •5. Алканы
- •Гомологический ряд алканов. Число структурных изомеров
- •5.1. Физические свойства
- •5.2. Химические свойства
- •5.2.1. Галогенирование
- •Зависимость реакционной способности галогенов от энергии связи h–Hal
- •5.2.2. Нитрование
- •5.3.4. Декарбоксилирование карбоновых кислот
- •6.2. Плоскополяризованный свет. Оптическая активность
- •6.3. Строение молекул и оптическая активность
- •6.4. Обозначение конфигураций
- •7. Циклоалканы
- •7.1 Номенклатура. Изомерия
- •7.2. Физические свойства
- •7.3. Типы напряжения
- •7.4. Строение
- •Теплоты сгорания и энергии напряжения циклоалканов
- •7.4.1. Особенности пространственного строения некоторых циклоалканов
- •7.5. Химические свойства
- •7.6. Способы получения
- •8.1. Физические свойства
- •Физические свойства алкенов
- •8.2. Химические свойства
- •8.2.1. Присоединение галогенов
- •8.2.1.1. Механизм реакции
- •8.2.1.2. Реакционная способность галогенов в реакции АdЕ
- •8.2.2. Присоединение галогеноводородов
- •8.2.2.1. Механизм реакции
- •8.2.2.2. Направление электрофильного присоединения
- •8.2.2.3. Реакционная способность и селективность
- •8.2.2.4. Перегруппировка
- •Механизм реакции
- •8.2.3. Присоединение бромистого водорода в присутствии
- •1. Инициирование:
- •2. Рост цепи:
- •3. Обрыв цепи:
- •8.2.4. Присоединение серной кислоты
- •8.2.5. Гидратация алкенов. Присоединение спиртов
- •8.2.6. Гидроборирование алкенов
- •8.2.7. Алкилирование алкенов
- •8.2.8. Гидрирование. Теплота гидрирования
- •8.2.9. Теплота гидрирования и устойчивость алкенов
- •8.2.10. Окисление
- •8.2.11. Полимеризация алкенов
- •8.2.12. Реакция аллильного замещения. Галогенирование
- •8.3. Способы получения алкенов
- •9.1. Устойчивость сопряженных диенов
- •9.2. Химические свойства
- •9.2.1. Электрофильное присоединение
- •9.2.2. 1,2- И 1,4-Присоединение. Кинетический контроль, термодинамический контроль
- •9.2.3. Диеновый синтез. Реакция Дильса-Альдера
- •9.2.4. Полимеризация
- •9.3. Способы получения
- •10. Алкины
- •Характеристики химических связей в молекуле алкинов
- •10.1. Физические свойства
- •10.2. Химические свойства
- •10.2.1. Реакции присоединеня
- •10.2.1.1. Каталитическое гидрирование и восстановление
- •10.2.1.2. Реакции электрофильного присоединения Галогенирование
- •Гидрогалогенирование
- •Гидратация
- •10.2.1.3. Нуклеофильное присоединение
- •10.2.2. Кислотность алкинов
- •Константы кислотности некоторых соединений
- •10.2.3. Взаимодействие алкинов с карбонильными соединениями
- •10.2.4. Окисление алкинов
- •10.2.5. Радикальное присоединение бромоводорода
- •10.3. Способы получения
- •11. Арены
- •11.1. Сравнение свойств бензола со свойствами алкенов
- •11.2. Теплота гидрирования. Энергия резонанса
- •11.3. Строение бензола
- •11.4. Ароматичность
- •11.5. Физические свойства
- •Физические свойства аренов
- •11.6. Химические свойства
- •11.6.1. Электрофильное замещение
- •11.6.2. Свободнорадикальное замещение в боковой цепи аренов
- •11.6.3. Реакции окисления
- •11.7. Методы синтеза аренов
- •12.1. Влияние заместителей на реакционную способность бензольного кольца
- •12.2. Влияние заместителя на выбор места электрофильной атаки
- •13. Многоядерные ароматические соединения
- •13.1. Нафталин
- •13.2. Антрацен и фенантрен
- •14. Гетероциклические соединения
- •14.1. Пятичленные гетероциклы
- •14.1.1. Строение
- •14.1.2. Химические свойства
- •14.1.3. Способы получения
- •14.2. Пиридин
- •14.2.1. Строение пиридина
- •14.2.2. Химические свойства
- •14.3. Хинолин
- •15. Галогеналканы
- •15.1. Нуклеофильное замещение
- •15.1.1. Бимолекулярное нуклеофильное замещение
- •15.1.2. Мономолекулярное нуклеофильное замещение
- •15.1.3. Сравнение реакций sn 1 и sn 2
- •15.2. Реакции отщепления (элиминирование)
- •15.2.1. Бимолекулярное отщепление е2
- •15.2.2. Мономолекулярное отщепление е1
- •15.2.3. Сравнение реакций нуклеофильного замещения и элиминирования
- •15.3. Методы синтеза галогеналканов
- •16.2. Нуклеофильное замещение, протекающее через стадию образования дегидробензола, - отщепление - присоединение
- •16.3. Бимолекулярное нуклеофильное замещение sn2Ar
- •16.4. Ориентация при нуклеофильном замещении в ароматическом кольце
- •17. Магнийорганические соединения
- •17.1. Получение и строение магнийорганических соединений
- •17.2. Синтез спиртов и кислот
- •Библиографический список
- •Оглавление
- •Часть 1
13.2. Антрацен и фенантрен
Антрацен и фенантрен являются ароматическими соединениями. Они представляют собой плоские циклические структуры, содержащие замкнутое -электронное облако, расположенное ниже и выше плоскости колец. Число -электронов в соответствии с правилом Хюккеля равно 4n + 2 = 4 3 + 2 = 14.

Антрацен можно рассматривать как резонансный гибрид структур I-IV.

Его энергия резонанса составляет 352 кДж/моль.
Фенантрен можно представить резонансным гибридом структур V-IX.

Резонансная энергия фенантрена 386 кДж/моль.
Антрацен и фенантрен вступают в реакции электрофильного замещения. Их активные положения 9 и 10 находятся в среднем кольце, так как при атаке в эти положения сохраняется ароматичность двух боковых бензольных систем с энергией резонанса 1532=306 кДж/моль. При атаке в боковые кольца сохраняется ароматичность одного нафталинового фрагмента с энергией резонанса 256 кДж/моль.

Вывод об активности положений 9 и 10 справедлив как для электрофильного замещения, так и для реакций окисления и восстановления.

14. Гетероциклические соединения


Гетероциклическими называются соединения, содержащие циклы, в которых, кроме атомов углерода, имеются один или несколько атомов других элементов, чаще всего - азота, кислорода, серы.
14.1. Пятичленные гетероциклы
14.1.1. Строение
Простейшие пятичленные гетероциклы: пиррол, фуран, тиофен - содержат один гетероатом.
В соответствии с представленными формулами каждое из этих соединений будет обладать свойствами сопряженного диена и соответственно - свойствами амина R-NH-R, простого эфира R-O-R и тиоэфира (сульфида) R-S-R. Однако пиррол не обладает основными свойствами, типичными для аминов, тиофен не вступает в реакции окисления, типичные для сульфидов. Для них характерна способность вступать в реакции электрофильного замещения: нитрование, сульфирование, галогенирование, ацилирование по Фриделю-Крафтсу. Числовые значения теплот сгорания указывают на наличие значительной энергии резонансной стабилизации - 67-117 кДж/моль. Это несколько меньше, чем энергия резонанса бензола (153 кДж/моль), но гораздо больше, чем аналогичная величина для большинства сопряженных диенов (13 кДж/моль). Следовательно, эти соединения являются ароматическими.
Рассмотрим строение пятичленных гетероциклов на примере пиррола. Четыре атома углерода и атом азота находятся в sp2-гибридном состоянии и затрачивают три гибридные орбитали на образование двух -связей с другими атомами кольца и одним атомом водорода. У каждого атома углерода остается один электрон, а у атома азота - два на р-орбитали. При -перекрывании р-орбиталей образуются -облака выше и ниже плоскости кольца, содержащие шесть электронов, - ароматический секстет.
|
|
|
Структура пиррола может быть представлена резонансным гибридом структур I-V.

Сравнение дипольных моментов пирролидина 5,1810-30 Клм (1,57Д) и пиррола 5,9410-30 Клм (1,8Д) показывает, что структуры II-V вносят значительный вклад в резонансный гибрид.

Данные, полученные при измерении длин связей в молекуле пиррола, дипольных моментов, УФ-спектров, теплот сгорания, подтверждают наличие делокализованной -электронной системы.
Следствием делокализации четырех -электронов атомов углерода и двух электронов гетероатома является склонность к реакциям электрофильного замещения, в которых сохраняется -электронная система.
В отличие от вторичных алифатических аминов, для которых КВ10-3-10-4, пиррол - более слабое основание (КВ =2,510-14). Это объясняется тем, что свободная пара электронов азота, которая обусловливает основные свойства азотсодержащих соединений, вовлечена в -электронное облако и не может быть предоставлена для образования связи с протоном.
Высокая электронная плотность в кольце пиррола обусловливает высокую реакционную способность пиррола в реакциях электрофильного замещения.
Структуры фурана и тиофена аналогичны структуре пиррола. Атом кислорода в фуране и атом серы в тиофене подают два электрона в -электронное облако и ведут себя как высокореакционноспособные соединения, подобные бензолу.
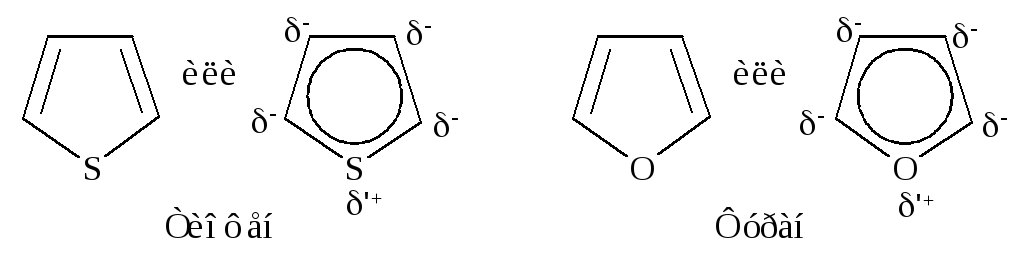
Сравнивая электроотрицательность серы, азота и кислорода, можно ожидать, что вклад структур, подобных II - V, будет наиболее значительным для тиофена и наименее - для фурана, содержащего наиболее электроотрицательный элемент - кислород. Действительно, ароматический характер усиливается при переходе от фурана к пирролу и далее к тиофену, энергии резонанса составляют соответственно 67·103, 88·103, 117·103 Дж/моль. Фуран, наименее ароматичный из этих трех соединений, вступает в реакции диенового синтеза в качестве диена.


