
- •1. Алканы
- •Введение
- •1. Классификация органических соединений
- •2. Классификация органических реакций
- •3. Способы образования ковалентной связи
- •4. Гибридизация атомных орбиталей и форма органических молекул
- •4.1. Sp3-Гибридизация
- •4.2. Sр2-Гибридизация
- •4.3. Sp-Гибридизация
- •5. Алканы
- •Гомологический ряд алканов. Число структурных изомеров
- •5.1. Физические свойства
- •5.2. Химические свойства
- •5.2.1. Галогенирование
- •Зависимость реакционной способности галогенов от энергии связи h–Hal
- •5.2.2. Нитрование
- •5.3.4. Декарбоксилирование карбоновых кислот
- •6.2. Плоскополяризованный свет. Оптическая активность
- •6.3. Строение молекул и оптическая активность
- •6.4. Обозначение конфигураций
- •7. Циклоалканы
- •7.1 Номенклатура. Изомерия
- •7.2. Физические свойства
- •7.3. Типы напряжения
- •7.4. Строение
- •Теплоты сгорания и энергии напряжения циклоалканов
- •7.4.1. Особенности пространственного строения некоторых циклоалканов
- •7.5. Химические свойства
- •7.6. Способы получения
- •8.1. Физические свойства
- •Физические свойства алкенов
- •8.2. Химические свойства
- •8.2.1. Присоединение галогенов
- •8.2.1.1. Механизм реакции
- •8.2.1.2. Реакционная способность галогенов в реакции АdЕ
- •8.2.2. Присоединение галогеноводородов
- •8.2.2.1. Механизм реакции
- •8.2.2.2. Направление электрофильного присоединения
- •8.2.2.3. Реакционная способность и селективность
- •8.2.2.4. Перегруппировка
- •Механизм реакции
- •8.2.3. Присоединение бромистого водорода в присутствии
- •1. Инициирование:
- •2. Рост цепи:
- •3. Обрыв цепи:
- •8.2.4. Присоединение серной кислоты
- •8.2.5. Гидратация алкенов. Присоединение спиртов
- •8.2.6. Гидроборирование алкенов
- •8.2.7. Алкилирование алкенов
- •8.2.8. Гидрирование. Теплота гидрирования
- •8.2.9. Теплота гидрирования и устойчивость алкенов
- •8.2.10. Окисление
- •8.2.11. Полимеризация алкенов
- •8.2.12. Реакция аллильного замещения. Галогенирование
- •8.3. Способы получения алкенов
- •9.1. Устойчивость сопряженных диенов
- •9.2. Химические свойства
- •9.2.1. Электрофильное присоединение
- •9.2.2. 1,2- И 1,4-Присоединение. Кинетический контроль, термодинамический контроль
- •9.2.3. Диеновый синтез. Реакция Дильса-Альдера
- •9.2.4. Полимеризация
- •9.3. Способы получения
- •10. Алкины
- •Характеристики химических связей в молекуле алкинов
- •10.1. Физические свойства
- •10.2. Химические свойства
- •10.2.1. Реакции присоединеня
- •10.2.1.1. Каталитическое гидрирование и восстановление
- •10.2.1.2. Реакции электрофильного присоединения Галогенирование
- •Гидрогалогенирование
- •Гидратация
- •10.2.1.3. Нуклеофильное присоединение
- •10.2.2. Кислотность алкинов
- •Константы кислотности некоторых соединений
- •10.2.3. Взаимодействие алкинов с карбонильными соединениями
- •10.2.4. Окисление алкинов
- •10.2.5. Радикальное присоединение бромоводорода
- •10.3. Способы получения
- •11. Арены
- •11.1. Сравнение свойств бензола со свойствами алкенов
- •11.2. Теплота гидрирования. Энергия резонанса
- •11.3. Строение бензола
- •11.4. Ароматичность
- •11.5. Физические свойства
- •Физические свойства аренов
- •11.6. Химические свойства
- •11.6.1. Электрофильное замещение
- •11.6.2. Свободнорадикальное замещение в боковой цепи аренов
- •11.6.3. Реакции окисления
- •11.7. Методы синтеза аренов
- •12.1. Влияние заместителей на реакционную способность бензольного кольца
- •12.2. Влияние заместителя на выбор места электрофильной атаки
- •13. Многоядерные ароматические соединения
- •13.1. Нафталин
- •13.2. Антрацен и фенантрен
- •14. Гетероциклические соединения
- •14.1. Пятичленные гетероциклы
- •14.1.1. Строение
- •14.1.2. Химические свойства
- •14.1.3. Способы получения
- •14.2. Пиридин
- •14.2.1. Строение пиридина
- •14.2.2. Химические свойства
- •14.3. Хинолин
- •15. Галогеналканы
- •15.1. Нуклеофильное замещение
- •15.1.1. Бимолекулярное нуклеофильное замещение
- •15.1.2. Мономолекулярное нуклеофильное замещение
- •15.1.3. Сравнение реакций sn 1 и sn 2
- •15.2. Реакции отщепления (элиминирование)
- •15.2.1. Бимолекулярное отщепление е2
- •15.2.2. Мономолекулярное отщепление е1
- •15.2.3. Сравнение реакций нуклеофильного замещения и элиминирования
- •15.3. Методы синтеза галогеналканов
- •16.2. Нуклеофильное замещение, протекающее через стадию образования дегидробензола, - отщепление - присоединение
- •16.3. Бимолекулярное нуклеофильное замещение sn2Ar
- •16.4. Ориентация при нуклеофильном замещении в ароматическом кольце
- •17. Магнийорганические соединения
- •17.1. Получение и строение магнийорганических соединений
- •17.2. Синтез спиртов и кислот
- •Библиографический список
- •Оглавление
- •Часть 1
11.6.2. Свободнорадикальное замещение в боковой цепи аренов
Вторая по важности группа реакций алкилароматических углеводородов - свободнорадикальное замещение атома водорода боковой цепи в -положении по отношению к ароматическому ядру.
Для бензола не характерно свободнорадикальное замещение, так как он не содержит sp3-гибридного углерода. Реакции свободнорадикального замещения аренов: галогенирование, нитрование происходят в боковой цепи (алкильной группе).
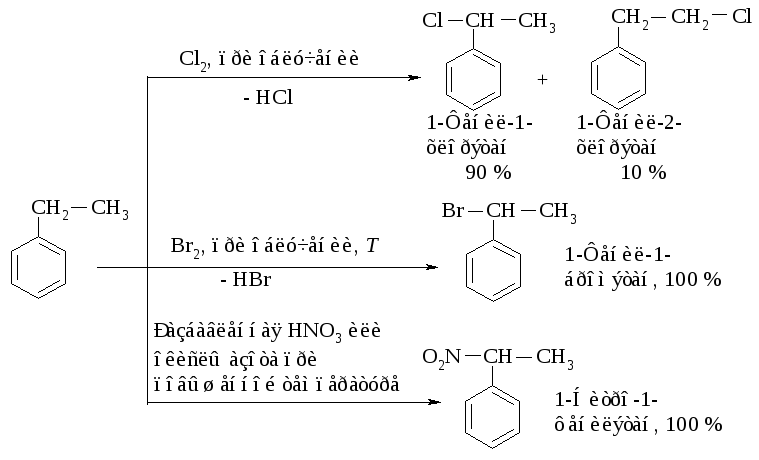
Преимущественное замещение в -положении объясняется высокой устойчивостью соответствующих алкилароматических радикалов. В этих радикалах имеется возможность распределения спиновой плотности неспаренного электрона между -углеродным атомом боковой цепи и одним пара- и двумя орто-углеродными атомами ароматического кольца.
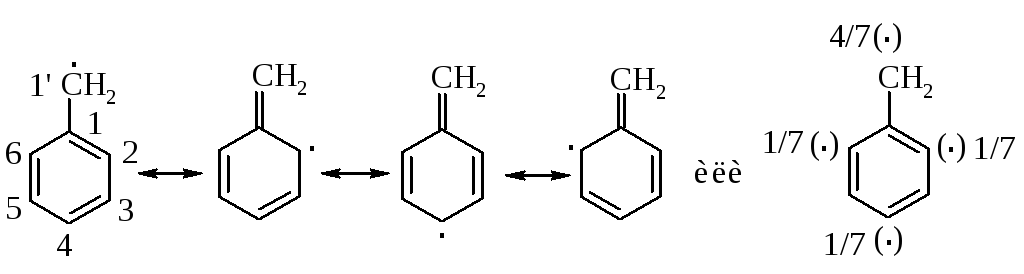
В результате распределения (делокализации) спиновая плотность неспаренного электрона только на 4/7 остается у некольцевого атома углерода, остальные 3/7 спиновой плотности распределены между одним пара- и двумя орто- углеродными атомами ароматического ядра.
11.6.3. Реакции окисления
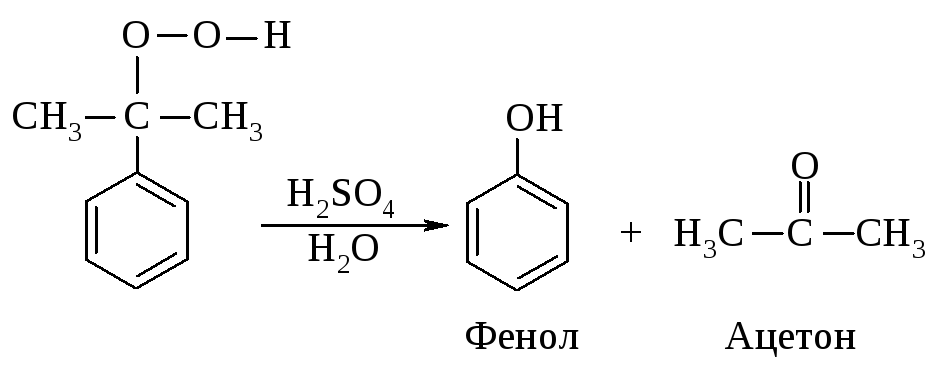
Реакции окисления в зависимости от условий и природы окислителя могут протекать по-разному. Молекулярный кислород при температуре около 100 оС окисляет изопропилбензол по радикальноцепному механизму.

Гидропероксид изопропилбензола можно разложить с образованием фенола и ацетона. Этот процесс разработали ученые Р.Ю. Удрис и П.Г. Сергеев (1942 г.).
Окисление бензола молекулярным кислородом в присутствии пятиокиси ванадия приводит к образованию малеинового ангидрида.

Озон действует на ароматическое ядро так же, как на углеводороды с двойными связями.

Сильные неорганические окислители (KMnO4, K2Cr2O7 + H2SO4) окисляют боковые цепи алкилароматических соединений до карбоксильных групп, связанных непосредственно с ароматическим кольцом.

Трет-бутильная группа устойчива к окислению, так как не содержит водорода у -углеродного атома.
11.7. Методы синтеза аренов
Бензол и многие его гомологи содержатся в нефти различного происхождения, в коксовых газах и каменноугольной смоле. В настоящее время в больших масштабах осуществляют дегидрирование, дегидроциклизацию, дегидроизомеризацию или высокотемпературный крекинг алифатических и алициклических углеводородов нефти до аренов.
11.7.1. Ароматизация алканов
Процесс превращения алканов в арены называется дегидроциклизацией, т.к. одновременно включает в себя две реакции: замыкание в цикл линейного углеводорода и отщепление водорода. Из гексана получается бензол, из гептана – толуол, из октана - смесь изомерных ксилолов. Другие арены этим способом не получают.
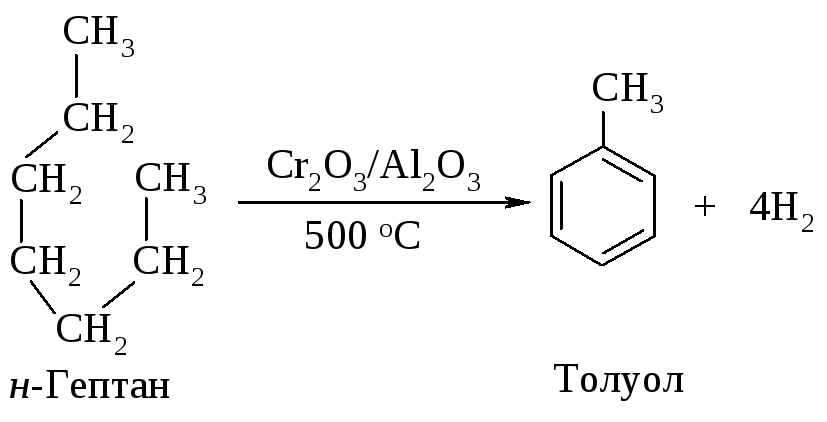
Для получения алкилбензолов существует ряд синтетических методов.
11.7.2. Реакция Вюрца – Фиттига
Аналогично получению алканов по реакции Вюрца алкилбензолы можно получить взаимодействием галогенбензола и галогеналкана с натрием. Наилучшие выходы получаются при использовании арилбромидов и первичных алкилбромидов.

При этом в качестве побочных продуктов получаются бифенил и алкан, но они легко отделимы от алкиларенов.
Гомологи бензола могут быть получены также при взаимодействии фенилмагнийгалогенидов с галогеналканами.
11.7.3. Алкилирование бензола
При действии на бензол алкилирующих агентов (галогеналканов, алкенов, спиртов) в присутствии кислот Льюиса, а также сильных кислот образуется алкилбензол.

11.7.4. Ацилирование с последующим восстановлением
Реакция ацилирования может быть использована в двухстадийном синтезе алкилбензолов с неразветвлённой цепью атомов углерода: первая стадия - ацилирование, вторая - восстановление полученного кетона амальгамированным цинком в концентрированной соляной кислоте (восстановление по Клеменсену).
![]()
12. Электрофильное замещение в производных бензола
Любая группа, связанная с бензольным кольцом, определенным образом изменяет в кольце электронную плотность.
Все эффекты заместителей рассматриваются относительно эффекта атома водорода, на месте которого в молекуле появился заместитель.
Индуктивный эффект – это перераспределение электронной плотности -связи между двумя атомами, обусловленное различием в их способности притягивать и удерживать электроны. Индуктивный эффект передается от атома к атому по системе -связей и быстро затухает. Если под действием заместителя на соседнем атоме возникает частичный положительный заряд, то этот заместитель проявляет отрицательный индуктивный эффект (-I-эффект) и называется электроноакцепторным. Этот заместитель уменьшает электронную плотность на соседнем атоме углерода по сравнению с атомом водорода на этом же месте.
Если под действием заместителя на соседнем атоме возникает частичный отрицательный заряд, то этот заместитель проявляет положительный индуктивный эффект (+I-эффект) и называется электронодонорным. Этот заместитель увеличивает электронную плотность на соседнем атоме углерода по сравнению с атомом водорода на этом же месте.
Мезомерный эффект (эффект сопряжения) возникает в сопряжённых системах – т.е. в системах, в которых имеет место чередование простых связей и подвижных пар электронов. Подвижные пары электронов - это электроны кратных связей (-электроны) или свободные пары электронов (р-электроны). Эти электроны не локализованы между двумя атомами или на одном атоме (р-электроны), а распределены по всей сопряженной системе, т.е. орбитали, на которых находятся электроны, перекрываются между собой и образуют новую орбиталь, охватывающую все атомы сопряженной системы. Мезомерным эффектом называется перераспределение - и р-электронов в сопряженной системе под влиянием заместителя за счёт перекрывания орбиталей, на которых находятся делокализующиеся электроны.
Поскольку -электроны обладают значительно большей подвижностью, чем -электроны, то изменение электронной плотности в результате проявления мезомерного эффекта распространяется на всю сопряженную систему и оказывает более существенное влияние на реакционную способность, чем индуктивный эффект.
Электронодонорный мезомерный эффект (+М-эффект) описывает повышение электронной плотности в ароматическом кольце. В сопряжение с -электронами ароматического кольца могут вступать только неподеленные электронные пары, находящиеся на высших уровнях атома, связанного с бензольным ядром.
Действие электроноакцепторного эффекта сопряжения (-М-эффект) проявляется в понижении электронной плотности в ароматическом кольце, особенно в о- и п-положениях. Заместители, проявляющие электроноакцепторный мезомерный эффект, обычно имеют кратные связи между атомами с различной электроотрицательностью, при этом более электроотрицательный атом удалён от кольца, а положительно заряженный атом присоединён к ароматическому кольцу.
Группы, подающие электроны, называются электродонорными, группы, оттягивающие электроны – электроноакцепторными.
Любая группа, связанная с кольцом, влияет на дальнейшее течение электрофильного замещения. Это влияние выражается, во-первых, в изменении реакционной способности соединения по сравнению с бензолом; во-вторых, в направлении атаки электрофила в определенные положения кольца.
