- •1. Алканы
- •Введение
- •1. Классификация органических соединений
- •2. Классификация органических реакций
- •3. Способы образования ковалентной связи
- •4. Гибридизация атомных орбиталей и форма органических молекул
- •4.1. Sp3-Гибридизация
- •4.2. Sр2-Гибридизация
- •4.3. Sp-Гибридизация
- •5. Алканы
- •Гомологический ряд алканов. Число структурных изомеров
- •5.1. Физические свойства
- •5.2. Химические свойства
- •5.2.1. Галогенирование
- •Зависимость реакционной способности галогенов от энергии связи h–Hal
- •5.2.2. Нитрование
- •5.3.4. Декарбоксилирование карбоновых кислот
- •6.2. Плоскополяризованный свет. Оптическая активность
- •6.3. Строение молекул и оптическая активность
- •6.4. Обозначение конфигураций
- •7. Циклоалканы
- •7.1 Номенклатура. Изомерия
- •7.2. Физические свойства
- •7.3. Типы напряжения
- •7.4. Строение
- •Теплоты сгорания и энергии напряжения циклоалканов
- •7.4.1. Особенности пространственного строения некоторых циклоалканов
- •7.5. Химические свойства
- •7.6. Способы получения
- •8.1. Физические свойства
- •Физические свойства алкенов
- •8.2. Химические свойства
- •8.2.1. Присоединение галогенов
- •8.2.1.1. Механизм реакции
- •8.2.1.2. Реакционная способность галогенов в реакции АdЕ
- •8.2.2. Присоединение галогеноводородов
- •8.2.2.1. Механизм реакции
- •8.2.2.2. Направление электрофильного присоединения
- •8.2.2.3. Реакционная способность и селективность
- •8.2.2.4. Перегруппировка
- •Механизм реакции
- •8.2.3. Присоединение бромистого водорода в присутствии
- •1. Инициирование:
- •2. Рост цепи:
- •3. Обрыв цепи:
- •8.2.4. Присоединение серной кислоты
- •8.2.5. Гидратация алкенов. Присоединение спиртов
- •8.2.6. Гидроборирование алкенов
- •8.2.7. Алкилирование алкенов
- •8.2.8. Гидрирование. Теплота гидрирования
- •8.2.9. Теплота гидрирования и устойчивость алкенов
- •8.2.10. Окисление
- •8.2.11. Полимеризация алкенов
- •8.2.12. Реакция аллильного замещения. Галогенирование
- •8.3. Способы получения алкенов
- •9.1. Устойчивость сопряженных диенов
- •9.2. Химические свойства
- •9.2.1. Электрофильное присоединение
- •9.2.2. 1,2- И 1,4-Присоединение. Кинетический контроль, термодинамический контроль
- •9.2.3. Диеновый синтез. Реакция Дильса-Альдера
- •9.2.4. Полимеризация
- •9.3. Способы получения
- •10. Алкины
- •Характеристики химических связей в молекуле алкинов
- •10.1. Физические свойства
- •10.2. Химические свойства
- •10.2.1. Реакции присоединеня
- •10.2.1.1. Каталитическое гидрирование и восстановление
- •10.2.1.2. Реакции электрофильного присоединения Галогенирование
- •Гидрогалогенирование
- •Гидратация
- •10.2.1.3. Нуклеофильное присоединение
- •10.2.2. Кислотность алкинов
- •Константы кислотности некоторых соединений
- •10.2.3. Взаимодействие алкинов с карбонильными соединениями
- •10.2.4. Окисление алкинов
- •10.2.5. Радикальное присоединение бромоводорода
- •10.3. Способы получения
- •11. Арены
- •11.1. Сравнение свойств бензола со свойствами алкенов
- •11.2. Теплота гидрирования. Энергия резонанса
- •11.3. Строение бензола
- •11.4. Ароматичность
- •11.5. Физические свойства
- •Физические свойства аренов
- •11.6. Химические свойства
- •11.6.1. Электрофильное замещение
- •11.6.2. Свободнорадикальное замещение в боковой цепи аренов
- •11.6.3. Реакции окисления
- •11.7. Методы синтеза аренов
- •12.1. Влияние заместителей на реакционную способность бензольного кольца
- •12.2. Влияние заместителя на выбор места электрофильной атаки
- •13. Многоядерные ароматические соединения
- •13.1. Нафталин
- •13.2. Антрацен и фенантрен
- •14. Гетероциклические соединения
- •14.1. Пятичленные гетероциклы
- •14.1.1. Строение
- •14.1.2. Химические свойства
- •14.1.3. Способы получения
- •14.2. Пиридин
- •14.2.1. Строение пиридина
- •14.2.2. Химические свойства
- •14.3. Хинолин
- •15. Галогеналканы
- •15.1. Нуклеофильное замещение
- •15.1.1. Бимолекулярное нуклеофильное замещение
- •15.1.2. Мономолекулярное нуклеофильное замещение
- •15.1.3. Сравнение реакций sn 1 и sn 2
- •15.2. Реакции отщепления (элиминирование)
- •15.2.1. Бимолекулярное отщепление е2
- •15.2.2. Мономолекулярное отщепление е1
- •15.2.3. Сравнение реакций нуклеофильного замещения и элиминирования
- •15.3. Методы синтеза галогеналканов
- •16.2. Нуклеофильное замещение, протекающее через стадию образования дегидробензола, - отщепление - присоединение
- •16.3. Бимолекулярное нуклеофильное замещение sn2Ar
- •16.4. Ориентация при нуклеофильном замещении в ароматическом кольце
- •17. Магнийорганические соединения
- •17.1. Получение и строение магнийорганических соединений
- •17.2. Синтез спиртов и кислот
- •Библиографический список
- •Оглавление
- •Часть 1
11.4. Ароматичность
Какие свойства должно проявлять вещество для того, чтобы его можно было отнести к ароматическим соединениям? Ароматичность можно определить с точки зрения кинетической устойчивости. Ароматическими называются соединения с молекулярной формулой, указывающей на высокую степень ненасыщенности, которые, однако, не реагируют как ненасыщенные соединения (кинетическая устойчивость), а вступают в реакции электрофильного замещения; для них характерна высокая термодинамическая устойчивость.
Условие ароматичности определяется правилом Хюккеля.
Ароматическими свойствами обладает соединение, если его строение удовлетворяет следующим требованиям:
соединение включает в себя плоскую моно- или полициклическую структуру,
каждый цикл в этой структуре содержит замкнутую систему делокализованных -электронов,
число -электронов в цикле должно равняться (4n+2), где n= 0, 1, 2, ...(целое число).
Для n=1 число сопряженных -электронов в ароматической системе равно шести. В бензоле как раз имеется циклическая шести--электронная система - ароматический секстет. Таким образом, бензол отвечает правилу Хюккеля.
11.5. Физические свойства
Физические свойства аренов похожи на свойства углеводородов других классов. Арены представляют собой малополярные соединения, плохо растворимые в воде, но растворимые в неполярных и слабополярных растворителях: гексане, эфире, четыреххлористом углероде.
Температура кипения аренов несколько выше, чем температура кипения углеводородов жирного ряда с тем же числом атомов углерода.
Температура кипения алкилбензолов растёт с увеличением молекулярной массы так же, как и в ряду алканов. Увеличение температуры кипения за счёт удлинения алкильной линейной цепочки на один атом углерода составляет 20-30 ºС. Разветвлённые алкилбензолы кипят при более низкой, а плавятся при более высокой температуре, чем их изомеры с линейной углеродной цепью.
|
|
|
|
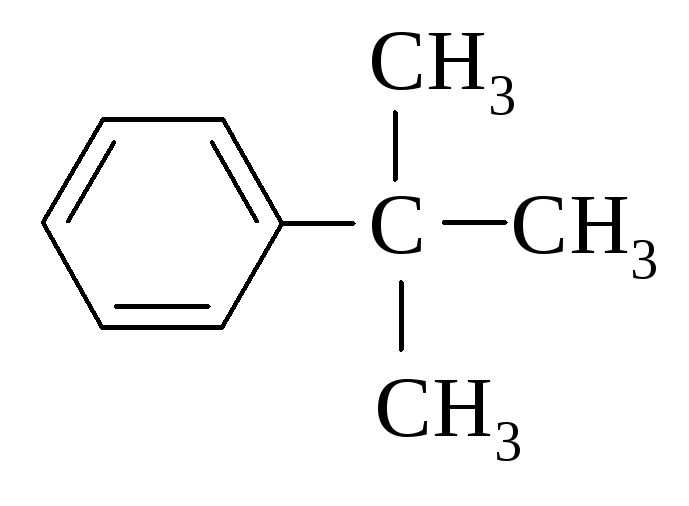
н-Бутилбензол Ткип = 183 оС Тпл = -81 оС |
трет-Бутилбензол Ткип = 169 оС Тпл = -58 оС |
Температуры кипения мета- и пара-изомеров диалкилбензолов приблизительно одинаковы, а температура кипения орто-изомера на несколько градусов выше. Плавление сопровождается разрушением межмолекулярных сил в кристалле; более симметричные молекулы более плотно упаковываются в кристаллической решетке. Чем прочнее кристаллическая решетка, тем выше температура плавления. Поэтому для дизамещенных производных бензола характерна такая закономерность: температура плавления наиболее симметричного пара-изомера обычно превышает температуры плавления менее симметричных орто- и мета-изомеров (см. табл. 11.2). Высокой степенью симметрии обладает бензол. Его температура плавления достаточно высока - плюс 5 оС.
Вследствие того, что растворение, так же как и плавление, связано с разрушением кристаллической решетки, пара-изомер менее растворим, чем орто- и мета-изомеры диалкилбензолов.
Для аренов характерны высокие значения показателя преломления (см. табл. 11.2). Это является следствием сопряжения -электронов и повышенной поляризуемости сопряжённой -электронной системы ароматического ядра. Особенно большое значение показателя преломления у стирола, так как в нем с -электронами ароматического кольца дополнительно сопряжена винильная группа.
Таблица 11.2