
- •1. Алканы
- •Введение
- •1. Классификация органических соединений
- •2. Классификация органических реакций
- •3. Способы образования ковалентной связи
- •4. Гибридизация атомных орбиталей и форма органических молекул
- •4.1. Sp3-Гибридизация
- •4.2. Sр2-Гибридизация
- •4.3. Sp-Гибридизация
- •5. Алканы
- •Гомологический ряд алканов. Число структурных изомеров
- •5.1. Физические свойства
- •5.2. Химические свойства
- •5.2.1. Галогенирование
- •Зависимость реакционной способности галогенов от энергии связи h–Hal
- •5.2.2. Нитрование
- •5.3.4. Декарбоксилирование карбоновых кислот
- •6.2. Плоскополяризованный свет. Оптическая активность
- •6.3. Строение молекул и оптическая активность
- •6.4. Обозначение конфигураций
- •7. Циклоалканы
- •7.1 Номенклатура. Изомерия
- •7.2. Физические свойства
- •7.3. Типы напряжения
- •7.4. Строение
- •Теплоты сгорания и энергии напряжения циклоалканов
- •7.4.1. Особенности пространственного строения некоторых циклоалканов
- •7.5. Химические свойства
- •7.6. Способы получения
- •8.1. Физические свойства
- •Физические свойства алкенов
- •8.2. Химические свойства
- •8.2.1. Присоединение галогенов
- •8.2.1.1. Механизм реакции
- •8.2.1.2. Реакционная способность галогенов в реакции АdЕ
- •8.2.2. Присоединение галогеноводородов
- •8.2.2.1. Механизм реакции
- •8.2.2.2. Направление электрофильного присоединения
- •8.2.2.3. Реакционная способность и селективность
- •8.2.2.4. Перегруппировка
- •Механизм реакции
- •8.2.3. Присоединение бромистого водорода в присутствии
- •1. Инициирование:
- •2. Рост цепи:
- •3. Обрыв цепи:
- •8.2.4. Присоединение серной кислоты
- •8.2.5. Гидратация алкенов. Присоединение спиртов
- •8.2.6. Гидроборирование алкенов
- •8.2.7. Алкилирование алкенов
- •8.2.8. Гидрирование. Теплота гидрирования
- •8.2.9. Теплота гидрирования и устойчивость алкенов
- •8.2.10. Окисление
- •8.2.11. Полимеризация алкенов
- •8.2.12. Реакция аллильного замещения. Галогенирование
- •8.3. Способы получения алкенов
- •9.1. Устойчивость сопряженных диенов
- •9.2. Химические свойства
- •9.2.1. Электрофильное присоединение
- •9.2.2. 1,2- И 1,4-Присоединение. Кинетический контроль, термодинамический контроль
- •9.2.3. Диеновый синтез. Реакция Дильса-Альдера
- •9.2.4. Полимеризация
- •9.3. Способы получения
- •10. Алкины
- •Характеристики химических связей в молекуле алкинов
- •10.1. Физические свойства
- •10.2. Химические свойства
- •10.2.1. Реакции присоединеня
- •10.2.1.1. Каталитическое гидрирование и восстановление
- •10.2.1.2. Реакции электрофильного присоединения Галогенирование
- •Гидрогалогенирование
- •Гидратация
- •10.2.1.3. Нуклеофильное присоединение
- •10.2.2. Кислотность алкинов
- •Константы кислотности некоторых соединений
- •10.2.3. Взаимодействие алкинов с карбонильными соединениями
- •10.2.4. Окисление алкинов
- •10.2.5. Радикальное присоединение бромоводорода
- •10.3. Способы получения
- •11. Арены
- •11.1. Сравнение свойств бензола со свойствами алкенов
- •11.2. Теплота гидрирования. Энергия резонанса
- •11.3. Строение бензола
- •11.4. Ароматичность
- •11.5. Физические свойства
- •Физические свойства аренов
- •11.6. Химические свойства
- •11.6.1. Электрофильное замещение
- •11.6.2. Свободнорадикальное замещение в боковой цепи аренов
- •11.6.3. Реакции окисления
- •11.7. Методы синтеза аренов
- •12.1. Влияние заместителей на реакционную способность бензольного кольца
- •12.2. Влияние заместителя на выбор места электрофильной атаки
- •13. Многоядерные ароматические соединения
- •13.1. Нафталин
- •13.2. Антрацен и фенантрен
- •14. Гетероциклические соединения
- •14.1. Пятичленные гетероциклы
- •14.1.1. Строение
- •14.1.2. Химические свойства
- •14.1.3. Способы получения
- •14.2. Пиридин
- •14.2.1. Строение пиридина
- •14.2.2. Химические свойства
- •14.3. Хинолин
- •15. Галогеналканы
- •15.1. Нуклеофильное замещение
- •15.1.1. Бимолекулярное нуклеофильное замещение
- •15.1.2. Мономолекулярное нуклеофильное замещение
- •15.1.3. Сравнение реакций sn 1 и sn 2
- •15.2. Реакции отщепления (элиминирование)
- •15.2.1. Бимолекулярное отщепление е2
- •15.2.2. Мономолекулярное отщепление е1
- •15.2.3. Сравнение реакций нуклеофильного замещения и элиминирования
- •15.3. Методы синтеза галогеналканов
- •16.2. Нуклеофильное замещение, протекающее через стадию образования дегидробензола, - отщепление - присоединение
- •16.3. Бимолекулярное нуклеофильное замещение sn2Ar
- •16.4. Ориентация при нуклеофильном замещении в ароматическом кольце
- •17. Магнийорганические соединения
- •17.1. Получение и строение магнийорганических соединений
- •17.2. Синтез спиртов и кислот
- •Библиографический список
- •Оглавление
- •Часть 1
10.1. Физические свойства
Алкины малополярные соединения, их физические свойства сходны со свойствами алканов и алкенов: они также нерастворимы в воде, но растворимы в таких органических растворителях, как эфир, четырёххлористый углерод, бензол; плотность их меньше плотности воды. Низшие алкины - газы; температуры кипения алкинов повышаются с увеличением числа атомов углерода; разветвление цепи в молекуле изомера понижает температуру кипения.
Отличительным свойством ацетилена и его гомологов с одной алкильной группой является поглощение в области 3300 см-1 , соответствующее валентным колебаниям (С–Н). Увеличение частоты в ряду (Сsp3 –H), (Сsp2 –H), (Сsp –H) объясняется увеличением доли s-состояния гибридных орбиталей атомов углерода, образующих связи С–Н, при этом связь С–Н становится более короткой, прочной и более жёсткой.
Благодаря наличию частичных положительных зарядов на атомах водорода групп С–Н между атомом водорода ацетилена и атомами кислорода и азота других органических соединений (кетонов, эфиров, аминов) возникает сильное диполь-дипольное взаимодействие.
![]()
Поэтому ацетилен достаточно хорошо растворим в полярных органических растворителях.
10.2. Химические свойства
Химические свойства алкинов обусловлены их способностью реагировать двумя путями:
1). Посредством раскрытия кратной связи - реакции присоединения;
2). Посредством замещения атома водорода при углероде с тройной связью.
10.2.1. Реакции присоединеня
10.2.1.1. Каталитическое гидрирование и восстановление
Гидрирование алкинов и алкенов протекает примерно в одних и тех же условиях. Каталитическое гидрирование алкинов в присутствии таких катализаторов, как никель, платина, палладий, происходит с образованием алкана.
![]()
Можно подобрать условия, в которых каталитическое присоединение водорода к алкинам может происходить в одну стадию с образованием алкена.
![]()
При этом используют специальные “отравленные” катализаторы – катализаторы с пониженной активностью. Примером такого катализатора является палладий, нанесенный на карбонат кальция и дезактивированный ацетатом свинца. Это катализатор Линдлара, который позволяет восстанавливать алкины до алкенов, предотвращая дальнейшее восстановление до алкана. Гидрирование на этом катализаторе протекает стереоселективно с образованием до 96 % цис-алкенов и 5-10 % транс-алкена.
Реакция, предпочтительно приводящая к одному из нескольких возможных пространственных изомеров, называется стереоселективной
Восстановление алкинов в жидком аммиаке ведёт преимущественно к образованию транс-алкена.

Это объясняется тем, что реакция протекает через образование более устойчивого (пространственно незатруднённого) радикала.
Сначала натрий отдает электрон углероду тройной связи и образуется анион-радикал.
![]()
Затем анион-радикал взаимодействует с аммиаком и образуется радикал.

Реакция завершается переносом электрона от натрия и взаимодействием образовавшегося аниона с аммиаком.

Таким же образом алкины восстанавливаются литийалюминийгидридом.

10.2.1.2. Реакции электрофильного присоединения Галогенирование
Алкины, как и алкены, имеют доступные для атаки -электроны и вступают в реакции электрофильного присоединения. Но из-за повышенной электроотрицательности sp-гибридизованных атомов углерода и укороченности связей поляризуемость -электронов тройной связи СС уменьшена, поэтому тройная углерод-углеродная связь по сравнению с двойной связью СС менее реакционноспособна в отношении электрофильных реагентов.
Электрофильное присоединение галогенов (хлора, брома) к алкинам протекает аналогично реакции присоединения к алкенам.
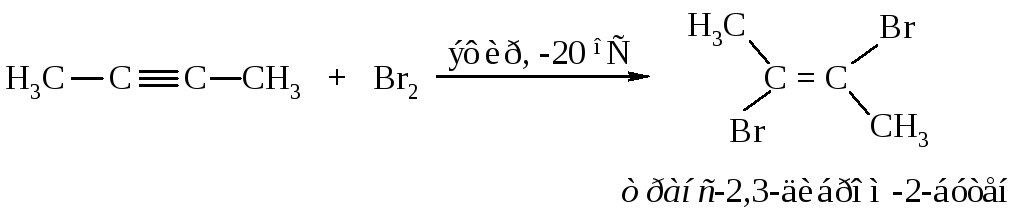
В первой быстрой стадии -электроны тройной связи отталкивают электроны ближайшего атома брома к удалённому атому брома; происходит поляризация молекулы брома и образование -комплекса.

Во второй стадии -комплекс перестраивается в циклический бромониевый катион, который является простейшим устойчивым сопряжённым соединением (число -электронов равно двум). Эта стадия является медленной скорость лимитирующей.

На третьей стадии происходит присоединение аниона брома преимущественно в транс-положение, со стороны, противоположной брому образовавшегося катиона, так как цис-присоединение стерически затруднено из-за большого объёма электронных оболочек брома.

Эта реакция является примером реакции с высокой степенью стереоселективности.
При избытке брома в качестве конечного продукта бромирования ацетилена получается 2,2,3,3-тетрабромбутан.
