
- •1. Алканы
- •Введение
- •1. Классификация органических соединений
- •2. Классификация органических реакций
- •3. Способы образования ковалентной связи
- •4. Гибридизация атомных орбиталей и форма органических молекул
- •4.1. Sp3-Гибридизация
- •4.2. Sр2-Гибридизация
- •4.3. Sp-Гибридизация
- •5. Алканы
- •Гомологический ряд алканов. Число структурных изомеров
- •5.1. Физические свойства
- •5.2. Химические свойства
- •5.2.1. Галогенирование
- •Зависимость реакционной способности галогенов от энергии связи h–Hal
- •5.2.2. Нитрование
- •5.3.4. Декарбоксилирование карбоновых кислот
- •6.2. Плоскополяризованный свет. Оптическая активность
- •6.3. Строение молекул и оптическая активность
- •6.4. Обозначение конфигураций
- •7. Циклоалканы
- •7.1 Номенклатура. Изомерия
- •7.2. Физические свойства
- •7.3. Типы напряжения
- •7.4. Строение
- •Теплоты сгорания и энергии напряжения циклоалканов
- •7.4.1. Особенности пространственного строения некоторых циклоалканов
- •7.5. Химические свойства
- •7.6. Способы получения
- •8.1. Физические свойства
- •Физические свойства алкенов
- •8.2. Химические свойства
- •8.2.1. Присоединение галогенов
- •8.2.1.1. Механизм реакции
- •8.2.1.2. Реакционная способность галогенов в реакции АdЕ
- •8.2.2. Присоединение галогеноводородов
- •8.2.2.1. Механизм реакции
- •8.2.2.2. Направление электрофильного присоединения
- •8.2.2.3. Реакционная способность и селективность
- •8.2.2.4. Перегруппировка
- •Механизм реакции
- •8.2.3. Присоединение бромистого водорода в присутствии
- •1. Инициирование:
- •2. Рост цепи:
- •3. Обрыв цепи:
- •8.2.4. Присоединение серной кислоты
- •8.2.5. Гидратация алкенов. Присоединение спиртов
- •8.2.6. Гидроборирование алкенов
- •8.2.7. Алкилирование алкенов
- •8.2.8. Гидрирование. Теплота гидрирования
- •8.2.9. Теплота гидрирования и устойчивость алкенов
- •8.2.10. Окисление
- •8.2.11. Полимеризация алкенов
- •8.2.12. Реакция аллильного замещения. Галогенирование
- •8.3. Способы получения алкенов
- •9.1. Устойчивость сопряженных диенов
- •9.2. Химические свойства
- •9.2.1. Электрофильное присоединение
- •9.2.2. 1,2- И 1,4-Присоединение. Кинетический контроль, термодинамический контроль
- •9.2.3. Диеновый синтез. Реакция Дильса-Альдера
- •9.2.4. Полимеризация
- •9.3. Способы получения
- •10. Алкины
- •Характеристики химических связей в молекуле алкинов
- •10.1. Физические свойства
- •10.2. Химические свойства
- •10.2.1. Реакции присоединеня
- •10.2.1.1. Каталитическое гидрирование и восстановление
- •10.2.1.2. Реакции электрофильного присоединения Галогенирование
- •Гидрогалогенирование
- •Гидратация
- •10.2.1.3. Нуклеофильное присоединение
- •10.2.2. Кислотность алкинов
- •Константы кислотности некоторых соединений
- •10.2.3. Взаимодействие алкинов с карбонильными соединениями
- •10.2.4. Окисление алкинов
- •10.2.5. Радикальное присоединение бромоводорода
- •10.3. Способы получения
- •11. Арены
- •11.1. Сравнение свойств бензола со свойствами алкенов
- •11.2. Теплота гидрирования. Энергия резонанса
- •11.3. Строение бензола
- •11.4. Ароматичность
- •11.5. Физические свойства
- •Физические свойства аренов
- •11.6. Химические свойства
- •11.6.1. Электрофильное замещение
- •11.6.2. Свободнорадикальное замещение в боковой цепи аренов
- •11.6.3. Реакции окисления
- •11.7. Методы синтеза аренов
- •12.1. Влияние заместителей на реакционную способность бензольного кольца
- •12.2. Влияние заместителя на выбор места электрофильной атаки
- •13. Многоядерные ароматические соединения
- •13.1. Нафталин
- •13.2. Антрацен и фенантрен
- •14. Гетероциклические соединения
- •14.1. Пятичленные гетероциклы
- •14.1.1. Строение
- •14.1.2. Химические свойства
- •14.1.3. Способы получения
- •14.2. Пиридин
- •14.2.1. Строение пиридина
- •14.2.2. Химические свойства
- •14.3. Хинолин
- •15. Галогеналканы
- •15.1. Нуклеофильное замещение
- •15.1.1. Бимолекулярное нуклеофильное замещение
- •15.1.2. Мономолекулярное нуклеофильное замещение
- •15.1.3. Сравнение реакций sn 1 и sn 2
- •15.2. Реакции отщепления (элиминирование)
- •15.2.1. Бимолекулярное отщепление е2
- •15.2.2. Мономолекулярное отщепление е1
- •15.2.3. Сравнение реакций нуклеофильного замещения и элиминирования
- •15.3. Методы синтеза галогеналканов
- •16.2. Нуклеофильное замещение, протекающее через стадию образования дегидробензола, - отщепление - присоединение
- •16.3. Бимолекулярное нуклеофильное замещение sn2Ar
- •16.4. Ориентация при нуклеофильном замещении в ароматическом кольце
- •17. Магнийорганические соединения
- •17.1. Получение и строение магнийорганических соединений
- •17.2. Синтез спиртов и кислот
- •Библиографический список
- •Оглавление
- •Часть 1
9.3. Способы получения
Наиболее важные сопряженные диены 1,3-бутадиен (дивинил), 2-метил-1,3-бутадиен (изопрен) получают из соответствующих алканов дегидрированием.

Аналогично алкенам диены могут быть получены реакцией дегидрогалогенирования дигалогенпроизводных алканов и дегидратации диолов.
1,3-Бутадиен также получают высокотемпературной каталитической реакцией дегидрирования и дегидратации этанола (процесс С.В. Лебедева).
![]()
Дивинил может быть получен из ацетилена и формальдегида по методу В. Реппе (см. п. 5.3.3).
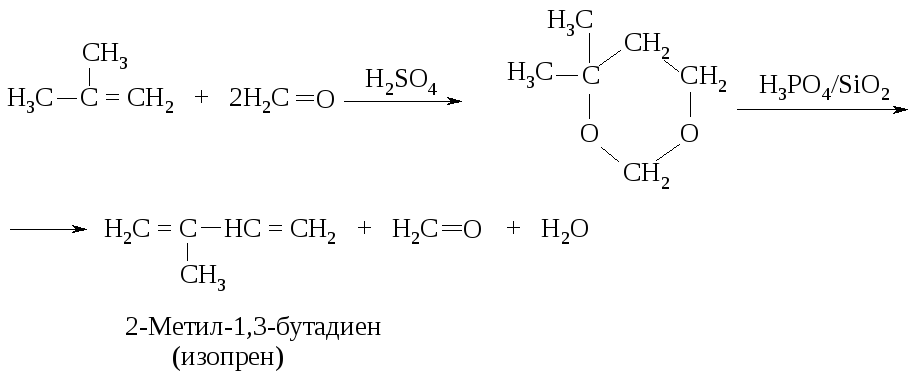
Изопрен получают по методу Г. Принса.
10. Алкины
Алкинами называются углеводороды, содержащие тройную углерод-углеродную связь –СС–.
Общая формула простых алкинов СnH2n-2. Простейшим представителем класса алкинов является ацетилен H–СС–H, поэтому алкины называют также ацетиленовыми углеводородами.
Атомы углерода ацетилена находятся в sp-гибридном состоянии. При гибридизации 2s-орбитали и 2р-орбитали образуются две равноценные sp-гибридные орбитали, расположенные на одной прямой, и остаются две негибридизованные р-орбитали.
В молекуле ацетилена простая связь (-связь) между атомами углерода образована перекрыванием двух sp-гибридизованных орбиталей. Две взаимно перпендикулярные -связи возникают при боковом перекрывании двух пар негибридизованных 2р-орбиталей, -электронные облака охватывают скелет так, что электронное облако имеет симметрию, близкую к цилиндрической. Связи с атомами водорода образуются за счёт sp-гибридных орбиталей атома углерода и 1s-орбитали атома водорода, молекула ацетилена линейна.
В пропине простая связь (-связь) Сsp-Сsp3 короче аналогичной связи Сsp-Сsp2 в алкенах, это объясняется тем, что sp-орбиталь ближе к ядру, чем sp2- орбиталь .
Тройная углерод-углеродная связь С С короче двойной связи, а общая энергия тройной связи приблизительно равна сумме энергий одной простой связи С–С (347 кДж/моль) и двух -связей (259·2 кДж/моль) (табл. 10.1).
Таблица 10.1
Характеристики химических связей в молекуле алкинов
|
Соединение |
Связи между атомами С |
Связи С–Н | ||||||||
|
СС |
С–С |
Н–С |
Сsp3–Н | |||||||
|
l102, нм |
Е, кДж/моль |
l102, нм |
Е, кДж/моль |
l102, нм |
Е, кДж/моль |
, Д |
l102, нм |
Е, кДж/моль |
, Д | |
|
НСС–СН3 |
12,0 |
828 |
14,6 |
347 |
10,6 |
464 |
1,1 |
11,0 |
355 |
0,3 |
Особый интерес представляет связь С-Н. Эта связь короче и прочнее аналогичных связей углерод-водород в алкенах и алканах (табл. 10.2).
Таблица 10.2
Характеристики связей С-Н в алканах, алкенах и алкинах
|
Углеводород |
Длина, l102, нм |
Энергия Е, кДж/моль |
Доля s-орбитали атома углерода, % |
Дипольный момент , Д |
|
|
11,0 |
405 |
25,0 |
0,3 |
|
|
10,9 |
435 |
33,3 |
0,6 |
|
|
10,6 |
464 |
50,0 |
1,08 |
Связь С–Н имеет заметную полярность, связанную с большей долей s-состояния гибридной орбитали и, вследствие этого, с большей близостью электронной пары связи С–Н к углероду.
![]()
В результате смещения электронного облака -связи от атома водорода к атому углерода атом водорода становится отчасти положительно заряженным - кислотным.
Энергия диссоциации связи углерод-водород в ацетилене С–Н больше, чем в этилене; sp-гибридизация затрудняет гомолитический разрыв связи С–Н с образованием радикалов, но облегчает гетеролитический разрыв этой связи с образованием ионов.


