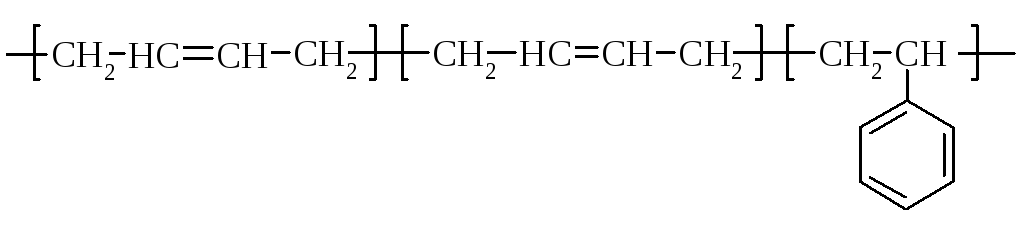- •1. Алканы
- •Введение
- •1. Классификация органических соединений
- •2. Классификация органических реакций
- •3. Способы образования ковалентной связи
- •4. Гибридизация атомных орбиталей и форма органических молекул
- •4.1. Sp3-Гибридизация
- •4.2. Sр2-Гибридизация
- •4.3. Sp-Гибридизация
- •5. Алканы
- •Гомологический ряд алканов. Число структурных изомеров
- •5.1. Физические свойства
- •5.2. Химические свойства
- •5.2.1. Галогенирование
- •Зависимость реакционной способности галогенов от энергии связи h–Hal
- •5.2.2. Нитрование
- •5.3.4. Декарбоксилирование карбоновых кислот
- •6.2. Плоскополяризованный свет. Оптическая активность
- •6.3. Строение молекул и оптическая активность
- •6.4. Обозначение конфигураций
- •7. Циклоалканы
- •7.1 Номенклатура. Изомерия
- •7.2. Физические свойства
- •7.3. Типы напряжения
- •7.4. Строение
- •Теплоты сгорания и энергии напряжения циклоалканов
- •7.4.1. Особенности пространственного строения некоторых циклоалканов
- •7.5. Химические свойства
- •7.6. Способы получения
- •8.1. Физические свойства
- •Физические свойства алкенов
- •8.2. Химические свойства
- •8.2.1. Присоединение галогенов
- •8.2.1.1. Механизм реакции
- •8.2.1.2. Реакционная способность галогенов в реакции АdЕ
- •8.2.2. Присоединение галогеноводородов
- •8.2.2.1. Механизм реакции
- •8.2.2.2. Направление электрофильного присоединения
- •8.2.2.3. Реакционная способность и селективность
- •8.2.2.4. Перегруппировка
- •Механизм реакции
- •8.2.3. Присоединение бромистого водорода в присутствии
- •1. Инициирование:
- •2. Рост цепи:
- •3. Обрыв цепи:
- •8.2.4. Присоединение серной кислоты
- •8.2.5. Гидратация алкенов. Присоединение спиртов
- •8.2.6. Гидроборирование алкенов
- •8.2.7. Алкилирование алкенов
- •8.2.8. Гидрирование. Теплота гидрирования
- •8.2.9. Теплота гидрирования и устойчивость алкенов
- •8.2.10. Окисление
- •8.2.11. Полимеризация алкенов
- •8.2.12. Реакция аллильного замещения. Галогенирование
- •8.3. Способы получения алкенов
- •9.1. Устойчивость сопряженных диенов
- •9.2. Химические свойства
- •9.2.1. Электрофильное присоединение
- •9.2.2. 1,2- И 1,4-Присоединение. Кинетический контроль, термодинамический контроль
- •9.2.3. Диеновый синтез. Реакция Дильса-Альдера
- •9.2.4. Полимеризация
- •9.3. Способы получения
- •10. Алкины
- •Характеристики химических связей в молекуле алкинов
- •10.1. Физические свойства
- •10.2. Химические свойства
- •10.2.1. Реакции присоединеня
- •10.2.1.1. Каталитическое гидрирование и восстановление
- •10.2.1.2. Реакции электрофильного присоединения Галогенирование
- •Гидрогалогенирование
- •Гидратация
- •10.2.1.3. Нуклеофильное присоединение
- •10.2.2. Кислотность алкинов
- •Константы кислотности некоторых соединений
- •10.2.3. Взаимодействие алкинов с карбонильными соединениями
- •10.2.4. Окисление алкинов
- •10.2.5. Радикальное присоединение бромоводорода
- •10.3. Способы получения
- •11. Арены
- •11.1. Сравнение свойств бензола со свойствами алкенов
- •11.2. Теплота гидрирования. Энергия резонанса
- •11.3. Строение бензола
- •11.4. Ароматичность
- •11.5. Физические свойства
- •Физические свойства аренов
- •11.6. Химические свойства
- •11.6.1. Электрофильное замещение
- •11.6.2. Свободнорадикальное замещение в боковой цепи аренов
- •11.6.3. Реакции окисления
- •11.7. Методы синтеза аренов
- •12.1. Влияние заместителей на реакционную способность бензольного кольца
- •12.2. Влияние заместителя на выбор места электрофильной атаки
- •13. Многоядерные ароматические соединения
- •13.1. Нафталин
- •13.2. Антрацен и фенантрен
- •14. Гетероциклические соединения
- •14.1. Пятичленные гетероциклы
- •14.1.1. Строение
- •14.1.2. Химические свойства
- •14.1.3. Способы получения
- •14.2. Пиридин
- •14.2.1. Строение пиридина
- •14.2.2. Химические свойства
- •14.3. Хинолин
- •15. Галогеналканы
- •15.1. Нуклеофильное замещение
- •15.1.1. Бимолекулярное нуклеофильное замещение
- •15.1.2. Мономолекулярное нуклеофильное замещение
- •15.1.3. Сравнение реакций sn 1 и sn 2
- •15.2. Реакции отщепления (элиминирование)
- •15.2.1. Бимолекулярное отщепление е2
- •15.2.2. Мономолекулярное отщепление е1
- •15.2.3. Сравнение реакций нуклеофильного замещения и элиминирования
- •15.3. Методы синтеза галогеналканов
- •16.2. Нуклеофильное замещение, протекающее через стадию образования дегидробензола, - отщепление - присоединение
- •16.3. Бимолекулярное нуклеофильное замещение sn2Ar
- •16.4. Ориентация при нуклеофильном замещении в ароматическом кольце
- •17. Магнийорганические соединения
- •17.1. Получение и строение магнийорганических соединений
- •17.2. Синтез спиртов и кислот
- •Библиографический список
- •Оглавление
- •Часть 1
9.2.3. Диеновый синтез. Реакция Дильса-Альдера
Сопряженные диены реагируют с ненасыщенными соединениями по схеме:
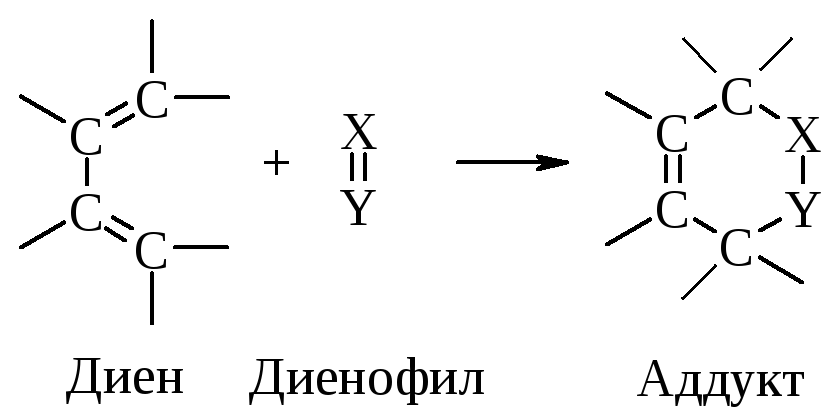
В реакциях Дильса-Альдера разрываются три -связи и образуются новые связи: одна - и две -связи. Поскольку -связи более стабильны, чем -связи, то эти реакции, как правило, экзотермичны. Однако это не означает, что они обязательно протекают самопроизвольно (спонтанно). Экзотермичность определяется разностью энергий исходных и конечных продуктов, а спонтанность зависит от энергии активации.
Многие из реакций диенового синтеза обратимы, т.е. при высокой температуре аддукт способен распадаться на исходные соединения. Этот процесс называют «ретродиеновый распад».
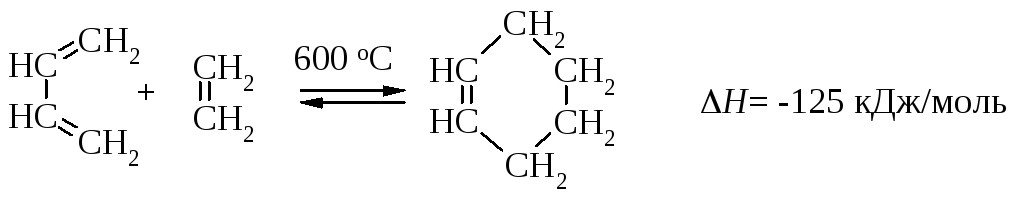
Реакция между 1,3-бутадиеном и этиленом экзотермична, но температура реакции (600 оС) указывает на то, что энергетический барьер превращения очень высокий.
Для того чтобы диенофил взаимодействовал одновременно с обоими концами диена, диен должен находиться в S-цис-конформации:

Упрощенную схему этого процесса можно себе представить следующим образом. Молекулы диена и диенофила ориентируются так, что оба конца диена одновременно сталкиваются с углеродными атомами диенофила.
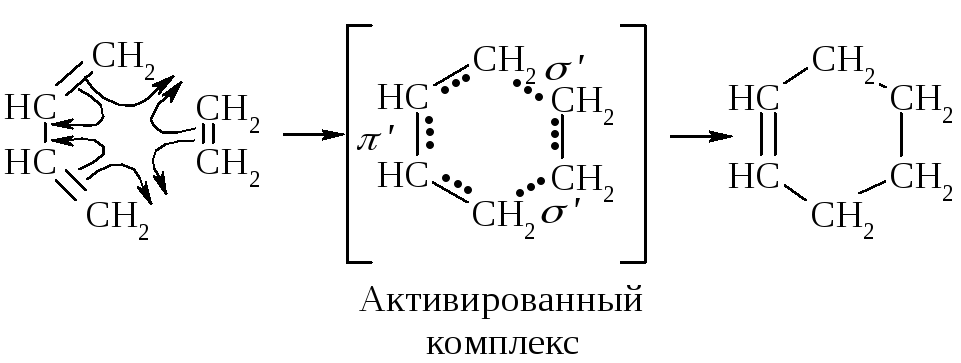
Если энергия молекул достаточно велика, т.е. достигается вершина энергетического барьера, начинается электронная перестройка. Это согласованный процесс, в активированном комплексе одновременно завязываются две -связи и одна -связь (они обозначены ' и ') и разрываются три -связи.
Реакция происходит с большой легкостью при наличии электронодонорных групп в диене и электроноакцепторных групп в диенофиле.
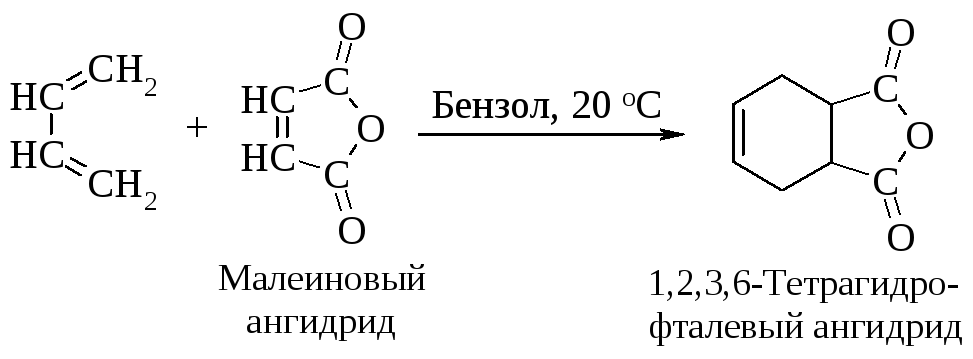
Активность диена возрастает в ряду:
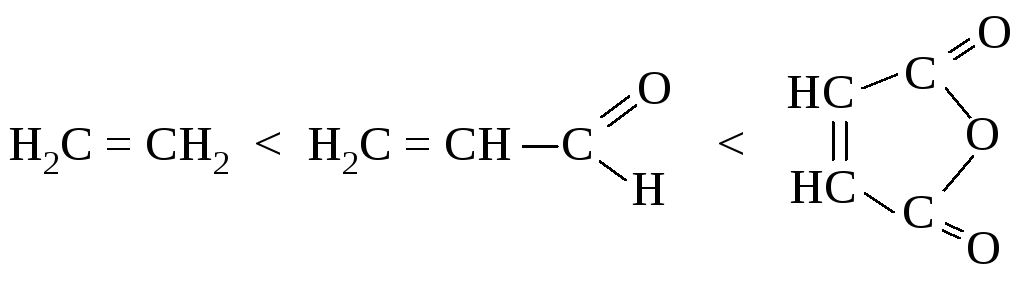
Если для диенового синтеза 1,3-бутадиена с этиленом необходима температура 600 оС, то малеиновый ангидрид мгновенно реагирует с 1,3-бутадиеном при 100 оC в растворе толуола.
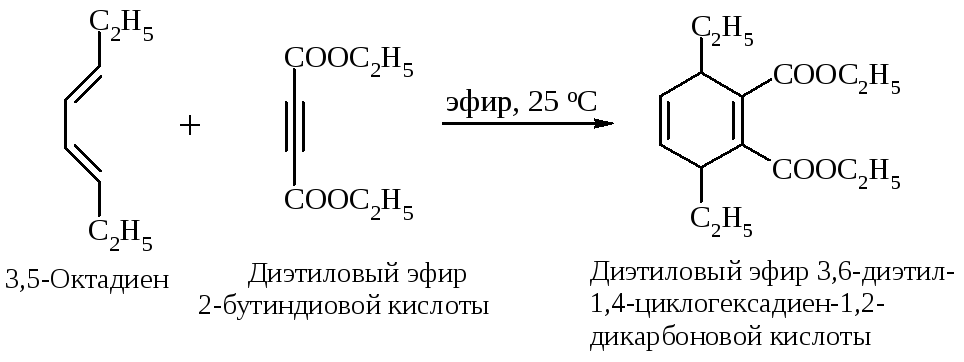
В качестве диенофила можно использовать замещенные алкины.
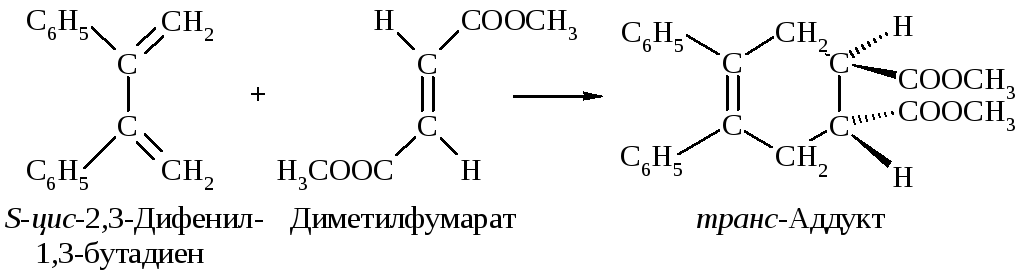
Реакция Дильса-Альдера стереоспецифична. Конфигурации диена и диенофила сохраняются при образовании аддукта.
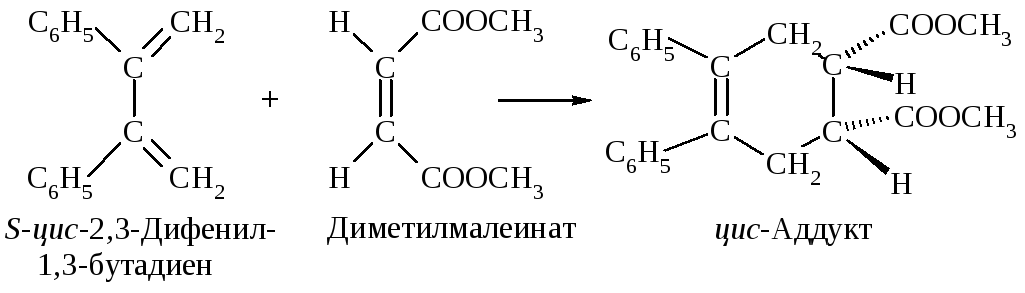
9.2.4. Полимеризация
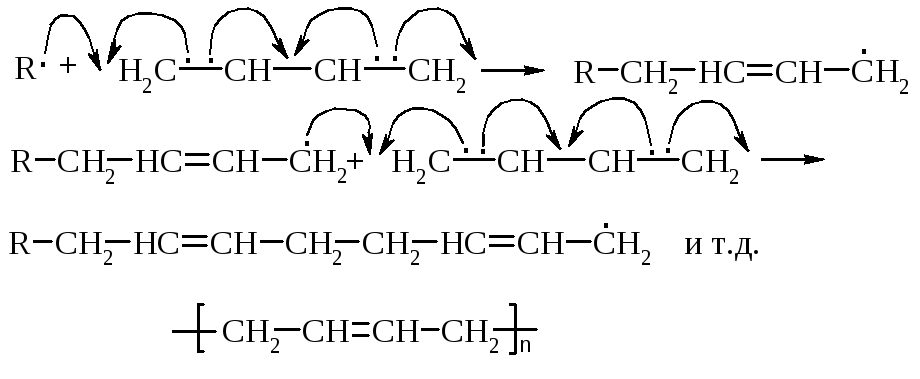
Полимеризация диенов предпочтительно идет по 1,4-положениям через образование наиболее устойчивых частиц.
Механизм:
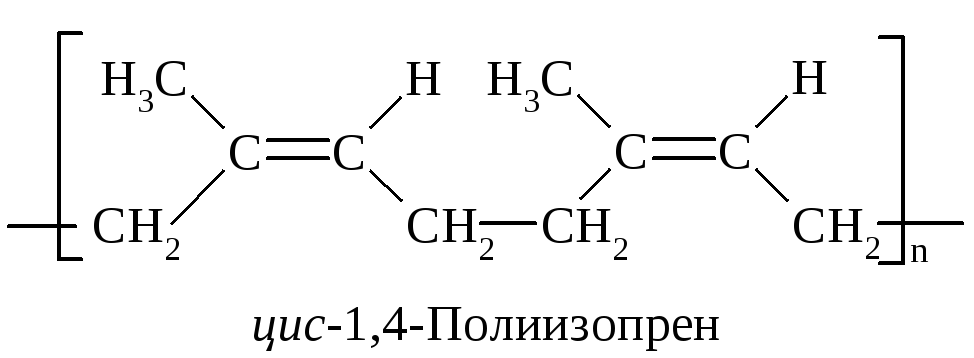
Натуральный каучук (НК) представляет собой полимер 2-метил-1,3-бутадиена (изопрена). В растениях-каучуконосах он образуется путем биосинтеза. В промышленности полимеризацией изопрена получают аналог натурального каучука - синтетический полиизопреновый каучук (СКИ). Структура НК и СКИ одинакова:
Полимеризация происходит по типу "голова к хвосту". Это обусловлено относительной стабилизацией промежуточных продуктов.
При полимеризации изопрена следует учитывать возможность образования цис- и транс-изомеров. НК и СКИ являются геометрическими цис-изомерами полиизопрена. Цепочки простых С-С-связей, образующих полимерную цепь, расположены по одну сторону от плоскостей -связей.
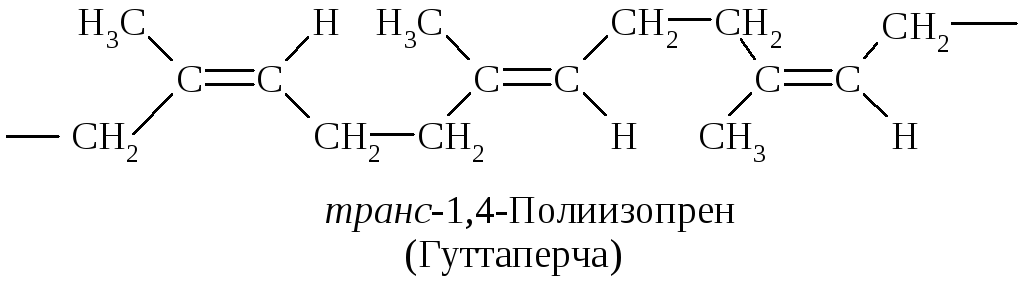
Гуттаперча - это геометрический транс-изомер полимера изопрена. Полимерные цепочки простых связей С-С находятся по разные стороны от плоскости каждой -связи.
Натуральный каучук при нагревании с серой превращается в эластичный и прочный материал - резину. Этот процесс, называемый вулканизацией, состоит в образовании сульфидных мостиков между различными полимерными цепями.
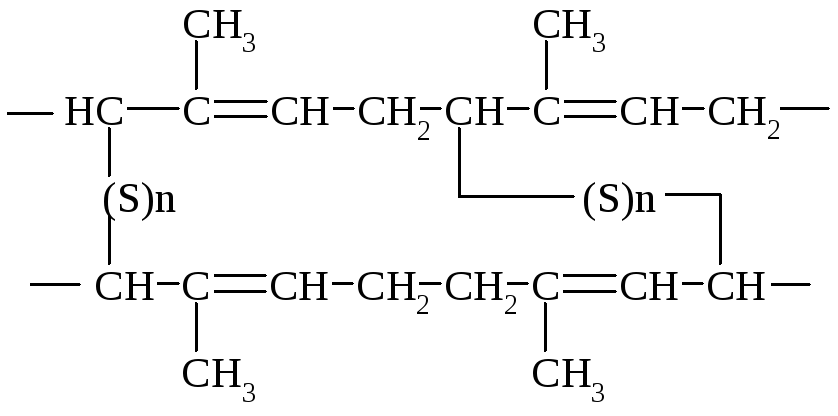
Аналогично изопрену хлоропрен (2-хлор-1,3-бутадиен) при свободно-радикальной полимеризации дает продукт 1,4-присоединения.
![]()
Этот полимер является масло- и бензостойким и устойчив к действию кислорода воздуха.
Большое значение имеют сополимеры диенов с другими мономерами. При сополимеризации 1,3-бутадиена (дивинила) и стирола (винилбензола) C6H5–CH=CH2 получают синтетический каучук дивинилстирольный - СКС. Этот сополимер состоит примерно из трех частей бутадиена и одной части стирола.