
- •1. Алканы
- •Введение
- •1. Классификация органических соединений
- •2. Классификация органических реакций
- •3. Способы образования ковалентной связи
- •4. Гибридизация атомных орбиталей и форма органических молекул
- •4.1. Sp3-Гибридизация
- •4.2. Sр2-Гибридизация
- •4.3. Sp-Гибридизация
- •5. Алканы
- •Гомологический ряд алканов. Число структурных изомеров
- •5.1. Физические свойства
- •5.2. Химические свойства
- •5.2.1. Галогенирование
- •Зависимость реакционной способности галогенов от энергии связи h–Hal
- •5.2.2. Нитрование
- •5.3.4. Декарбоксилирование карбоновых кислот
- •6.2. Плоскополяризованный свет. Оптическая активность
- •6.3. Строение молекул и оптическая активность
- •6.4. Обозначение конфигураций
- •7. Циклоалканы
- •7.1 Номенклатура. Изомерия
- •7.2. Физические свойства
- •7.3. Типы напряжения
- •7.4. Строение
- •Теплоты сгорания и энергии напряжения циклоалканов
- •7.4.1. Особенности пространственного строения некоторых циклоалканов
- •7.5. Химические свойства
- •7.6. Способы получения
- •8.1. Физические свойства
- •Физические свойства алкенов
- •8.2. Химические свойства
- •8.2.1. Присоединение галогенов
- •8.2.1.1. Механизм реакции
- •8.2.1.2. Реакционная способность галогенов в реакции АdЕ
- •8.2.2. Присоединение галогеноводородов
- •8.2.2.1. Механизм реакции
- •8.2.2.2. Направление электрофильного присоединения
- •8.2.2.3. Реакционная способность и селективность
- •8.2.2.4. Перегруппировка
- •Механизм реакции
- •8.2.3. Присоединение бромистого водорода в присутствии
- •1. Инициирование:
- •2. Рост цепи:
- •3. Обрыв цепи:
- •8.2.4. Присоединение серной кислоты
- •8.2.5. Гидратация алкенов. Присоединение спиртов
- •8.2.6. Гидроборирование алкенов
- •8.2.7. Алкилирование алкенов
- •8.2.8. Гидрирование. Теплота гидрирования
- •8.2.9. Теплота гидрирования и устойчивость алкенов
- •8.2.10. Окисление
- •8.2.11. Полимеризация алкенов
- •8.2.12. Реакция аллильного замещения. Галогенирование
- •8.3. Способы получения алкенов
- •9.1. Устойчивость сопряженных диенов
- •9.2. Химические свойства
- •9.2.1. Электрофильное присоединение
- •9.2.2. 1,2- И 1,4-Присоединение. Кинетический контроль, термодинамический контроль
- •9.2.3. Диеновый синтез. Реакция Дильса-Альдера
- •9.2.4. Полимеризация
- •9.3. Способы получения
- •10. Алкины
- •Характеристики химических связей в молекуле алкинов
- •10.1. Физические свойства
- •10.2. Химические свойства
- •10.2.1. Реакции присоединеня
- •10.2.1.1. Каталитическое гидрирование и восстановление
- •10.2.1.2. Реакции электрофильного присоединения Галогенирование
- •Гидрогалогенирование
- •Гидратация
- •10.2.1.3. Нуклеофильное присоединение
- •10.2.2. Кислотность алкинов
- •Константы кислотности некоторых соединений
- •10.2.3. Взаимодействие алкинов с карбонильными соединениями
- •10.2.4. Окисление алкинов
- •10.2.5. Радикальное присоединение бромоводорода
- •10.3. Способы получения
- •11. Арены
- •11.1. Сравнение свойств бензола со свойствами алкенов
- •11.2. Теплота гидрирования. Энергия резонанса
- •11.3. Строение бензола
- •11.4. Ароматичность
- •11.5. Физические свойства
- •Физические свойства аренов
- •11.6. Химические свойства
- •11.6.1. Электрофильное замещение
- •11.6.2. Свободнорадикальное замещение в боковой цепи аренов
- •11.6.3. Реакции окисления
- •11.7. Методы синтеза аренов
- •12.1. Влияние заместителей на реакционную способность бензольного кольца
- •12.2. Влияние заместителя на выбор места электрофильной атаки
- •13. Многоядерные ароматические соединения
- •13.1. Нафталин
- •13.2. Антрацен и фенантрен
- •14. Гетероциклические соединения
- •14.1. Пятичленные гетероциклы
- •14.1.1. Строение
- •14.1.2. Химические свойства
- •14.1.3. Способы получения
- •14.2. Пиридин
- •14.2.1. Строение пиридина
- •14.2.2. Химические свойства
- •14.3. Хинолин
- •15. Галогеналканы
- •15.1. Нуклеофильное замещение
- •15.1.1. Бимолекулярное нуклеофильное замещение
- •15.1.2. Мономолекулярное нуклеофильное замещение
- •15.1.3. Сравнение реакций sn 1 и sn 2
- •15.2. Реакции отщепления (элиминирование)
- •15.2.1. Бимолекулярное отщепление е2
- •15.2.2. Мономолекулярное отщепление е1
- •15.2.3. Сравнение реакций нуклеофильного замещения и элиминирования
- •15.3. Методы синтеза галогеналканов
- •16.2. Нуклеофильное замещение, протекающее через стадию образования дегидробензола, - отщепление - присоединение
- •16.3. Бимолекулярное нуклеофильное замещение sn2Ar
- •16.4. Ориентация при нуклеофильном замещении в ароматическом кольце
- •17. Магнийорганические соединения
- •17.1. Получение и строение магнийорганических соединений
- •17.2. Синтез спиртов и кислот
- •Библиографический список
- •Оглавление
- •Часть 1
8.2.7. Алкилирование алкенов
Присоединение насыщенного углеводорода к алкену называется алкилированием и используется в нефтехимической промышленности. Наибольшее значение имеет присоединение изобутана к изобутену в присутствии минеральных кислот, приводящее к 2,2,4-триметилпентану – изооктану.

Первая стадия - такая же, как и во всех реакциях электрофильного присоединения. Электрофил (протон) присоединяется в соответствии с правилом Марковникова с образованием трет-бутил-катиона (I).

Образующийся карбокатион (I) аналогичным образом атакует вторую молекулу алкена с образованием нового карбокатиона (II).

Карбокатион (II) может взаимодействовать с изобутаном, имеющим третичный атом водорода: карбокатион (II) вырывает третичный водород с его парой электронов - гидрид-ион, при этом образуется карбокатион (I) и изооктан.

Следовательно, механизм алкилирования изобутена изобутаном состоит в следующем: сначала происходит димеризаця изобутена под действием серной кислоты как катализатора, после чего карбокатион (II) вступает в реакцию переноса гидрид-иона с изобутаном.
8.2.8. Гидрирование. Теплота гидрирования
В процессе гидрирования алкена происходит разрыв -связи и связи Н–Н и образование двух связей С–Н:
![]()
Количество теплоты, выделяющейся при гидрировании одного моля ненасыщенного соединения, называется теплотой гидрирования. Этен и другие алкены в обычных условиях не реагируют с газообразным водородом вследствие высокой энергии активации Еакт..
В присутствии катализаторов алкены легко гидрируются в алканы. Теплота гидрирования в присутствии катализатора остаётся такой же, как и без катализатора. Изменяется лишь Еа, катализатор понижает энергетический барьер между исходными веществами и переходным состоянием. Катализатор, понижая энергию активации, направляет реакцию по особому механизму.
Обычно в качестве катализатора гидрирования используют тонко измельчённые металлы VIII группы: платину, палладий, рутений, родий, никель.
Уменьшение энергетического барьера прямой реакции также понижает энергию активации и обратной реакции и таким образом увеличивает скорость обратной реакции - дегидрирования. Катализатор в одинаковой степени ускоряет и прямую и обратную реакции, т.е. способствует более быстрому наступлению равновесия между исходными и конечными продуктами, но не сдвигает равновесия.
Платина, палладий, никель в соответствующих условиях служат и катализаторами дегидрирования. Каталитическое гидрирование ведется обычно в избытке водорода, что замедляет обратный процесс дегидрирования.
8.2.9. Теплота гидрирования и устойчивость алкенов
Теплоты гидрирования дают информацию об относительной устойчивости алкенов. Для сравнения устойчивости алкенов нужно сопоставить теплоты гидрирования различных алкенов для одного и того же алкана в равных условиях.
Например, сравним теплоты гидрирования 1-бутена, цис-2-бутена и транс-2-бутена. В реакциях поглощается 1 моль водорода и образуется один и тот же продукт – н-бутан.
При гидрировании транс-изомера выделяется на 4 кДж/моль энергии меньше, чем при гидрировании цис-изомера. Это означает, что содержание энергии в нем на 4 кДж/моль меньше, т.е. другими словами, транс-изомер на 4 кДж/моль устойчивее цис-изомера. В транс-изомере два объёмистых заместителя расположены по разные стороны от двойной связи, пространственные препятствия меньше, чем в случае цис-изомера. В свою очередь, оба геометрических изомера 2-бутена более устойчивы, чем 1-бутен.
Сравним теплоты гидрирования (кДж/моль) алкенов, которые при взаимодействии с водородом дают 2-метилбутан.
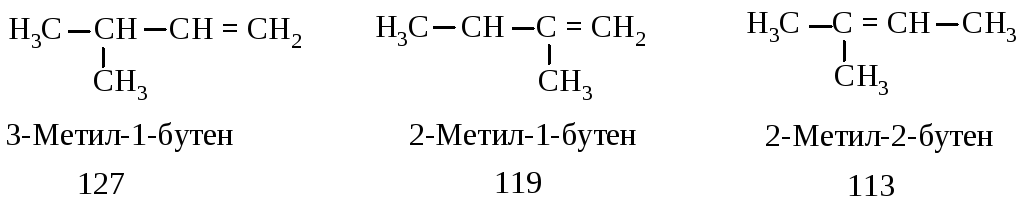
Различие в теплотах гидрирования обусловлено их различной устойчивостью.
Чем больше степень алкилирования атомов углерода при двойной связи, тем более устойчив алкен:
![]()
Различная устойчивость алкенов может быть объяснена неодинаковой возможностью распределения электронной плотности в молекулах с различным числом метильных групп при углеродах у двойной связи. Электроны -связи углерод – водород метильной группы частично перекрываются с электронами -связи (гиперконъюгация). Такое электронное взаимодействие ведет к уменьшению энергии молекулы.

К объяснению изменения устойчивости алкенов в приведенном ряду также может быть привлечено представление о различии энергий и длин связей, образованных sp3- и sp2-гибридизованными атомами углерода.

В 2-бутене имеются две более короткие и более прочные -связи Сsp3–Сsp2 , а в 1-бутене – только одна такая связь.
