
- •1. Алканы
- •Введение
- •1. Классификация органических соединений
- •2. Классификация органических реакций
- •3. Способы образования ковалентной связи
- •4. Гибридизация атомных орбиталей и форма органических молекул
- •4.1. Sp3-Гибридизация
- •4.2. Sр2-Гибридизация
- •4.3. Sp-Гибридизация
- •5. Алканы
- •Гомологический ряд алканов. Число структурных изомеров
- •5.1. Физические свойства
- •5.2. Химические свойства
- •5.2.1. Галогенирование
- •Зависимость реакционной способности галогенов от энергии связи h–Hal
- •5.2.2. Нитрование
- •5.3.4. Декарбоксилирование карбоновых кислот
- •6.2. Плоскополяризованный свет. Оптическая активность
- •6.3. Строение молекул и оптическая активность
- •6.4. Обозначение конфигураций
- •7. Циклоалканы
- •7.1 Номенклатура. Изомерия
- •7.2. Физические свойства
- •7.3. Типы напряжения
- •7.4. Строение
- •Теплоты сгорания и энергии напряжения циклоалканов
- •7.4.1. Особенности пространственного строения некоторых циклоалканов
- •7.5. Химические свойства
- •7.6. Способы получения
- •8.1. Физические свойства
- •Физические свойства алкенов
- •8.2. Химические свойства
- •8.2.1. Присоединение галогенов
- •8.2.1.1. Механизм реакции
- •8.2.1.2. Реакционная способность галогенов в реакции АdЕ
- •8.2.2. Присоединение галогеноводородов
- •8.2.2.1. Механизм реакции
- •8.2.2.2. Направление электрофильного присоединения
- •8.2.2.3. Реакционная способность и селективность
- •8.2.2.4. Перегруппировка
- •Механизм реакции
- •8.2.3. Присоединение бромистого водорода в присутствии
- •1. Инициирование:
- •2. Рост цепи:
- •3. Обрыв цепи:
- •8.2.4. Присоединение серной кислоты
- •8.2.5. Гидратация алкенов. Присоединение спиртов
- •8.2.6. Гидроборирование алкенов
- •8.2.7. Алкилирование алкенов
- •8.2.8. Гидрирование. Теплота гидрирования
- •8.2.9. Теплота гидрирования и устойчивость алкенов
- •8.2.10. Окисление
- •8.2.11. Полимеризация алкенов
- •8.2.12. Реакция аллильного замещения. Галогенирование
- •8.3. Способы получения алкенов
- •9.1. Устойчивость сопряженных диенов
- •9.2. Химические свойства
- •9.2.1. Электрофильное присоединение
- •9.2.2. 1,2- И 1,4-Присоединение. Кинетический контроль, термодинамический контроль
- •9.2.3. Диеновый синтез. Реакция Дильса-Альдера
- •9.2.4. Полимеризация
- •9.3. Способы получения
- •10. Алкины
- •Характеристики химических связей в молекуле алкинов
- •10.1. Физические свойства
- •10.2. Химические свойства
- •10.2.1. Реакции присоединеня
- •10.2.1.1. Каталитическое гидрирование и восстановление
- •10.2.1.2. Реакции электрофильного присоединения Галогенирование
- •Гидрогалогенирование
- •Гидратация
- •10.2.1.3. Нуклеофильное присоединение
- •10.2.2. Кислотность алкинов
- •Константы кислотности некоторых соединений
- •10.2.3. Взаимодействие алкинов с карбонильными соединениями
- •10.2.4. Окисление алкинов
- •10.2.5. Радикальное присоединение бромоводорода
- •10.3. Способы получения
- •11. Арены
- •11.1. Сравнение свойств бензола со свойствами алкенов
- •11.2. Теплота гидрирования. Энергия резонанса
- •11.3. Строение бензола
- •11.4. Ароматичность
- •11.5. Физические свойства
- •Физические свойства аренов
- •11.6. Химические свойства
- •11.6.1. Электрофильное замещение
- •11.6.2. Свободнорадикальное замещение в боковой цепи аренов
- •11.6.3. Реакции окисления
- •11.7. Методы синтеза аренов
- •12.1. Влияние заместителей на реакционную способность бензольного кольца
- •12.2. Влияние заместителя на выбор места электрофильной атаки
- •13. Многоядерные ароматические соединения
- •13.1. Нафталин
- •13.2. Антрацен и фенантрен
- •14. Гетероциклические соединения
- •14.1. Пятичленные гетероциклы
- •14.1.1. Строение
- •14.1.2. Химические свойства
- •14.1.3. Способы получения
- •14.2. Пиридин
- •14.2.1. Строение пиридина
- •14.2.2. Химические свойства
- •14.3. Хинолин
- •15. Галогеналканы
- •15.1. Нуклеофильное замещение
- •15.1.1. Бимолекулярное нуклеофильное замещение
- •15.1.2. Мономолекулярное нуклеофильное замещение
- •15.1.3. Сравнение реакций sn 1 и sn 2
- •15.2. Реакции отщепления (элиминирование)
- •15.2.1. Бимолекулярное отщепление е2
- •15.2.2. Мономолекулярное отщепление е1
- •15.2.3. Сравнение реакций нуклеофильного замещения и элиминирования
- •15.3. Методы синтеза галогеналканов
- •16.2. Нуклеофильное замещение, протекающее через стадию образования дегидробензола, - отщепление - присоединение
- •16.3. Бимолекулярное нуклеофильное замещение sn2Ar
- •16.4. Ориентация при нуклеофильном замещении в ароматическом кольце
- •17. Магнийорганические соединения
- •17.1. Получение и строение магнийорганических соединений
- •17.2. Синтез спиртов и кислот
- •Библиографический список
- •Оглавление
- •Часть 1
8.2.2.2. Направление электрофильного присоединения
Электрофильное присоединение к алкенам происходит через стадию образования более устойчивого карбокатиона (правило Марковникова).
Рассмотрим двухстадийный механизм присоединения бромоводорода к алкенам: медленная стадия - образование карбокатиона, быстрая стадия - присоединение нуклеофила (BrΘ).
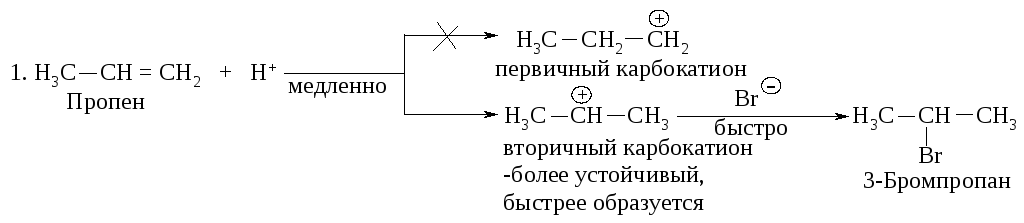
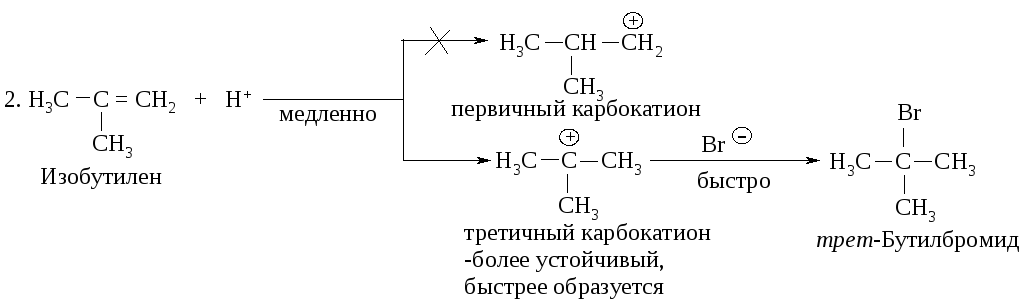
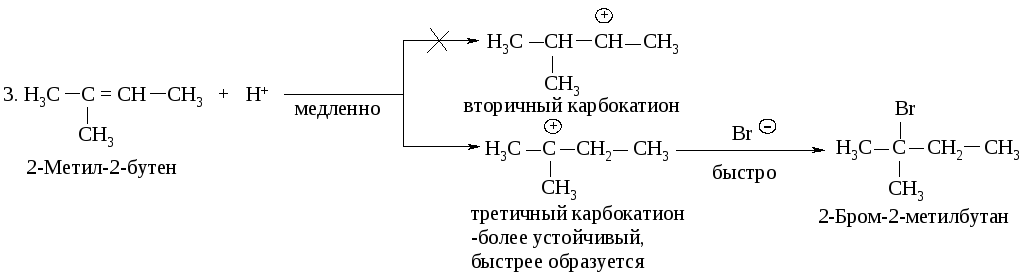
Рассмотрение механизма реакций показывает, что в первой стадии вторичный карбокатион образуется быстрее, чем первичный по реакции 1, а третичный - быстрее, чем первичный и вторичный, как следует из реакций 2 и 3.
Легкость образования карбокатионов увеличивается в следующей последовательности: метильный < первичный < вторичный < третичный.
С другой стороны, устойчивость карбокатионов возрастает в таком же порядке: метильный < первичный < вторичный < третичный.

Такой порядок изменения устойчивости можно объяснить следующим образом. Согласно законам физики, устойчивость заряженной системы повышается при распределении заряда. Связь sp3-гибридизованного атома углерода с различными группами (X, Y) в той или иной степени поляризована из-за различной электроотрицательности элементов. Полярность этих связей сравнивается с полярностью связи C–H, выбранной в качестве стандарта. Перераспределение электронной плотности σ-связи под влиянием какой-либо группы по сравнению с распределением электронной плотности связи С–Н называется индукционным (индуктивным) эффектом (I).

Группа X, которая притягивает пару электронов -связи сильнее, чем атом водорода, проявляет электроноакцепторный эффект (минус I). Группа Y, которая отталкивает пару электронов -связи, проявляет электронодонорный эффект (+I). Под влиянием заряда, образующегося на атоме углерода, поляризуются соседние связи, но этот эффект быстро затухает по цепи связей C–C.

Алкильные группы имеют тенденцию подавать электроны по сравнению с атомом водорода, следовательно, алкильная группа проявляет электронодонорный индукционный эффект (+I). Подавая электроны -связи на положительно заряженный атом углерода, она приобретает некоторый положительный заряд, а заряд на центральном атоме в некоторой степени уменьшается. В третичном карбокатионе положительный заряд распределен между третичным углеродом и тремя алкильными группами, поэтому третичный карбокатион наиболее устойчив. Наоборот, метильный - наименее устойчив, т.к. в нем заряд локализован на одном атоме углерода. Чем больше распределен заряд в карбокатионе, тем он устойчивее.

Устойчивость карбокатионов изменяется в таком же порядке, как и легкость, их образования.
Чем устойчивее карбокатион, тем легче он образуется.
8.2.2.3. Реакционная способность и селективность
Скорость присоединения протона зависит от устойчивости карбокатиона. Этот фактор определяет относительную реакционную способность различных алкенов: наиболее реакционноспособным должен быть алкен, дающий наиболее устойчивый карбокатион:
![]()
Устойчивость трет-бутилкатиона настолько превосходит устойчивость другого возможного карбокатиона - первичного изобутилкатиона СН2-СН(СН3)2, что в продуктах реакции изобутилена с галогеноводородами обнаруживается только трет-бутилгалогенид. При образовании первичных и вторичных карбокатионов, например, из пропилена или 1-бутена, преобладание вторичных карбокатионов достаточно велико: 85 % вторичного и 15 % первичного.
