
- •1.Переваривание углеводов
- •Инактивация биогенных аминов происходит двумя путями:
- •Биологическое значение реакций трансаминирования заключается:
- •2. Образование аммонийных солей.
- •18. Нарушение обмена белка может развиваться при несоответствии поступления белка потребностям организма.
- •20. Липогенез
- •22. Глицерин – трехатомный спирт, водорастворим и легко всасывается из кишечника и по воротной вене поступает в печень.Окисление глицерина
- •24. Синтез кетоновых тел:
- •25. АцетилКоА- это центральный метаболит липидного обмена.
Инактивация биогенных аминов происходит двумя путями:
-
метилирование с участием SAM (S-аденозилметионин) под действием метилтрансфераз. Характерно для гистамина, адреналина, норадреналина. SAГ
-
окисление ферментами МАО (моноаминооксидазами) с коферментом ФАД . При окислении биогенных аминов происходит дезаминирование с образованием альдегида, а затем кислоты, которые выводятся почками.
13. Дезаминирование аминокислот.
Деаминирование – это удаление альфа-аминогруппы, которая выделяется в виде аммиака, и образование альфа-кетокислоты. При дезаминировании в отличие от трансаминирования общее количество аминокислот уменьшается.
Аммиак – токсичное соединение и в клетках подвергается обезвреживанию.
Альфа-кетокислота включается:
-
в реакции окисления в цикле Кребса
-
в реакции трансаминирования для синтеза заменимых аминокислот
-
в глюконеогенез
-
в кетогенез
Записываем. Дезаминированию подвергаются все аминокислоты кроме лизина и пролина.
Существует 3 типа реакций дезаминирования:
-
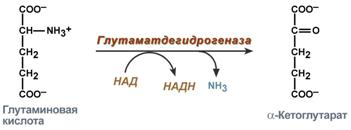
Окислительное – характерно только для глутамата.
-
Неокислительное – характерно для серина, треонина, гистидина, цистеина
Серин, треонин теряют воду.
гистидин – внутримолекулрные перестройки
цистеин – с отщеплением сероводорода и присоединением воды.
-
Непрямое – характерно для остальных аминокислот. Включает 2 стадии:
А. Трансаминирование с альфа-кетоглутаратом и образование глутамата в цитозоле клетки. Валин + α-кетоглутарат → глутамат + α-кетокислота
Б. Окислительное дезаминирование глутамата в митохондриях.
глутамат → α-кетоглутарат +NH3
14. Трансаминирование – реакция переноса аминогруппы с аминокислоты (донора) на альфа-кетокислоту (акцептор), в результате чего образуется новая кетокислота и новая аминокислота. Реакция обратима.
Реакция трансаминирования происходит с участием ферментов аминотрансфераз (трансаминаз), которые локализованы в цитозоле и митохондриях клеток практически всех органов. Наиболее активно реакция протекает в печени. Название каждой аминотрансферазы включает название субстратов: донора аминогруппы (аминокислоты) и акцептора аминогруппы (альфа-кетокислоты).
Коферментом этих ферментов является производное витамина В6 – пиридоксальфосфат. Трансаминазы являются субстрат специфичными ферментами. Известно более 10 ферментов.
Основными донорами аминогрупп являются Глутамат, Аспартат, Аланин.
Не могут быть трансаминированы Лизин, Треонин.
Аспартатаминотрансфераза (АСТ) и аланинаминотрансфераза (АЛТ) наиболее распространенные аминотрансферазы в организме. В клинике определение их активности широко используется для диагностики заболеваний миокарда и печени. В норме их активность в крови мала и составляет 5-40 ЕД/л. При поражениях печени (гепатите, циррозе), инфаркте миокарда активность АСТ и АЛТ резко возрастает.
Биологическое значение реакций трансаминирования заключается:
- в синтезе заменимых аминокислот, если их в данный момент недостаточно в ткани.
- это начальный этап катаболизма аминокислот. Образующиеся альфа-кетокислоты могут затем окисляться в цикле Кребса или использоваться для синтеза глюкозы или кетоновых тел.
15. Основным механизмом обезвреживания аммиака в организме является биосинтез мочевины (в основном, в печени).Она выводится с мочой в качестве главного конечного продукта белкового, соответственно аминокислотного, обмена. На долю мочевины приходится до 80-85% всего азота мочи. Реакции синтеза мочевины, представлены в виде цикла, получившего название орнитинового цикла мочевинообразования Кребса.
· На первом этапе синтезируется макроэргическое соединение карбамоилфосфат– это метаболически активная форма аммиака, используемая в качестве исходного продукта для синтеза ряда других азотистых соединений.
· На втором этапе цикла мочевинообразования происходит конденсация карбамоилфосфата и орнитина с образованием
цитруллина; реакцию катализирует орнитинкарбамоилтрансфераза:
На следующей стадии цитруллин превращается в аргинин в результате двух последовательно протекающих реакций. Первая
из них, энергозависимая, сводится к конденсации цитруллина и аспаргиновой кислоты с образованием аргининосукцината (эту реакцию катализирует аргининосукцинат-синтетаза). Аргининсукцинат распадается во второй
реакции на аргинин и фумарат поддействием аргининосукцинат-лиазы.
На последнем этапе аргинин расщепляется на мочевину и орнитин под действием аргиназы. Суммарная реакция синтеза мочевины без учёта промежуточных продуктов:
Это энергетически выгодная реакция, поэтому процесс всегда протекает в направлении синтеза мочевины.
В состоянии азотистого равновесия организм человека потребляет и соответственно выделяет примерно 15 г азота в сутки; из экскретируемого с мочой количества азота на долю мочевины приходится около 85% , креатинина-около 5%, аммонийных солей – 3%, мочевой кислоты-1% и на другие формы-около 6%.
16. Пути образования и утилизации аммиака в организме
1. Восстановительное аминирование.
Одним из путей связывания и обезвреживания аммиака в организме, в частности в мозге, сетчатке, почках, печени и мышцах - это биосинтез амидов глутаминовой и аспарагиновой кислот (глутамина или аспарагина):
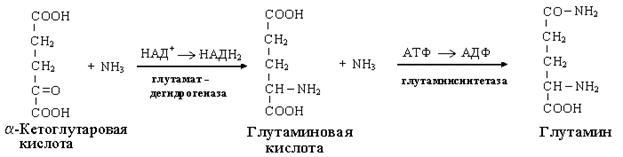
Эта реакция протекает во многих тканях, но наиболее важна для нервной, особенно чувствительной к токсическому действию аммиака. Первая реакция представляет собой обращение глутаматдегидрогеназной реакции (обратная окислительному дезаминированию ГЛУ).
Обезвреживание аммиака путем синтеза глутамина имеет и анаболическое значение, поскольку глутамин используется для синтеза ряда соединений. Прежде всего нужно отметить, что глутамин — одна из 20 аминокислот, входящих в белки. Кроме того, амидная группа глутамина используется для синтеза аспарагина, глюкозамина и других аминосахаров, пуриновых и пиримидиновых нуклеотидов. Таким образом, в этих реакциях азот аммиака включается в разнообразные структурно-функциональные компоненты клетки.
Глутамин затем может поступать во все ткани, где осуществляется его гидролиз при участии глутаминазы:
![]()
Подобным образом происходит образование аспарагина (через ЩУК).
