
Работа газа при изменении его объёма
Р dl P









![]()

![]() приложенная к поршню, также изменяется.
Тогда механическая работаAнаходится
по формуле:
приложенная к поршню, также изменяется.
Тогда механическая работаAнаходится
по формуле:
![]() (5)
(5)
В
данном случае
= 0 (
—
угол между силой
![]() и элементарным перемещением
и элементарным перемещением![]() )
и cos
= 1. Модуль силы F
находим через давление P,
которое оказывает газ на поршень: F
= PS. С учётом
этого, для элементарной работы dA
получаем, что d
)
и cos
= 1. Модуль силы F
находим через давление P,
которое оказывает газ на поршень: F
= PS. С учётом
этого, для элементарной работы dA
получаем, что d A
= F·dl·cos
= PS·dl
= P·dV,
где dV = S·dl
—
элементарное приращение объёма.
Подставляя это выражение в (5), имеем:
A
= F·dl·cos
= PS·dl
= P·dV,
где dV = S·dl
—
элементарное приращение объёма.
Подставляя это выражение в (5), имеем:
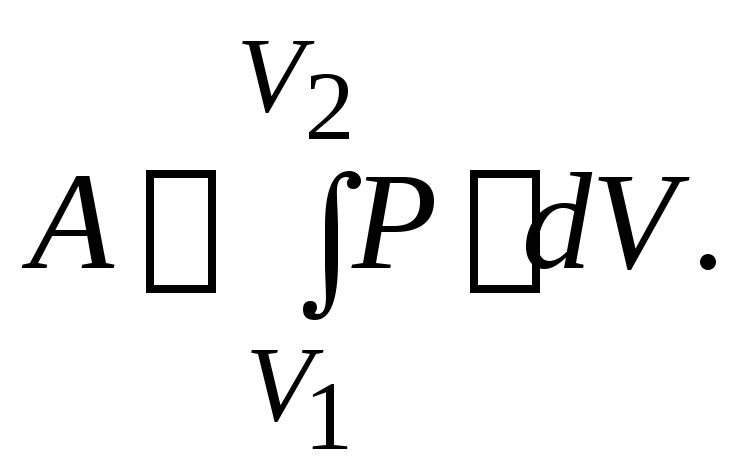 (6)
(6)
Применение первого закона термодинамики к различным процессам
1. Изохорический процесс.Процесс, протекающий при постоянном объёме (V = const), называютизохорическим (изохорным). ПосколькуV = const, тоэлементарное изменение объёма dV = 0, и элементарная работа газа dA = P·dV = 0,т.е. при этом процессе газ не совершает механической работы. Тогда первый закон термодинамики запишется:
dQV = dU. (7)
Следовательно, при изохорическом процессе количество теплоты, сообщённое газу, полностью расходуется на изменение его внутренней энергии. Отметим, что в (7) использовано принятое в термодинамике обозначение. Если какой-либо параметр при данном процессе не изменяется, то он служит индексом при интересующей нас величине.
Количество теплоты, переданное или отданное термодинамической системе, определяется через её теплоёмкость. Теплоёмкость — это физическая величина, измеряемая количеством теплоты, которую необходимо сообщить для нагревания системы на один градус. Очевидно, что количество теплоты, необходимое для нагревания системы на один градус, зависит от массы вещества. Поэтому вводят понятие удельной и молярной теплоёмкости. Удельная теплоёмкость c характеризуется количеством теплоты, необходимым для повышения температуры единицы массы вещества на один градус. Молярная теплоёмкость C — это количество теплоты, требуемое для повышения температуры одного моля вещества на один градус. Эти теплоёмкости связаны между собой соотношением
C = c, (8)
где — молярная масса.
Если одному молю вещества сообщить количество теплоты dQи при этом его температура изменится наdTградусов, то по определению
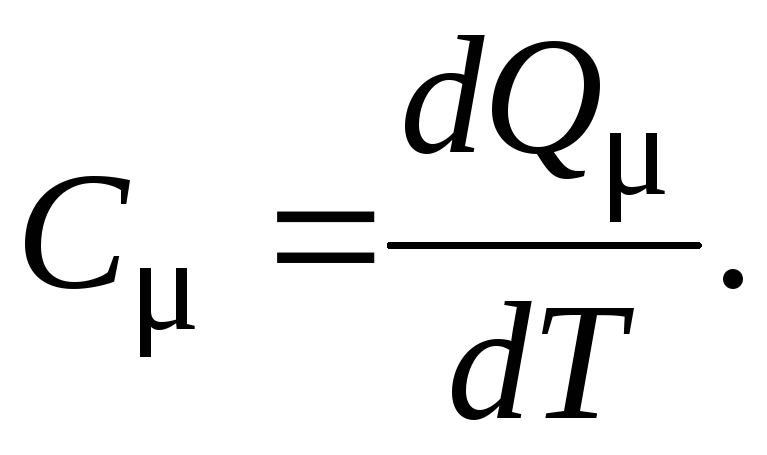 (9)
(9)
Теплоёмкость зависит от внешних условий, при которых происходит нагревание термодинамической системы. Различают теплоёмкости при постоянном давлении (изобарная теплоёмкость) и при постоянном объёме (изохорная теплоёмкость). Обозначим молярную изохорную теплоёмкость через CV. Согласно выражению (9), она равна:
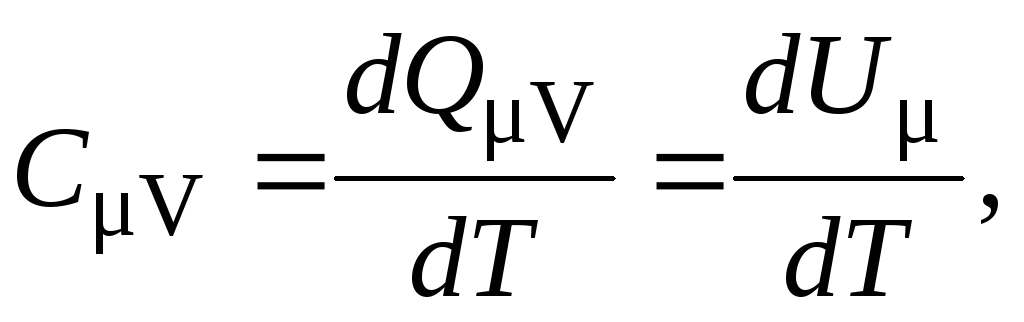 (10)
(10)
так как из (7) следует, что dQV = dU . Из формулы (10) получаем, что
dU = CV dT. (11)
Для нахождения внутренней энергии одного моля вещества надо проинтегрировать выражение (11), т.е.
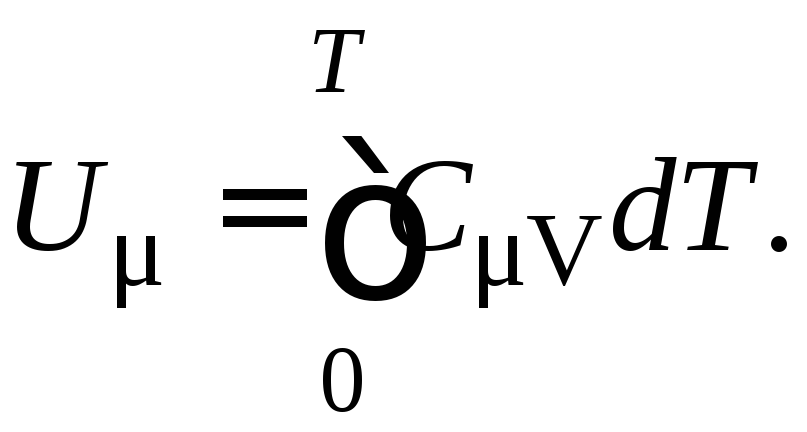 (12)
(12)
В не слишком широких интервалах температур CV остаётся постоянной. Тогда её можно вынести за знак интеграла и (12) запишется
U = CV T. (13)
Для произвольной массы вещества M внутренняя энергия U равна внутренней энергии U одного моля, умноженной на число молей = M / , т.е.
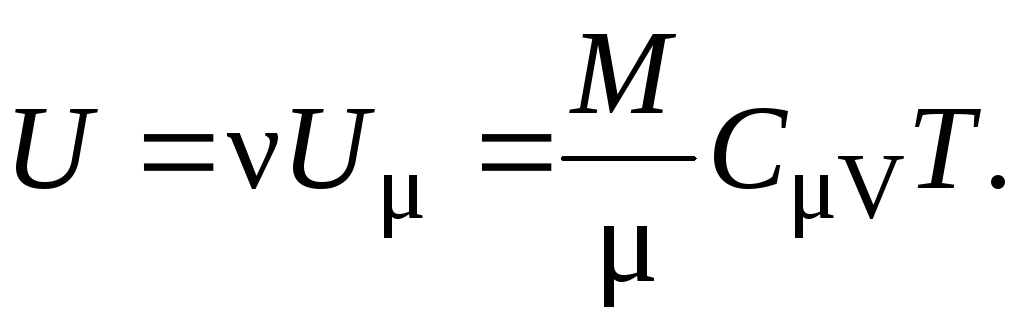 (14)
(14)
2. Изобарический процесс.Процесс, происходящий при неизменном давлении (P = const), называется изобарическим(изобарным). Работу газа при увеличении объёма отV1доV2находим, используя формулу (6):
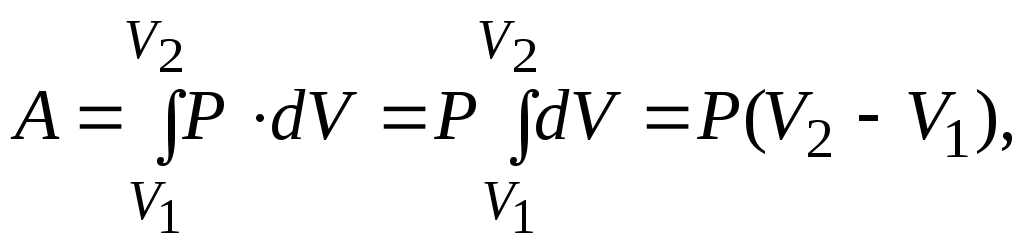 (15)
(15)
так как P = const, то её вынесли за знак интеграла. Первый закон термодинамики в дифференциальной форме, учитывая, что dA = PdV, запишется в виде
dQ = dU + P·dV. (16)
Молярная изобарная теплоёмкость CP равна
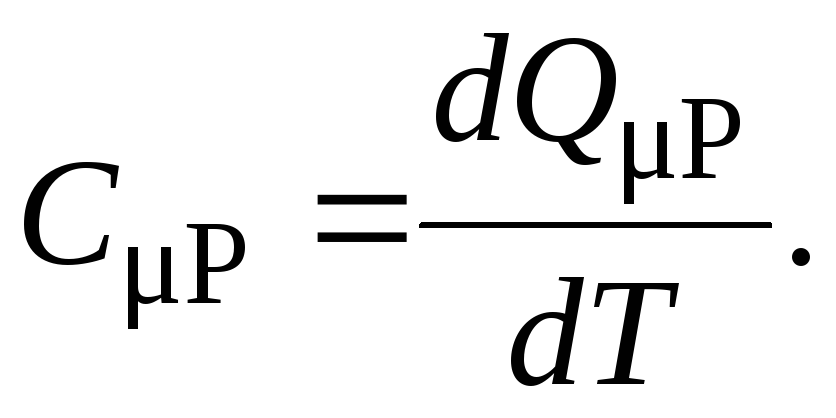 (17)
(17)
Теплоёмкости газа при постоянном давлении и объёме связны соотношением:
CP = CV + R. (18)
Соотношение (18) носит название уравнения Майера. Из него следует, что теплоёмкость при изобарическом процессе больше, чем при изохорическом.
3. Связь теплоёмкости идеального газа
со степенями свободы молекул.Сравнивая
выражения![]() иU=CV
T, находим, что молярная изохорная
теплоёмкость равна:
иU=CV
T, находим, что молярная изохорная
теплоёмкость равна:
![]() (19)
(19)
где i — число степеней свободы молекулы. Молярную изобарную теплоёмкость находим, воспользовавшись уравнением Майера и формулой (19):
![]() (20)
(20)
Если молекулу считать жёсткой, то для одноатомных газов i = 3, для двухатомных — i = 5 и для многоатомных — i = 6. Подставляя эти значения в (19) и (20), можно вычислить молярные теплоёмкости газов. Из опытных данных следует, что теплоёмкость реальных одноатомных газов (гелий, аргон, неон и др.) близка к расчётным значениям в довольно широком температурном интервале. Теплоёмкость же двухатомных и многоатомных газов близка к расчётным величинам лишь при температурах, мало отличающихся от комнатной температуры. В широком же температурном интервале наблюдается зависимость теплоёмкости от температуры, в то время как, с точки зрения классической теории, она должна быть постоянной. Объяснение такого поведения теплоёмкости даётся квантовой механикой.
4. Изотермический процесс.Процесс, происходящий при постоянной температуре (T = const), называютизотермическим.
а) Рассмотрим первый закон термодинамики для данного процесса. Внутренняя энергия идеального газа зависит только от температуры. Поэтому при постоянной температуре внутренняя энергия постоянна (U = const), и следовательно,U = 0.Тогда первый закон термодинамики принимает вид:
QT = AT, (21)
т.е. количество теплоты, сообщённое газу при изотермическом процессе, полностью превращается в работу, совершаемую газом.
б) Вычислим работу, совершаемую идеальным
газом, при данном процессе при изменении
объёма от V1доV2.
Зависимость давления газа от объёма и
температуры находим из уравнения
Менделеева—Клапейрона: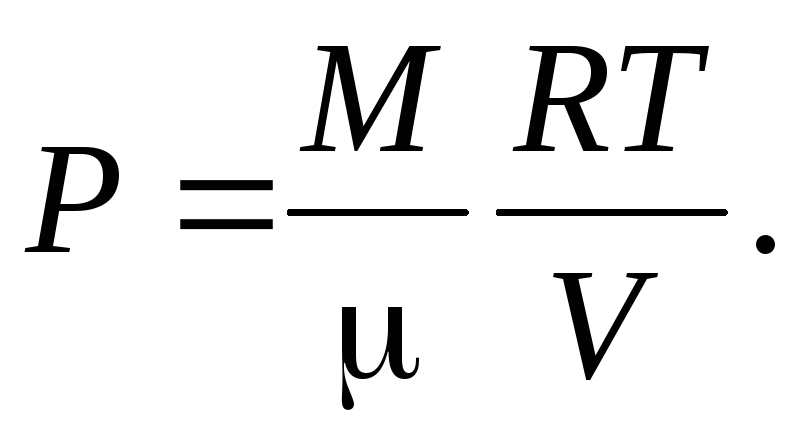 Тогда с учётом выражения (3) имеем, что
Тогда с учётом выражения (3) имеем, что
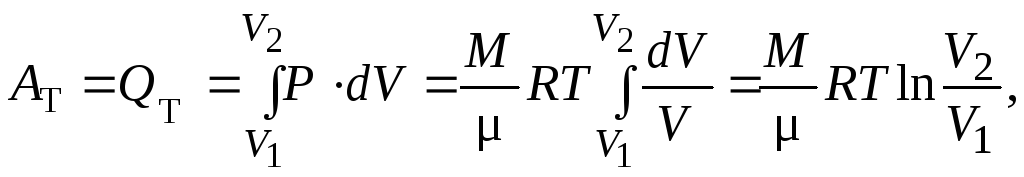 (22)
(22)
поскольку T = const, то её также вынесли за знак интеграла.
