
Вопрос 35Окислительно-восстан системы. Потенциалы, механизм возникновения, био. Значение.
Ок-восст. Реакциями наз реакции , протекающие с изменением степени окисления атомов элементов, входящих в состав реагирующих веществ. Окисление это процесс потери электронов, восстановление- это процесс присоединения электронов. Отличительным признаком окислительно-восстановительных реакций является перенос электронов между реагирующими частицами - ионами, атомами, молекулами и комплексами, в результате чего изменяется степень окисления этих частиц.Окислительно-восстановительный потенциал (редокс-потенциал) — мера способности химического вещества присоединять электроны (восстанавливаться). Окислительно-восстановительный потенциал выражают в милливольтах (мВ). Примером окислительно-восстановительного электрода:Pt/Fe3+,Fe2+ Окислительно-восстановительный потенциал определяют как электрический потенциал, устанавливающийся при погружении платины или золота(инертный электрод) в окислительно-восстановительную среду, то есть в раствор, содержащий как восстановленное соединение(Ared), так и окисленное соединение (Aox). Если полуреакцию восстановления представить уравнением:Aox + n·e− → Ared,
Окислительно-восстановительный потенциал. Основными процессами, обеспечивающими жизнедеятельность любого организма, являются окислительно-восстановительные реакции, т.е. реакции, связанные с передачей или присоединением электронов. Энергия, выделяемая в ходе этих реакций, расходуется на поддержание гомеостаза
(жизнедеятельности организма) и регенерацию клеток организма, т.е. на обеспечение процессов жизнедеятельности организма соответственно в настоящем и будущем.
Потенциалометрией называют совокупность физико-химических методов иссделования, в основе которых лежит измерение электродвижущей силы цепей, составленных из индикаторного электрода и электрода сравнения. Различают прямые и косвенные потенцианометрические методы. В прямых источником информации для определения активности или концентрации ионов является числовое значение потенциала индикаторного электрода. Косвенные.- Чаще всего потенциометрические измерения используют для определения точки эквивалентности в титриметрическом анализе(потенциометрическое титрование) В ациди- и алкалиметрии в качестве индикаторного электрода применяют стеклянный электрод, т.к его потенциал зависит от рН среды. В оксидометрическом титровании применяют редокс-электрод, в осадительном и комплексиметрическом- ионоселективные электроды.Биологическое значение.Важными процессами в животных организмах являются реакции ферментативного окисления веществ-субстратов: углеводов, жиров, аминокислот. В результате этих процессов организмы получают большое количество энергии. Приблизительно 90% всей потребности взрослого мужчины в энергии покрывается за счет энергии, вырабатываемой в тканях при окисленими углеводов и жиров. Остальную часть энергии , примерно 10% дает окислительное расщепление аминокислот Окислительно-восстановительные реакции лежат в основе методов оксидометрии, которые применяют в клиническом анализе для определения в крови ионов Са, мочевой кислоты, ферментов каталазы и пероксидазы, сахара, а в санитарно-гигиеническом – для определения окисляемости воды , содержания «активного» хлора в хлорной извести, остаточного хлора в хозяйственно-питьевой воде.
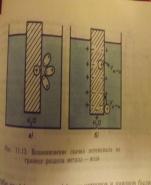


36)Ткани организмачеловека относятся к проводникам второго рода, поэтому прохождение через них электрического тока связано с перемещением положительно заряженных частиц (катионов) к отрицательному полюсу - катоду, а отрицательно заряженных частиц (анионов) - к положительному полюсу - аноду. В биологических тканях возникает ток проводимости. Подойдя к тому или иному полюсу, ионы восстанавливают свою наружную электронную оболочку и превращаются в атомы, обладающие высокой химической активностью. Этот процесс носит название терапевтического электролиза.Электропроводность растворов электролитов обусловленаперемещением ионов в электрическом поле (в отличие от электронной проводимости проводников первого рода). Электропроводность - математическая оценка способности раствора проводить электрический ток, зависит в основном от степени минерализации исследуемого раствора и его температуры.В качестве количественной меры способности раствора электролита проводить электрический токиспользуют обычно удельную электропроводность κ (каппа) - величину, обратную удельному сопротивлению (т.е. величину, обратную сопротивлению столба раствора между электродами площадью 1 см2, находящимися на расстоянии 1 см): χ=1/ρ, Ом-1см-1Удельная электропроводимость- численно равна проводимости вещ-ва заключенного в объеме между двумя электродами, стоящими друг от друга на расстоянииl=1, и сS=1 м2 χ=1/R*l/S Зависит от концентрации вещ-ва в растворе.Закон Кольрауша (или закон аддитивности электропроводности при бесконечном разбавлении электролитов) гласит, что в бесконечно разбавленном растворе перенос электричества осуществляется всеми ионами независимо друг от друга; при этом общая молярная электропроводность раствора равна сумме молярных электропроводностей отдельных ионов. Гидратация(от греч. hydro — вода) — присоединение молекул воды к молекулам или ионам. Гидратация является частным случаем сольватации — присоединения к молекулам или ионам веществ молекул органического растворителя. В отличие от гидролиза гидратация не сопровождается образованием водородных или гидроксильных ионов. Гидратация в водных растворах приводит к образованию стойких и нестойких соединений воды с растворенным веществом (гидратов); в органических растворителях образуются аналогичные гидратам сольваты. Гидратация обусловливает устойчивость ионов в растворах и затрудняет их ассоциацию. Гидратация является движущей силой электролитической диссоциации — источником энергии, необходимой для разделения противоположно заряженных ионов.Абсолютная скорость движения иона – это скорость передвижения иона к электроду, отнесенная к единице напряженности электрического поля. Скорость движения ионов в растворе зависит от их природы, температуры и природы растворителя, а именно:1. Природа иона определяется его радиусом r и зарядом Z. Эти два фактора характеризуют поляризующую способность ионов по отношению к растворителю. В растворах скорость движения ионов определяется размерами сольватированных (гидратированных) ионов. Чем меньше радиус иона и больше заряд, тем большим поляризующим действием ион обладает.2. Природа растворителя характеризуется диэлектрической постоянной D Е. С уменьшением величины D Е падает способность растворителя сольватировать ионы в растворе; электропроводимость раствора уменьшается, поскольку происходит уменьшение степени диссоциации веществ в малополярных растворителях.3. С ростом температуры электропроводимость увеличивается на каждый градус на 2 % (вследствие уменьшения сольватной оболочки).
