
Самостоятельная работа студентов.
Задание №1. Провести качественные реакции:
0,9% раствор натрия хлорида, 20% раствор калия бромида, 10% раствор кальция хлорида, 25% раствор магния сульфата, 25% раствор цинка сульфата, 3% раствор перекиси водорода, 30% раствор сульфацил-натрия, 10% раствор натрия салицилата, 2% раствор кислоты борной.
Раствор натрия хлорида 0,9%
На предметное стекло наносят по одной капле исследуемого раствора, раствора серебра нитрата и разведенной азотной кислоты. Образуется белый осадок хлорида серебра, растворимый в растворе аммиака и нерастворимый в разведенной азотной кислоте (хлорид-ион).
Часть раствора выпаривают в фарфоровой посуде, сухой остаток смачивают хлороводородной кислотой и вносят на отточенном грифеле в пламя спиртовки, пламя окрашивается в желтый цвет (ион натрия).
На предметное стекло наносят по одной капле исследуемого раствора и раствора пикриновой кислоты, под микроскопом наблюдают образующиеся желтые игольчатые кристаллы, выходящие из одной точки (ион натрия).
Раствор калия бромида 20%
В фарфоровую лодочку помещают по 1 капле исследуемого раствора, разведенной хлороводородной кислоты и раствора хлорамина, выделяющийся бром окрашивает раствор в желтый цвет. При добавлении к жидкости 3 капель хлороформа последний извлекает бром и окрашивается в желтый цвет (бромид-ион).
Часть раствора выпаривают, сухой остаток вносят в бесцветное пламя, пламя окрашивается в фиолетовый цвет (ион калия).
На предметное стекло наносят по одной капле исследуемого раствора, раствора виннокаменной кислоты, раствора натрия ацетата, перемешивают стеклянной палочкой; постепенно образуется белый кристаллический осадок, растворимый в минеральных кислотах и растворах едких щелочей (ион калия).
Раствор кальция хлорида 10%
На предметное стекло наносят по 1 капле исследуемого раствора и раствора аммония оксалата, образуется белый осадок кальция оксалата, растворимый в разведенных минеральных кислотах и нерастворимый в разведенной уксусной кислоте и растворе аммиака (ион кальция).
Реакции на хлорид-ион проводят как указано в методике для натрия хлорида.
Раствор магния сульфата 25%
2 капли раствора наносят на предметное стекло, прибавляют по 1 капле раствора аммиака, аммония хлорида и натрия гидрофосфата, образуется белый кристаллический осадок, растворимый в разведенных минеральных кислотах и уксусной кислоте (ион магния).
На том же предметном стекле к 1 капле раствора прибавляют 1 каплю раствора бария хлорида, образуется белый осадок, нерастворимый в разведенных минеральных кислотах и щелочах (сульфат-ион).
Раствор цинка сульфата 0,25%
На предметное стекло помещают по 1 капле растворов исследуемого вещества и гексациано-(П)-феррата калия. Образуется белый осадок, нерастворимый в разведенной хлороводородной кислоте (ион цинка).
Реакцию на сульфат-ион проводят как указано в методике для магния сульфата.
Раствор пероксида водорода 3%
2 капли раствора наносят на фарфоровую чашечку, прибавляют 1 каплю разведенной серной кислоты, 3-4 капли эфира, 1 каплю раствора калия дихромата; эфирный слой окрашивается в синий цвет.
Раствор натрия сульфацетамида (натрия сульфацила) 30%
На полоску фильтровальной бумаги наносят по 1 капле растворов: исследуемого, натрия нитрита, разведенной хлороводородной кислоты и 2-3 капли щелочного раствора β-нафтола, появляется красное окрашивание.
Ион натрия доказывают как указано выше (натрия хлорид).
Раствор натрия салицилата 10%
На полоску фильтровальной бумаги наносят по 1 капле растворов: исследуемого и железа (III) хлорида, появляется фиолетовое окрашивание (салицилат-ион).
На фарфоровую чашечку помещают одну каплю исследуемого раствора, 1-2 капли формальдегида и 2-3 капли концентрированной серной кислоты, появляется красное окрашивание.
Ион натрия доказывают по окраске пламени в желтый цвет.
Раствор кислоты борной 2%
Куркумовую бумажку смачивают исследуемым раствором, 1-2 каплями кислоты хлороводородной (1:2) и дают ей подсохнуть, при этом образуется буровато-красное окрашивание. При нанесении на окрашенную часть бумажки раствора аммиака последняя окрашивается в зелено-черный цвет.
Задание №2. Провести количественный анализ:
0,9% раствор натрия хлорида, 25% раствор цинка сульфата, 3% раствор перекиси водорода.
Раствор натрия хлорида 0,9% - 1000 мл
0,5 (1) мл раствора помещают в колбочку, прибавляют 3 мл воды, 1 каплю раствора калия хромата и титруют раствором серебра нитрата (0,05 моль/л) до появления оранжево-красного окрашивания. М.м. 58,44.
Раствор цинка сульфата 0,25% - 10 мл
1 мл раствора помещают в колбочку, прибавляют 5 мл аммиачного буферного раствора, 2-3 капли раствора хромогена черного и титруют раствором трилона Б (0.01 моль/л) до появления синего окрашивания. М.м. 287.54.
Раствор пероксида водорода 3% - 50 мл
1 мл раствора помещают в мерную колбу емкостью 50 мл и доводят водой до метки. 1 мл разведения помещают в колбочку, приливают 5 мл разведенной серной кислоты и титруют раствором калия перманганата (0,02 моль/л, УЧ 1/5 KMnO4) до слабо-розовой окраски. М.м. 30,01.
Отчет предоставляется в виде журнала В/А контроля (форма 1).
Задание №3. Провести качественный и количественный анализ лекарственной формы состава:
Дифенгидрамина гидрохлорида (димедрола) 0,5
Кислота аскорбиновая 5,0
Воды до 100 мл.
Описание. Бесцветная прозрачная жидкость.
Подлинность.
Выпаривают 2-3 капли раствора на водяной бане. После охлаждения к сухому остатку прибавляют 4-5 капель концентрированной серной кислоты, появляется желтое окрашивание, исчезающее при добавлении 2-3 капель воды (дифенгидрамина гидрохлорид).
К 1-2 каплям раствора прибавляют по 1-2 капли растворов гексациано-(III)феррата калия и железа (III) хлорида, появляется синее окрашивание (кислота аскорбиновая).
Количественное определение.
Дифенгидрамина гидрохлорид (димедрол).
К 2 мл раствора прибавляют 5-6 мл раствора железоаммониевых квасцов, 2 мл разведенной азотной кислоты, 3 мл раствора серебра нитрата (0,02 моль/л) и титруют раствором аммония тиоцианата (0,02 моль/л) до желто-розового окрашивания. М.м. 291,82.
Кислота аскорбиновая
К 1 мл раствора прибавляют 2 мл 95% спирта и титруют раствором йода (0,1 моль/л, УЧ ½ I2) до слабо-желтого окрашивания. М.м. 176,13.
Отчет предоставляется в виде журнала В/А контроля (форма 2).
Предварительные расчеты:
![]() ,
где Т – титр, Мr
– молекулярная масса исследуемого
вещества, С – концентрация титранта
(моль/л), f
– фактор эквивалентности.
,
где Т – титр, Мr
– молекулярная масса исследуемого
вещества, С – концентрация титранта
(моль/л), f
– фактор эквивалентности.
![]()
![]() ,
где V
– объем титранта, необходимый для
титрования, х – количество исследуемого
вещества в навеске.
,
где V
– объем титранта, необходимый для
титрования, х – количество исследуемого
вещества в навеске.
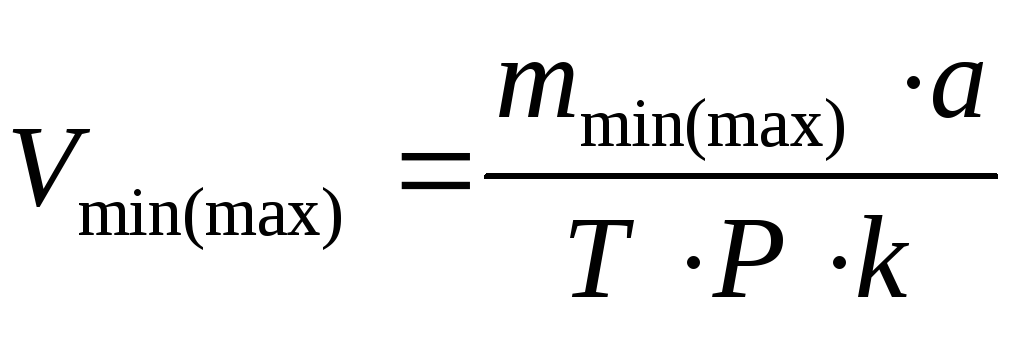 ,где
Vmin(max)
– объем титранта минимальный
(максимальный), необходимый для титрования,
а – навеска (объем) лекарственной формы,
взятая для титрования, Р – общая масса
(объем) лекарственной формы, m
– количество исследуемого вещества в
навеске (берется из Н.О.).
,где
Vmin(max)
– объем титранта минимальный
(максимальный), необходимый для титрования,
а – навеска (объем) лекарственной формы,
взятая для титрования, Р – общая масса
(объем) лекарственной формы, m
– количество исследуемого вещества в
навеске (берется из Н.О.).
Расчеты для димедрола (Мr = 291,82):
![]() г/мл
г/мл
На исследование берется 2 мл ЛФ. тогда масса димедрола равна:
0,5 г - 100 мл
х - 2 мл, отсюда х = 0,01 г
![]() ,
,
Для жидких ЛФ, если прописная масса 0,5 г то отклонение составляет ±8% (0,04 г). Тогда Н.О. 0,46 – 0,54 г
![]()
![]()
Расчеты для аскорбиновой кислоты(Мr = 176,13):
![]() г/мл
г/мл
На исследование берется 1 мл ЛФ. тогда масса аскорбиновой кислоты равна:
5,0г - 100 мл
х - 1 мл, отсюда х = 0,05 г
![]()
Для жидких ЛФ, если прописная масса 5,0 г то отклонение составляет ±3%(0,15 г). Тогда Н.О. 4,85 – 5,15 г
![]()
![]()
Задание №4. Провести качественный и количественный анализ лекарственной формы состава:
Дифенгидрамина гидрохлорида (димедрола) 0,001
Кальция глюконата 0,01
Сахара 0,1
Подлинность.
К 0,01 г порошка прибавляют 2-3 капли концентрированной серной кислоты. Появляется желтое окрашивание, исчезающее при добавлении 2-3 капель воды (дифенгидрамина гидрохлорид).
К 0,05 г порошка прибавляют 1 мл разведенной уксусной кислоты, нагревают до кипения, охлаждают и добавляют 3-5 капель оксалата аммония. Образуется белый осадок, нерастворимый в растворе гидроксида аммония и растворимый в разведенных минеральных кислотах (кальция глюконат).
К 0,005 г порошка прибавляют 1-2 мл разведенной соляной кислоты и несколько кристаллов резорцина. При кипячении смеси в течении 1 мин появляется красное окрашивание (сахар).
Количественное определение.
Дифенгидрамина гидрохлорид (димедрол).
К 0,5 г лекарственной формы прибавляют 5 мл воды, 2 мл разведенной азотной кислоты, 3 мл 0,02 моль/л раствора нитрата серебра 1 мл раствора железоаммониевых квасцов. Избыток нитрата серебра оттитровывают 0,02 моль/л раствором тиоцианата аммония до розового окрашивания.
Кальция глюконат.
К 0,2 г порошка добавляют 10 мл воды при нагревании. После охлаждения прибавляют 10 мл аммиачного буферного раствора, 0,02 г индикаторной смеси кислотного хром темно-синего и титруют 0,05 М раствором трилона Б до сине-фиолетового окрашивания.
Сахар
Определяют рефрактометрическим методом. Для этого 1 каплю раствора , приготовленного для определения кальция глюконата, наносят на призму рефрактометра и определяют показатель преломления. Содержание сахара определяют по формуле:
![]()
Задание №5. Провести качественный и количественный анализ лекарственной формы состава:
Натрия салицилата 6,0
Раствора калия иодида 4,0 – 200,0
Подлинность.
К 1-2 мл лекарственной формы прибавляют 1 мл хлороформа, 2-3 капли разведенной соляной кислоты, 2-3 капли 0,5% раствора перманганата калия и энергично встряхивают. Хлороформный слой окрашивается в фиолетовый цвет (иодид-ион).
К 2 мл раствора прибавляют 1 мл раствора винной кислты, 1 мл ацетата натрия. Раствор охлаждают водопроводной водой и встряхивают. Постепенно выпадает белый кристаллический осадок, растворимый в разведенных минеральный кислотах и растворах едких щелочей (ион калия).
К нескольким каплям добавляют 1-2 капли хлорида железа (III). Появляется сине-фиолетовое окрашивание (салицилат-ион).
Количественное определение.
Калия иодид
К 5 мл раствора прибавляют 5-10 мл воды, 2 мл разведенной уксусной кислоты, 1-2 капли раствора эозината натрия и титруют 0,1 моль/л раствором нитрата серебра до перехода окраски от желтой к розовой.
Натрия салицилат.
К 1 мл раствора прибавляют 2-3 мл эфира, 1 каплю 0,05% раствора метилового оранжевого и титруют при встряхивании 0,1 М раствором соляной кислоты до розового окрашивания водного слоя.
Задание №6. Провести качественный и количественный анализ лекарственной формы состава:
Натрия салицилата 3,0
Раствора натрия бромида 1% - 100,0
Подлинность.
2 капли раствора помещают в фарфоровую чашку, прибавляют 1 каплю раствора сульфата меди. Появляется зеленое окрашивание (салицилат–ион). Затем прибавляют 8-10 капель концентрированной серной кислоты. Появляется черный осадок (бромид-ион).
Графитовая палочка, смоченная раствором и внесенная в бесцветное пламя горелки, окрашивает пламя в желтый цвет.
Количественное определение.
Натрия бромид.
К 2 мл лекарственной формы прибавляют 2-3 капли раствора бромфенолового синего и по каплям разведенную уксусную кислоту до получения зеленовато-желтого окрашивания (1-2 капли). Затем титруют 0,1 моль/л раствором нитрата серебра до сине-фиолетового окрашивания осадка и раствора.
Натрия салицилат.
К 1 мл раствора прибавляют 3-5 мл эфира, 1 каплю метилового оранжевого и титруют при встряхивании 0,1 М раствором соляной кислоты до розового окрашивания водного слоя.
Задание №7. Провести качественный и количественный анализ лекарственной формы состава:
Кислоты аскорбиновой 0,1
Кальция глюконата 0,25
Подлинность.
Около 0,5 г порошка растворяют при нагревании в 8-10 каплях разведенной уксусной кислоты и прибавляют 5-7 капель раствора оксалата аммония. Образуется белый осадок, растворимый в соляной кислоте (ион кальция).
Растворяют 0,05 г порошка при нагревании в 8-10 каплях воды, прибавляют 2-3 капли пергидроля и смесь кипятят 2-3 минуты. Затем охлаждают и прибавляют 1-2 капли раствора хлорида железа (III). Появляется желто-зеленое окрашивание (глюконат-ион).
К 0,005 г порошка прибавляют по 1-2 капли растворов гексацианоферрата (III) калия и хлорида железа (III). Появляется синее окрашивание (кислота аскорбиновая).
К 0,01 г порошка прибавляют 3-5 капель воды и 2-3 капли раствора нитрата серебра . Выделяется осадок серого цвета (кислота аскорбиновая).
Количественное определение.
Кислота аскорбиновая.
0,05 г порошка растворяют в 5 мл воды в колбе с притертой пробкой и титруют 0,1 н. раствором йода до слабо-желтого окрашивания.
Кальция глюконат.
К 0,05 г порошка добавляют 3-5 мл воды при нагревании. После охлаждения прибавляют 3-5 мл аммиачного буферного раствора, 3-4 капли индикатора кислотного хром темно-синего и титруют 0,05 М раствором трилона Б до сине-фиолетового окрашивания.
