
- •1. Схема установки для эхо деталей
- •3.1. Обработка чистого металла
- •3.2. Обработка сплава
- •3.3. Замкнутый водооборот
- •4. Продолжительность обработки и сила тока
- •4.1. Расчеты при эхо деталей из чистого металла
- •4.2. Расчеты при эхо деталей из сплава
- •5. Скорость обработки. Механизм формообразования
- •6. Расход электроэнергии
- •7. Расход и скорость потока раствора электролита
- •8. Защита конструкций от коррозии
- •9. Защита окружающей среды. Очистка раствора электролита
- •10. Результаты расчета
- •11. Понятия и законы химии, использованные в
- •12. Упражнения
- •13. Оформление отчета
12. Упражнения
12.1. Определить массу и число молей реагентов, участвующих в реакции при двухсторонней обработке турбинной лопатки с размерами: длина – 30 см, ширина – 10 см, толщина припуска – 0,2 см, выход по току 1. Лопатка изготовлена:
а) из никеля (плотность 8,9 г/см3, степень окисления +2); б) из железа (плотность 7,8 г/см3, степень окисления +3).
Решение
Объем металла, снимаемый с лопатки, V = 30 ∙ 10 ∙ 0,2 ∙ 2 = 120 см3.
12.1.1. По никелевой лопатке:
Ni + 2 H2O = Ni(OH)2 + H2↑
Масса молей 58,7 2 ∙ 18 92,7 2
по уравнению
фактическая масса 1068 х1 х2 х3
Масса снятого металла m = 120 ∙ 8,9 = 1068 г
Масса воды (5.2) х1 = (1 068 ∙ 2 ∙ 18)/(1 ∙ 58,7) = 655 г
Масса Ni(OH)2 (5.2) х2 = (1 068 ∙ 1 ∙ 92,7)/(1 ∙ 58,7) = 1 687 г
Масса водорода (5.2) х3 = (1 068 ∙ 1 ∙ 2)/(1 ∙ 58,7) = 36,4 г
Число молей никеля n = 1068 : 58,7 = 18,2
Число молей воды n1 = 2 ∙ 18,2 = 36,4
Число молей Ni(OH)2 n2 = 1 ∙ 18,2 = 18,2
Число молей водорода n3 = 1 ∙ 18,2 = 18,2
Объем водорода при нормальных условиях: V = 22,4 ∙ 18,2 = 407,6 л
Сопоставляем массы исходных и конечных веществ, убеждаемся в правильности расчета:
1068 + 655 = 1723 г ; 1067 + 36,4 = 1723,4 г
12.1.2. По железной лопатке
Fe + 3 H2O = Fe (OH)3 + 1,5 H2↑
Масса молей 55,8 3 ∙ 18 106,8 3
по уравнению
фактическая масса 936 х1 х2 х3
Масса снятого металла m = 120 ∙ 7,8 = 936 г
Масса воды х1 = (936 ∙ 3 ∙ 18)/(1 ∙ 55,8) = 905,8 г
Масса Fe(OH)3 х2 = (936 ∙ 1 ∙ 106,8)/(1 ∙ 55,8) = 1791,5 г
Масса водорода х3 = (936 ∙ 1,5 ∙ 2)/(1 ∙ 55,8) = 50,3 г
Число молей железа n = 936 : 55,8 = 16,8
Число молей воды n1 = 3 ∙ 16,8 = 50,4
Число молей Fe(OH)3 n2 = 1 ∙ 16,8 = 16,8
Число молей водорода n3 = 1,5 ∙ 16,8 = 25,2
Объем водорода при нормальных условиях: V = 22,4 ∙ 25,2 = 564,5 л
Сопоставляем массы исходных и конечных веществ:
936 + 905,8 = 1841,8 г ; 1 791,5 + 50,3 = 1841,8 г
12.2. Определите массу и число молей реагентов, участвующих в реакции, при двусторонней обработке турбинной лопатки (размеры – в упражнении 12.1), изготовленной из хрома. Доля хрома, образующего нерастворимый гидроксид Cr(OH)3 и хромовую кислоту H2CrO4, равна соответственно 0,7 и 0,3; плотность хрома 7,2 г/см3.
Решение
Объем металла, снимаемый с лопатки, 120 см3.
Масса снятого металла m = 120 ∙ 7,2 = 864 г
Масса хрома, пошедшая на образование нерастворимого гидроксида Cr(OH)3:
mш = 0,7 ∙ m = 0,7∙ 864 = 605 г
Масса хрома, пошедшая на образование хромовой кислоты H2CrO4 (растворима):
mp = 0,3 ∙ m = 0,3 ∙ 864 = 259 г
В дальнейшем рассчитываем массу и число молей реагентов как для одной (0,7), так и для другой (0,3) доли хрома. Для воды и водорода определяем общую массу.
Масса воды х1 = (605 ∙ 3 + 259 ∙ 4 ∙ 18)/(1 ∙ 52) = 987 г
Масса шлама х2 = (605 ∙ 1 ∙ 103)/(1 ∙ 52) = 1 198 г
Масса хромовой кислоты хр = (259 ∙ 1 ∙ 118)/(1 ∙ 52) = 588 г
Масса водорода х3 = (605 ∙ 1,5 ∙ 2 + 259 ∙ 3 ∙ 2)/(1 ∙ 52) = 64,8 г
Число молей хрома n = 864 : 52 = 16,6
Число молей воды n1 = 987 : 18 = 54,8
Число молей Cr(OH)3 nш = 16,6 ∙ 0,7 = 11,62
Число молей H2CrO4 nр = 16,6 ∙ 0,3 = 4,98
Число молей водорода n1 = 64,8 : 2 = 32,4
Объем водорода при нормальных условиях: V = 22,4 ∙ 32,4 = 725,8 л
Сопоставляем массы исходных и конечных веществ:
864 + 987 = 1851 г ; 1198 + 588 + 64,8 = 1850,8 г
12.3. Определите массу реагентов при двусторонней обработке лопатки, изготовленной из сплава, содержащего 68% никеля, 14% кобальта и 18% хрома; доля хрома, образующего нерастворимый гидроксид 0,7; плотность сплава 8,59 г/см3. (Размеры – в упражнении 12.1).
Решение.
Объем сплава, снимаемый с лопатки, 120 см3.
Масса снятого сплава m = 120 ∙ 8,59 = 1031 г
Масса никеля mNi = 1 031 ∙ 0,68 = 701,1 г
Масса кобальта mCo = 1 031 ∙ 0,14 = 144,3 г
Масса хрома mCr = 1 031 ∙ 0,18 = 185,6 г
Масса хрома, пошедшая на образование нерастворимого гидроксида Cr(OH)3:
mCr = 0,7 ∙ mCr = 0,7∙ 185,6 = 129,9 г
Масса хрома, пошедшая на образование хромовой кислоты H2CrO4:
mp = 0,3 ∙ mCr = 0,3∙ 185,6 = 55,7 г
Массу реагентов, участвующих в реакции с каждым из металлов, вычисляем по уравнению типа (3.2); результаты расчетов сводим в таблицу.
Масса реагентов, участвующих в реакции
|
Обозначение металла |
Масса металла, mi, г |
Масса воды, х1,i, г |
Масса нерастворимого гидроксида (шлама), хш,i, г |
Масса хромовой кислоты, хр, г |
Масса водорода, х3,i, г |
|
Ni |
701,1 |
430,0 |
1107,2 |
- |
23,9 |
|
Co |
144,3 |
88,2 |
227,2 |
- |
4,9 |
|
Crш |
129,9 |
134,9 |
257,3 |
- |
7,5 |
|
Crр |
55,7 |
77,1 |
- |
126,4 |
6,4 |
|
сумма |
1031,0 |
730,2 |
1591,7 |
126,4 |
42,7 |
|
Сопоставление |
Масса исходных веществ 1761,2 г |
Масса конечных веществ 1760,8 г | |||
12.4. Хромоникелевый сплав содержит 70% никеля и 30% хрома, причем одна треть хрома преобразуется в Cr(OH)3 и две трети – в хромовую кислоту H2CrO4. Вычислить химические эквиваленты никеля, хрома, сплава.
Решение.
Сначала вычислим химические эквиваленты металлов:
из (2.24): ЭNi = 58,7 : 2 = 29,35
из (2.29): ЭCr+3/Cr = 52 : 3 = 17,33
из (2.27): ЭCr+6/Cr = 52 : 6 = 8,67
От общего количества сплава приходится на хром, преобразующийся в Cr(OH)3 – 10% и в H2CrO4 – 20%.
Химический эквивалент сплава вычисляем по (4.8):
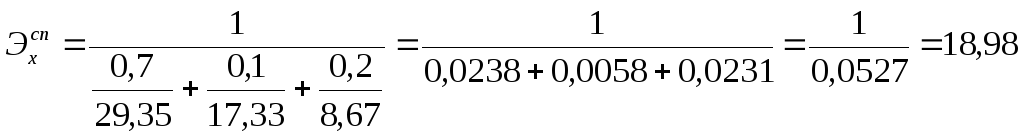
12.5. Определить силу тока, которая необходима при 30-минутной ЭХО детали, изготовленной: а) из никеля; б) из хрома, преобразующегося в Cr(OH)3;
в) из хрома, преобразующегося в H2CrO4; г) из хромоникелевого сплава с содержанием металлов, указанным в упражнении 12.4. Масса снятого металла (сплава) 1000 г. Выход по току 0,95.
Решение.
Расчет выполняем по уравнениям (4.5, 4.7, 4.11). Значения химических эквивалентов берем из упражнения 12.4.
а) I = (1000 ∙ 96 500)/(0,95 ∙ 29,35 ∙ 30 ∙ 60) = 1923 А
б) I = (1000 ∙ 96 500)/(0,95 ∙ 17,33 ∙ 30 ∙ 60) = 3256 А
в) I = (1000 ∙ 96 500)/(0,95 ∙ 8,67 ∙ 30 ∙ 60) = 6512 А
г) I = (1000 ∙ 96 500)/(0,95 ∙ 18,98 ∙ 30 ∙ 60) = 2973 А
