
- •Химическое отделение вятский государственный гуманитарный университет
- •М.А. Зайцев
- •Углеводороды
- •Виды изомерии органических соединений
- •Функциональные группы и классы органических веществ
- •Примеры названий органических веществ
- •Электронная структура атома углерода в органических соединениях
- •Химическая связь в органических соединениях
- •Длины и энергии углерод-углеродных связей
- •Классификация органических реакций
- •Углеводороды Алканы
- •Алкадиены
- •3Нссн бензол
- •Ароматические углеводороды (арены)
- •Задачи по теме
- •Цепочки превращений
- •Литература
Виды изомерии органических соединений
Различают следующие виды изомерии.
Структурная изомерия.
Изомерия цепи. Изомеры отличаются длиной углеводородной цепи. Характерна для всех классов органических веществ. Например:
СН3–СН2–СН2–СН3 бутан, tкип = 0С,
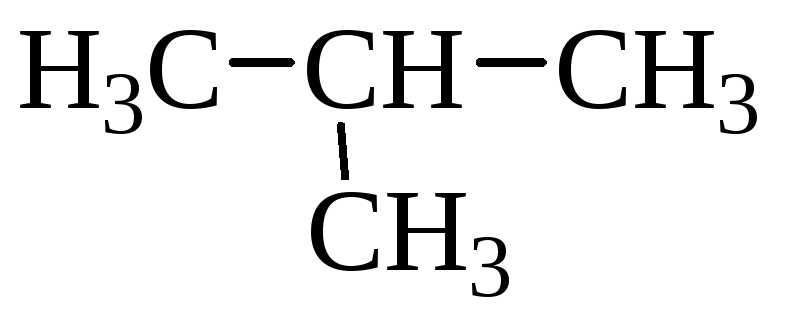 2-метилпропан,
tкип
= –12С.
2-метилпропан,
tкип
= –12С.
Изомерия положения
а) углеводородных радикалов:


3-метилпентан 2-метилпентан
б) кратных связей:
СН2=СН–СН2–СН3 бутен-1; СН3–СН=СН–СН3 бутен-2;
в) функциональных групп:
СН3–СН2–СН2–ОН
пропанол-1; ![]() пропанол-2.
пропанол-2.
Изомерия взаимного положения кратных связей, радикалов, функциональных групп:
СН2=СН–СН2–СН=СН2 СН2=СН–СН=СН–СН3
пентадиен-1,4 пентадиен-1,3


2,3-диметилгексан 2,4-диметилгексан
 НО–СН2–СН2–СН2–ОН
НО–СН2–СН2–СН2–ОН
пропандиол-1,2 пропандиол-1,3
Метамерия. Характерна для соединений, имеющих в составе молекулы (цепи) гетероатом, и зависит от его положения. Например:
СН3–О–СН2–СН2–СН3 метилпропиловый эфир;
СН3–СН2–О–СН2–СН3 диэтиловый эфир.
Межклассовая изомерия. Например:
НСС–СН2–СН3 бутин-1 Н2С=СН–СН=СН2 бутадиен-1,3
СН3–СН2–ОН этиловый спирт; СН3–О–СН3 диметиловый эфир

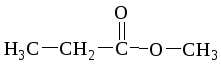
бутановая кислота метилпропаноат

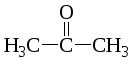
пропаналь пропанон
CH3–CH2–NO2 H2N–CH2–COOH
нитроэтан аминоэтановая кислота
Кольчато-цепная изомерия. Характерна для соединений, имеющих в составе молекулы кратную связь или цикл. Например:
СН2=СН–СН2–СН3
бутен-2;  циклобутан.
циклобутан.
Пространственная изомерия.
Конфигурационная изомерия.
Геометрическая изомерия. Характерна для соединений, имеющих в составе молекулы двойную связь или цикл и около них одинаковые атомы или группы атомов. Примеры:
СН3–СН=СН–СН3 бутен-2. Для этого вещества характерны два геометрических изомера:
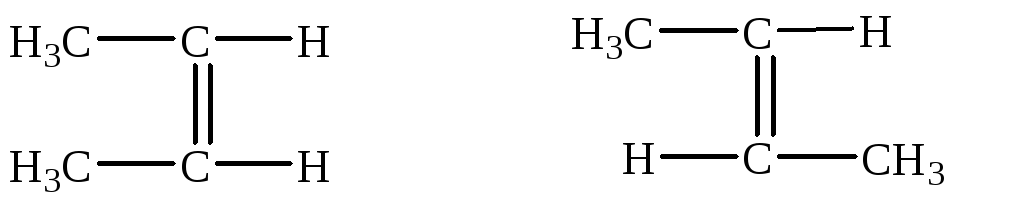
цис-бутен-2 транс-бутен-2
Для циклопропандикарбоновой кислоты также характерны два геометрических изомера:

цис-циклопропандикарбоноваятранс-циклопропандикарбоновая
кислота кислота
1.2. Оптическая изомерия. Характерна для соединений, имеющих в составе молекулы асимметричный атом углерода (С*), т.е. атом, у которого все 4 валентности заняты разными атомами или группами атомов. Такие молекулы способны вращать поляризованный свет. Если вещество отклоняет плоскость поляризации влево, то оно называется левовращающим (L)изомером, если вправо –правовращающим (D)изомером. МолекулыD- иL-изомеров являются зеркальным отражением друг друга. Например:

2. Конформационная изомерия. Электронная плотность -связи между двумяsp3-гибридизованными атомами углерода распределена равномерно относительно оси связи, т.е.-связь обладает осевой симметрией. Из этого следует, что вокруг одинарной С–С-связи возможно вращение атомов углерода. Это хорошо видно на шаростержневой модели этана. Поворот одной метильной группы относительно другой в этане происходит без нарушения химического строения молекулы, не меняются порядок связывания атомов, межатомные расстояния, величины углов между связями. Изменяется лишь взаимное расположение в пространстве атомов водорода. В случае других соединений можно говорить об изменении взаимного расположения заместителей, не связанных друг с другом ковалентными связями. Молекула может принимать при этом различные геометрические формы.
Различные геометрические формы молекулы, переходящие друг в друга путем вращения вокруг -связей, называютсяконформациями.
В результате вращения вокруг -связи между атомами углерода из множества возможных конформаций молекула этана стремится принять наиболее выгодную конформацию, обладающую наименьшей внутренней энергией. Рассмотрим из всех возможных две конформации этана. В одной из этих конформаций:

расстояние между атомами водорода двух метильных групп наименьшее, поэтому находящиеся друг против друга связи С–Н отталкиваются. Это приводит к увеличению потенциальной энергии молекулы, а следовательно, к меньшей устойчивости этой конформации. Такая конформация называется заслоненной.
В другой конформации:

атомы водорода двух метильных групп удалены на максимально возможное расстояние друг от друга. При этом электронное взаимодействие связей С–Н наименьшее и потенциальная энергия этой конформации также наименьшая. Такая конформация называется заторможенной. Она более устойчива. Разница в энергиях заслоненной и заторможенной конформаций этана составляет 10–12 кДж/моль. При обычных условиях конформации этана легко переходят друг в друга и составляют равновесную смесь. Выделить этан в виде какой-либо отдельной конформации невозможно. Существование конформаций этана обнаруживается только с помощью физико-химических методов.
Однако в случае более сложных соединений появляется реальная возможность выделения в индивидуальном состоянии отдельных, наиболее устойчивых конформаций, которые принято называть конформерами.
Таутомерия – вид изомерии, при которой одно и то же вещество существует в виде нескольких форм, находящихся в состоянии динамического равновесия. Примеры:
1). Кольчато-цепная таутомерия глюкозы:

-глюкоза открытая, альдегидная -глюкоза
форма глюкозы
2). Кето-енольная таутомерия (енолы – это соединения, содержащие в молекулах гидроксильную группу и двойную связь):
![]() ⇄
⇄ ![]()
виниловый спирт уксусный альдегид
(енольная форма) (кетоформа);
![]() ⇄
⇄ ![]()
кетоформа енольная форма
пептидной связи.
Классификация и номенклатура органических веществ
В классификации органических веществ принимаются за основу два важнейших признака:
строение углеродного скелета и
наличие в молекуле функциональных групп.
Различают следующие типы соединений по строению углеродного скелета (табл. 1).
Таблица 1
Типы органических соединений по строению углеродного скелета
|
Органические вещества | |||||||
|
Ациклические |
Карбоциклические |
Гетероциклические | |||||
|
Предельные |
Непредельные |
Предельные |
Непредельные |
Ароматические |
Предельные |
Непредельные |
Ароматические |
Ациклические (алифатические, соединения жирного ряда) – это соединения, имеющие открытую углеродную цепь (разветвленную или неразветвленную). Например:
СН3–СН2–СН2–СН3
бутан, 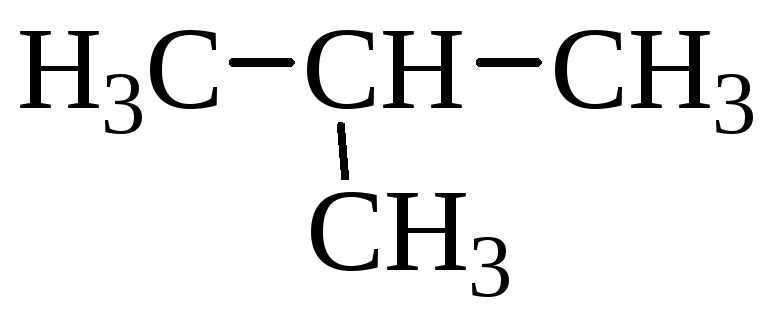 2-метилпропан.
2-метилпропан.
Карбоциклические – это соединения, в которых углеродная цепь замкнута в цикл (кольцо). Например:

Гетероциклические – это соединения, содержащие в цикле, кроме атомов С, атомы других элементов. Например:

Карбоциклические и гетероциклические соединения могут быть ароматическими, если наблюдается сопряжение р-электронов и образование циклической -электронной системы.
В большинстве органических молекул помимо атомов С и Н содержатся атомы других элементов. Именно от них в первую очередь зависят химические свойства вещества. Эти атомы входят в состав функциональных групп, т. е. групп атомов неуглеводородного характера, определяющих принадлежность соединения к определенному классу (табл. 2).
Таблица 2
