
reshenie_zadach
.pdf
Решаем задачи А28, В9, В10, С5
http://www.ycnex-ege.ru
СОДЕРЖАНИЕ
1.Введение: нужно ли на ЕГЭ решать расчетные задачи?
2.Базовые знания для решения расчетных задач.
3.Решение задач А28.
4.Решение задач В10.
5.Решение задач В9.
6.Решение задач С5.
7.Заключение.

Введение: нужно ли на ЕГЭ решать расчетные задачи?
За расчетные задачи на ЕГЭ по химии можно получить приличное число баллов: А28
– 1 балл, В9 -1 балл, В10 – 1 балл, С4 – 4 балла, С5 – 3 балла. В этом пособии мы не
будем разбирать задачи С4 - как самые сложные и рассчитанные на более продвинутых учеников по химии. Все остальные задания могут выполнить не только
отличники. Их под силу одолеть каждому: стоит лишь навести порядок в голове и четко уяснить алгоритм решения примерно 10 типов задач.
БАЗОВЫЕ ЗНАНИЯ ДЛЯ РЕШЕНИЯ РАСЧЕТНЫХ ЗАДАЧ.
1. Основные величины:
n - количество вещества (моль) В уравнении всегда равно коэффициенту.
m - масса (г, кг)
M - молярная масса (г/моль, кг/кмоль) Численно равна относительной молекулярной массе, получающейся при сложении атомных масс.
V - объем (л, м3)
Vm - молярный объем газа при н.у. Всегда равен 22,4 л/моль.
Q - тепловой эффект (кДж/моль) q - теплота (кДж)
2. Взаимосвязь величин (формулы): |
|
|
m |
V |
q |
n = — → m = n • M; |
n = — → V = n • Vm; |
n = — → q = n • Q |
M |
Vm |
Q |
3. Общий алгоритм решения задач - пропорция: неизвестную величину находим по известной.
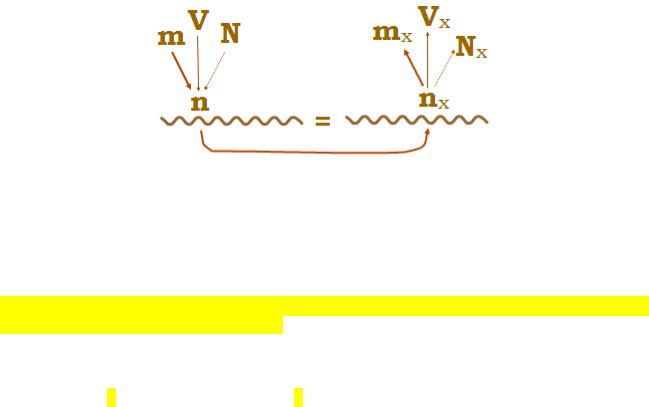
Например: 4моль х моль |
В пропорции должно быть только |
одно |
неизвестное. |
—= — Все остальные величины либо даны в условии (4моль),
2моль 3моль |
либо в уравнении реакции (число моль = коэффициенту). |
Помните правило решения пропорции: крест - накрест, то есть, произведение средних членов равно произведению крайних.
4• 3
4•3=х• 2 отсюда следует: х = ——— = 6 (моль )
2

А28
РАСЧЕТНЫЕ ЗАДАЧИ ПО УРАВНЕНИЯМ РЕАКЦИЙ
ТИП 1
РАСЧЕТ ПО ТЕРМОХИМИЧЕСКОМУ УРАВНЕНИЮ
Задание: При образовании аммиака согласно уравнению реакции N2 + 3H2 = 2NH3 + 92 кДж выделилось 230 кДж теплоты. Найти объем водорода (н.у.), вступившего при этом в реакцию:
1) 44,8 л 2) 56 л 3) 112 л 4) 168 л (выбрать правильный ответ).
Решение:
По условию: |
|
V-? |
|
230 кДж |
|
N2 + 3H2 = 2NH3 + 92 кДж |
|||
|
|
↓ |
↓ |
||
|
(3•22,4 л/моль) |
|
|
||
|
|
|
|
|
|
Из уравнения: |
67,2 л |
92 кДж |
|||
|
V (л) |
|
230 (кДж) |
|
х моль |
230 (кДж) |
|
— |
= |
— |
|
—— |
= —— |
Пропорция: |
или |
|||||
|
67,2 (л) |
|
92 (кДж) |
|
3 моль |
92 (кДж) |
67,2 |
•230 |
|
V(Н2) = ———— = 168 (л) |
х = 7,5 моль |
|
92 |
|
V(Н2) =22,4•7,5=168(л) |
Ответ: |
4) 168 л |
Задание: В соответствии с термохимическим уравнением 2AgNO3 = 2Ag + 2NO2 + O2 - 317 кДж количество теплоты, необходимое для для разложения 1,7 г нитрата серебра, составляет:
1) 31,7 кДж 2) 1,585 кДж 3) 3,17 кДж 4) 15,85 кДж
Решение: |
(0,01 моль) |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
По условию: |
1,7 г |
q-? |
|||||
|
|
|
2AgNO3 = 2Ag + 2NO2 + O2 - 317 кДж |
|||||
|
|
|
|
↓ |
↓ |
|||
(2•170г/моль)
Из уравнения: |
|
340 г |
|
317 кДж |
Пропорция: |
|
1,7 г |
q кДж |
|
0,01 моль |
q кДж |
|
|
— |
= — |
|
—— |
= —— |
|
|
или |
||||
|
|
340 г |
317 кДж |
|
2 моль |
317 кДж |
1,7 • 317
q = ———— = 1,585 (кДж)
340
0,01• 317
q = ———— = 1,585 (кДж)
2
Ответ: |
2) 1,585 кДж |

ТИП 2
ОБЪЕМНЫЕ ОТНОШЕНИЯ ГАЗОВ В ХИМИЧЕСКОМ УРАВНЕНИИ
Задание: Объем (н.у.) углекислого газа, который образуется при сжигании 5 л (н.у.) угарного газа,
равен: 1) 5 л 2) 2,5 л |
3) 7,5 л |
4) 10 л |
ДАНО: |
Решение: |
|
|
|
V(CO) = 5 л |
|
|
5 л |
V (л) |
По условию: |
||||
—————— |
|
|
2CO + O2 = 2CO2 |
|
НАЙТИ: |
|
|
↓ |
↓ |
V (CO2)= ? |
|
2 • 22,4 (л) |
2 • 22,4 )л) |
|
Из уравнения: |
||||
Пропорция: |
5 л |
|
V (л) |
|
— |
= |
— |
|
2 • 22,4 (л) |
|
2 • 22,4 (л) |
V(CO2)= 5 л
СЕКРЕТ ТАКОЙ: ОБЪЕМЫ ГАЗОВ, ВСТУПАЮЩИХ В РЕАКЦИЮ И ОБРАЗУЮЩИХСЯ В РЕЗУЛЬТАТЕ РЕАКЦИИ ОТНОСЯТСЯ ТАК ЖЕ, КАК ИХ КОЭФФИЦИЕНТЫ В УРАВНЕНИИ:
|
5 л |
|
V (л) |
Решаем проще: |
— |
= |
— |
|
2 |
|
2 |
V (CO2) = 5 л
Ответ: |
1) 5 л |
Задание на закрепление и краткая запись решения:
Какой объем кислорода потребуется для полного сгорания 10 л (н.у.) ацетилена?
1) 20 л 2) 5л 3) 50 л 4) 25 л
Дано: |
|
Решение: |
|
|
||||||
V (C2Н2) =10 л |
|
|
|
|
|
|
|
|
10 л |
V л |
|
|
|
|
По условию: |
||||||
—————— |
|
|
|
|
|
|
|
|
2 C2H2 + 5 O2 = 4 CO2 + 2 H2O |
|
Найти: |
|
|
|
|
|
↓ |
↓ |
|||
|
|
Из уравнения: |
|
|||||||
V (O2) = ? |
|
|
|
|
|
|
|
|
2 моль |
5 моль |
|
|
|
|
|
|
|
|
|
|
10 л • 5 моль |
|
|
|
|
|
|
V (O2) = ————— = 25 л |
||||
|
|
|
|
Расчет: |
||||||
|
|
|
|
|
|
|
|
|
|
2 моль |
Ответ: |
|
|
|
|
||||||
4) 25 л |
|
|
||||||||

В10
РАСЧЕТНЫЕ ЗАДАЧИ ПО УРАВНЕНИЯМ РЕАКЦИЙ
ТИП 1
НАХОЖДЕНИЕ НЕИЗВЕСТНОЙ МАССЫ ПО ЗАДАННОЙ МАССЕ
(объему или количеству вещ-ва)
Задание 1: Рассчитайте массу свинца, полученного в результате взаимодействия 6,5 г цинка с избытком раствора нитрата свинца. (Запишите ответ в граммах с точностью до целых).
СПОСОБ I
По условию: |
|
6,5 г |
|
|
x-? |
|
|
Zn + Pb(NO3)2 |
= Zn(NO3)2 + Pb |
||
|
|
↓ |
|
↓ |
||
|
(1•65 г/моль) |
(1•207 г/моль) |
||||
|
|
|
|
|
|
|
Из уравнения: |
65 г |
207 г |
||||
Пропорция: |
6,5 г |
|
х г |
|
— |
= |
— |
|
65 г |
|
207 г |
6,5 • 207
х = ———— = 20,7 = 21 (г)
65

СПОСОБ II - мольный (вся пропорция будет в молях)
По условию: 6,5 г (0,1 моль) x-?
Zn + Pb(NO3)2 = Zn(NO3)2 + Pb
(М=65 г/моль) |
(М=207 г/моль) |
↓ ↓
Из уравнения: |
|
1 моль |
|
1 моль |
|
|
|
|
|
|
m 6,5 |
[Нужно массу цинка 6,5 г перевести в количество вещества по формуле n= — = — = 0,1 моль] M 65
Пропорция: |
0,1 моль |
|
х моль |
|
— |
= |
— |
|
1 моль |
|
1 моль |
0,1 • 1
х = ———— = 0,1 (моль); m (Pb) = 207 г/моль • 0,1 моль = 20,7 = 21 (г)
1
В бланк ответов внести ответ: 21
P.S. на слово "избыток" в условии задачи не обращать внимания.

Задание 2: Масса газа, выделившегося при обработке избытком соляной кислоты 3 моль сульфида натрия, равна _____ г. (Записать ответ с точностью до целых)
Эту задачу можно решать любым из двух способов. Например, первым:
По условию: |
|
3 моль |
|
x г-? |
1 Na2S + 2 HCl = 2 NaCl + 1 H2S
↓ ↓
(1•34 г/моль)
Из уравнения: |
|
1 моль |
|
34 г |
Обратить внимание: единицы измерения для пропорции у одного и того же вещества должны быть одинаковые (над формулой и под формулой), но у каждого вещества они свои (смотреть условие).
Пропорция: |
3 моль |
|
х г |
|
— |
= |
— |
|
1 моль |
|
34 г |
3• 34
х = ———— = 102 (г)
1
В бланк ответов внести ответ: 102
