
- •Метод ЛМО
- •Метод канонических молекулярных орбиталей (КМО) не согласуется с классическими структурными представлениями о молекуле,
- •Основная идея метода ЛМО: любую молекулу можно построить из двух фрагментов:
- •Метод КМО
- •Узловая структура ЛМО
- •Симметрия ЛМО
- •Узловая структура ЛМО -типа
- •МО -типа
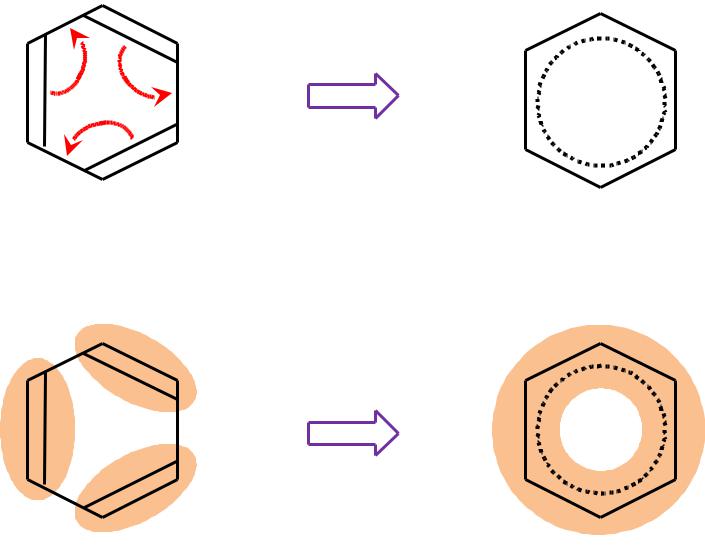
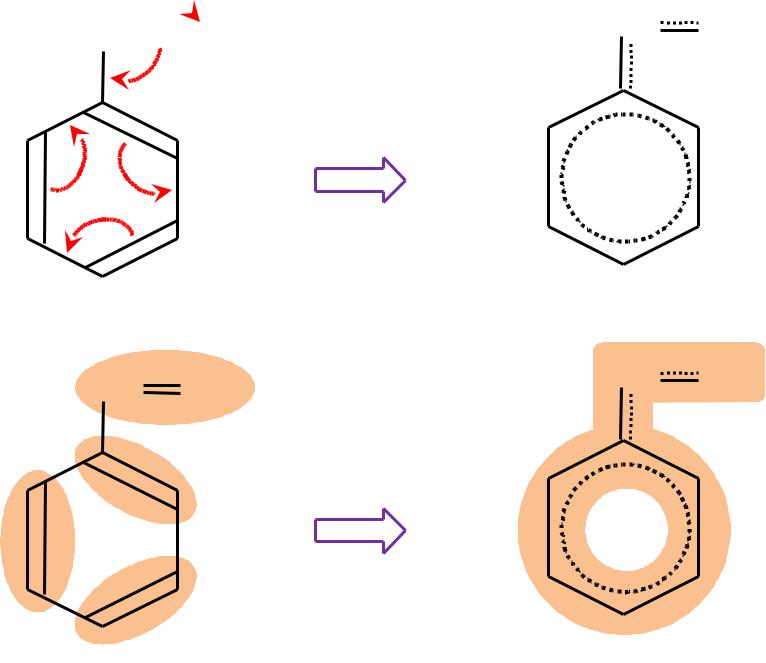
- •Правило «перекрывания»
- •Корреляционная диаграмма
- •Корреляционная диаграмма молекулы Н2О
- •Кратные связи
- •Образование канонических МО
- •Специфика образования локализованных МО
- •На основе молекулярных ЛМО-моделей химики получают возможность решения ряда важных задач:
- •Модель ЛМО имеет два существенных недостатка
- •Гибридизация АО
- •Орбитально-оболочечная модель иона никеля
- •Шаровые АО (типа s-, p-, d-, …) образуют лишь один из возможных базисных
- •Наиболее распространенные типы гибридизации
- •Пространственная форма ГАО
- •Все ГАО «вытянуты» в направлении некоторой пространственной оси и имеют не шаровую, а
- •sp2-гибридизация
- •sp3-гибридизация
- •Тип гибридизации и пространственная форма молекулы тесно связаны
- •Влияние неподеленных электронных пар
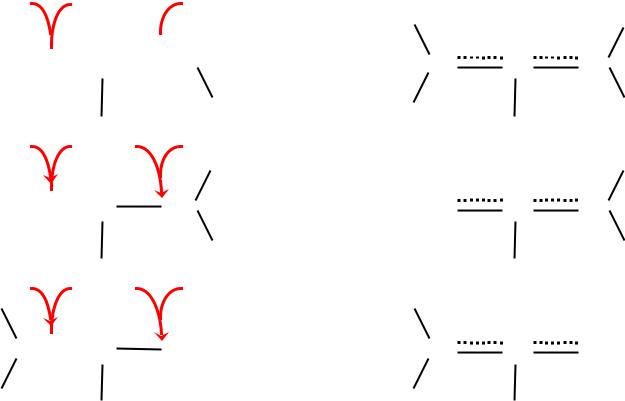
- •Эффекты сопряжения
- •( – )-сопряжение.
- •(n– )-сопряжение
- •(p– )-сопряжение
- •( – )-сопряжение (гиперконъюгация)
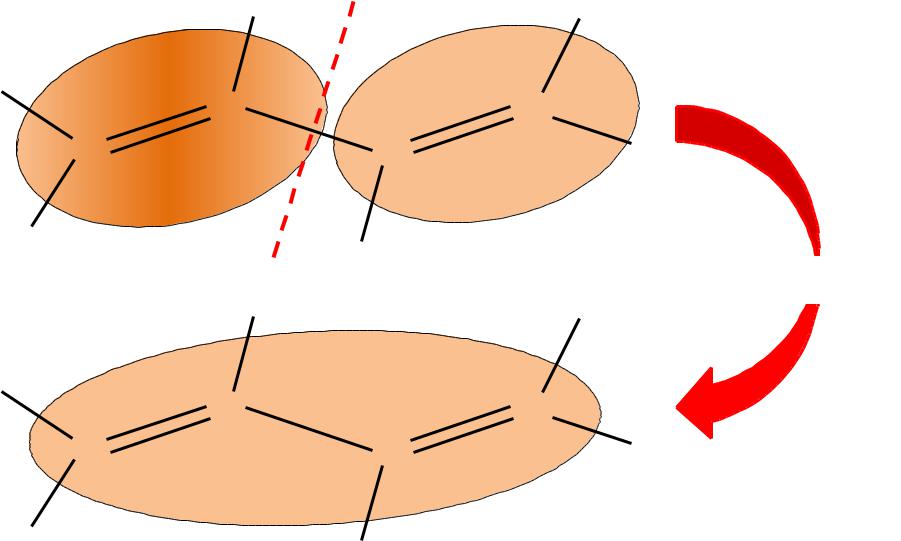
Эффекты сопряжения
|
С |
|
С |
|
|
С |
С |
|
|
1 |
= р1 + р2 |
2 |
= р3 + р4 |
сопряжение |
С |
С |
С |
С |
= 1 + 2 = р1 + р2 + р3 + р4
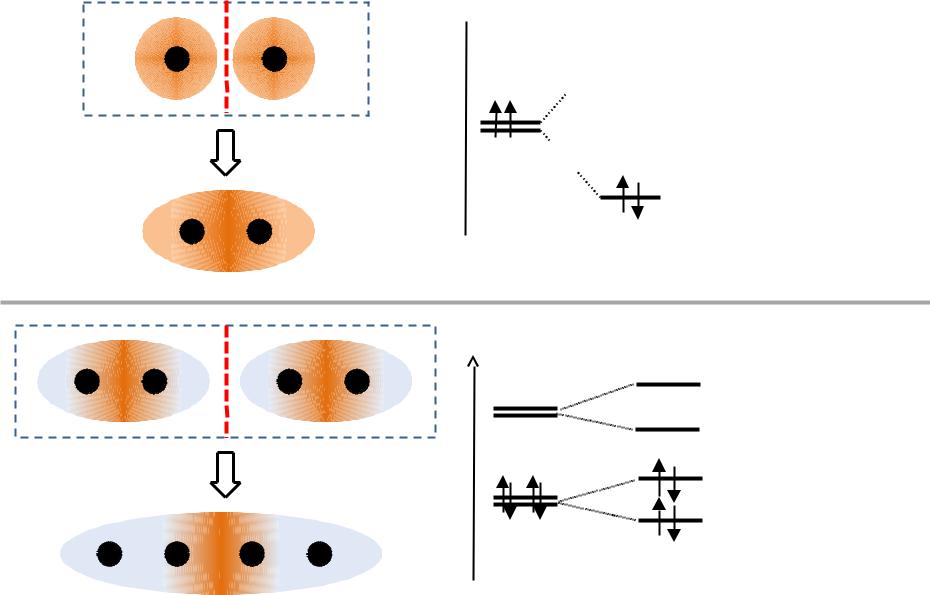
 Е
Е
ψ2 





 φ2 = ψ1 – ψ2
φ2 = ψ1 – ψ2
ψ1




φ1 = ψ1 + ψ2
АО МО
Е |
|
|
|
|
1* |
–* |
= 1* |
– 2* |
|
2* |
+* = 1* |
+ 2* |
||
2 |
– |
= |
1 |
– 2 |
|
||||
1 |
+ |
= |
1 |
+ 2 |
ЛМО ДЛМО
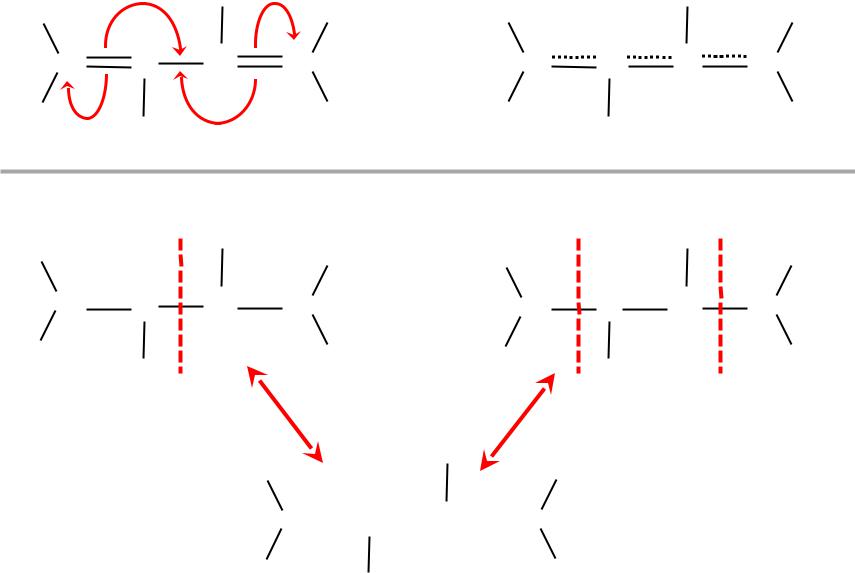
С С С С |
С С С С |
«неклассическая» формула
Резонансные формы
С •• С С •• С |
С• С •• С •С |
С С
С






 С
С С
С
Мезомерная форма
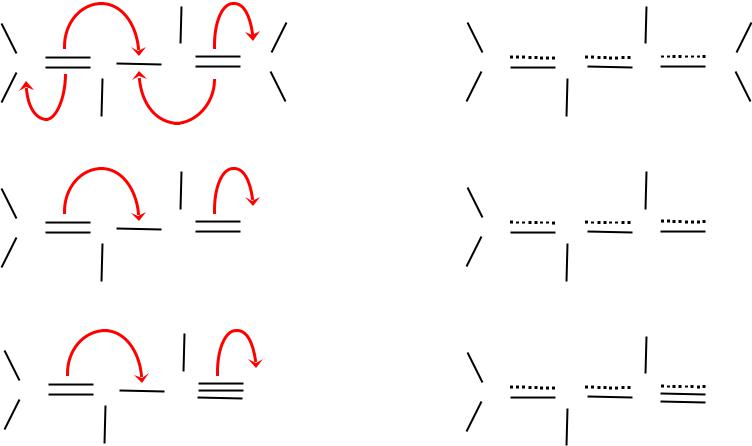
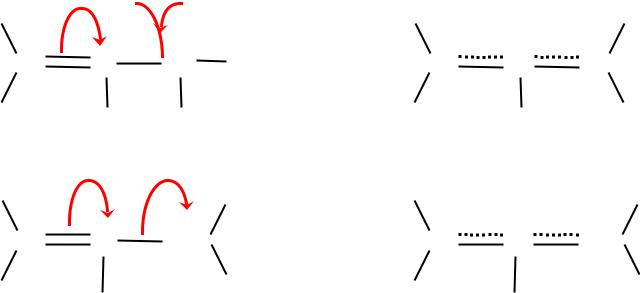
( – )-сопряжение.
имеющее место при определенном (соседнем) расположении в молекуле кратных связей -типа
С С С С |
С С С С |
+ –
С С С О |
С С С О |
+ –
С С С N |
С С С N |
СН  СН2 СН СН2
СН2 СН СН2
СН СН2 СН СН2
(n– )-сопряжение
имеющее место при определенном (соседнем) расположении в молекуле кратной связи -типа и
неподеленной пары электронов
 С
С С
С ••
•• 
 N
N
••
O С N
С N
••
С С F
С F
– |
+ |
С |
С |
N |
|
– |
+ |
O |
С N |
– |
+ |
С С |
F |
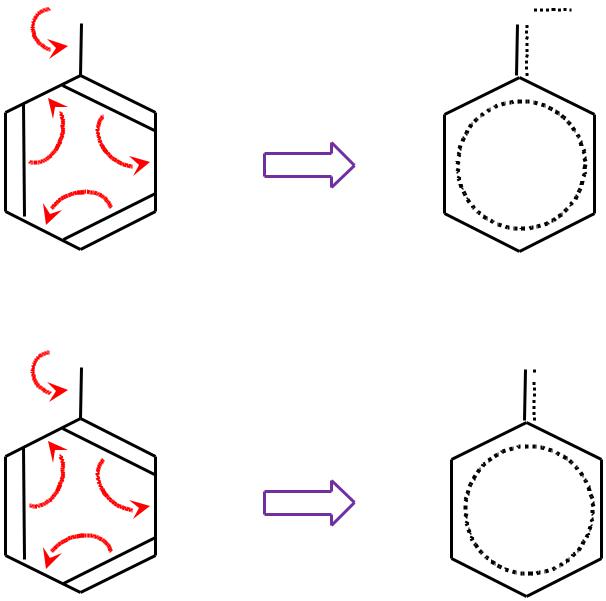
:О—Н |
δ+ |
О Н |
δ–
:NН2 |
δ+ |
NН2 |
δ–
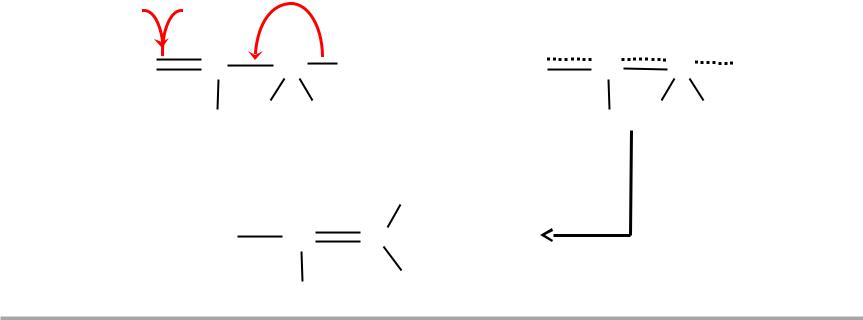
(p– )-сопряжение
имеющее место при определенном (соседнем) расположении в молекуле кратной связи -типа и
вакантной р-орбитали (лакуны)
|
|
|
|
½ |
½ |
С |
С |
|
С |
С |
|
|
|
||||
С |
|
|
С |
|
|
|
|
|
|
|
+ |
– |
C С Al |
C |
С Al |
( – )-сопряжение (гиперконъюгация)
имеющее место при определенном (соседнем) расположении в молекуле кратной связи -типа и простой -связи С—Н или N—H
|
– |
+ |
О С С |
О С |
С H |
H |
|
|
•• + О С С H
–
Диссоциация молекулы по кислотному типу («С-Н-кислоты» — альдегиды, кетоны, карбоновые кислоты, сложные эфиры и др.)
