
- •Метод ЛМО
- •Метод канонических молекулярных орбиталей (КМО) не согласуется с классическими структурными представлениями о молекуле,
- •Основная идея метода ЛМО: любую молекулу можно построить из двух фрагментов:
- •Метод КМО
- •Узловая структура ЛМО
- •Симметрия ЛМО
- •Узловая структура ЛМО -типа
- •МО -типа
- •Правило «перекрывания»
- •Корреляционная диаграмма
- •Корреляционная диаграмма молекулы Н2О
- •Кратные связи
- •Образование канонических МО
- •Специфика образования локализованных МО
- •На основе молекулярных ЛМО-моделей химики получают возможность решения ряда важных задач:
- •Модель ЛМО имеет два существенных недостатка
- •Гибридизация АО
- •Орбитально-оболочечная модель иона никеля
- •Шаровые АО (типа s-, p-, d-, …) образуют лишь один из возможных базисных
- •Наиболее распространенные типы гибридизации
- •Пространственная форма ГАО
- •Все ГАО «вытянуты» в направлении некоторой пространственной оси и имеют не шаровую, а
- •sp2-гибридизация
- •sp3-гибридизация
- •Тип гибридизации и пространственная форма молекулы тесно связаны
- •Влияние неподеленных электронных пар
- •Эффекты сопряжения
- •( – )-сопряжение.
- •(n– )-сопряжение
- •(p– )-сопряжение
- •( – )-сопряжение (гиперконъюгация)
Орбитально-оболочечная модель иона никеля
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4d |
||
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|||
|
4p |
|
|
|
|
||||
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4s |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3d |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ψ1 |
ψ2 |
ψ3 |
ψ4 |
ψ5 |
ψ6 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4d |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3d |
|
|
|
|
|
|
Ψ— «гибридные» атомные орбитали (ГАО)
Ψ= С1(4s) + С2(4px) + С3(4py) + С4(4pz) + С5(4d1) + С6(4d2)
1 |
|
С11 |
С12 |
… С1n |
|
1 |
|
2 |
= |
С21 |
С22 |
… С2n |
• |
2 |
Базисный |
набор |
|||||||
… |
|
………………. |
|
… |
|
||
n |
|
Сn1 Сn2 … Сnn |
|
n |
|
||
Переход к другому базису
1′ |
|
U11 |
U12 |
… U1n |
|
1 |
2′ |
= |
U21 |
U22 |
… U2n |
• |
2 |
… |
|
………………. |
|
… |
||
n′ |
|
Un1 Сn2 … Unn |
|
n |
||
Базисный набор |
|
|
|
Базисный набор |
||
из гибридных АО |
|
|
|
из шаровых АО |
||
i′ = Ui1( 1) + Ui2( 2) + … + Uin( n)

Шаровые АО (типа s-, p-, d-, …) образуют лишь один из возможных базисных наборов в пространстве состояний электронов .
Этот набор является стационарным в условиях полной изоляции, когда атом сферически симметричен.
Когда атом взаимодействует с окружением из нескольких других атомов, стационарным становится другой набор, а именно — набор гибридных АО.
Атомы, составляющие ближайшее окружение рассматриваемого атома, влияют на него, искажая шаровые (сферически симметричные) АО.
Поэтому тип гибридизации полностью определяется таким окружением.
Наиболее распространенные типы гибридизации
Тип молекулы
Линейный L1—A— L2
Плоский треугольный АL3
Тетраэдрический AL4
Плоский квадратный АL4
Тригональная бипирамида АL5
Тетрагональная бипирамида (октаэдр) АL6
Тип гибридизации АО центрального атома
sp
sp2
sp3
dsp2
sp3d или dsp3
sp3d2 или d2sp3
Пространственная форма ГАО
– |
+ |
+ |
х |
– |
+ |
х |
|
|
2px 2s |
узловая |
(sр) |
+ |
= 2s + 2px |
|
поверхность |
|
+ |
+ |
– |
х |
+ |
х |
|
– |
2px 2s |
узловая |
(sр)– = 2s – 2px |
|
поверхность |
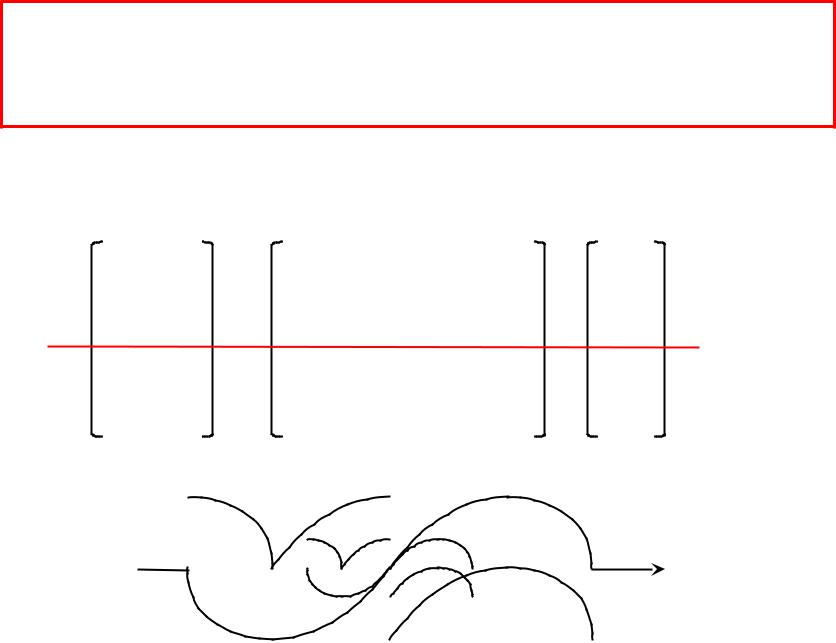
Все ГАО «вытянуты» в направлении некоторой пространственной оси и имеют не шаровую, а только аксиальную симметрию
ГАО1 ГАО2
2py
2pZ
sp-гибридизация
|
1 |
1 |
0 |
0 |
|
2s |
= |
1 |
–1 |
0 |
0 |
• |
2px |
|
|
|
|
2py |
||
|
0 |
0 |
1 |
0 |
|
|
|
0 |
0 |
0 |
1 |
|
2pz |
+ |
– |
– |
+ |
х |
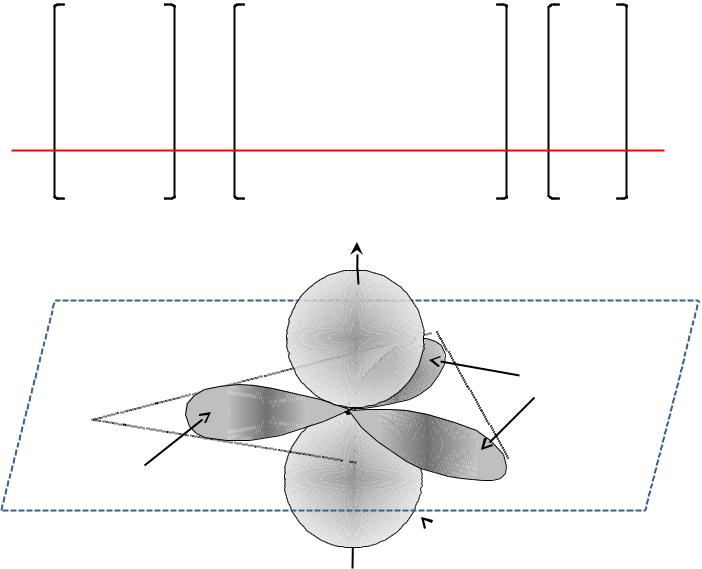
sp2-гибридизация
ГАО1 |
|
1 |
1 |
1 |
0 |
|
2s |
|
ГАО2 |
= |
1 |
1 |
–1 |
0 |
• |
2px |
|
ГАО |
3 |
1 |
–1 |
1 |
0 |
2p |
||
|
|
|
|
|
|
|
y |
|
2pZ |
|
0 |
0 |
0 |
1 |
|
2pz |
|
|
|
|
|
|
Z |
|
|
|
+ |
XY |
|
sp2 |
||
|
sp2 –



















































































 2pZ
2pZ
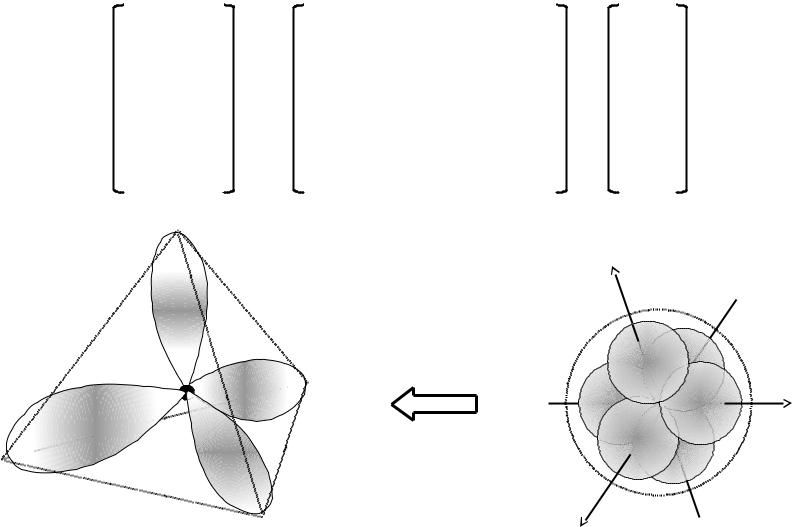
sp3-гибридизация
ГАО1 |
|
1 |
1 |
1 |
1 |
|
2s |
|
ГАО2 |
= |
1 |
1 |
–1 |
–1 |
• |
2px |
|
ГАО |
3 |
1 |
–1 |
1 |
–1 |
2p |
||
|
|
|
|
|
|
|
y |
|
ГАО4 |
|
1 |
–1 |
–1 |
1 |
|
2pz |
|
Z
Y
|
Х |
sp3-ГАО |
Шаровые АО |
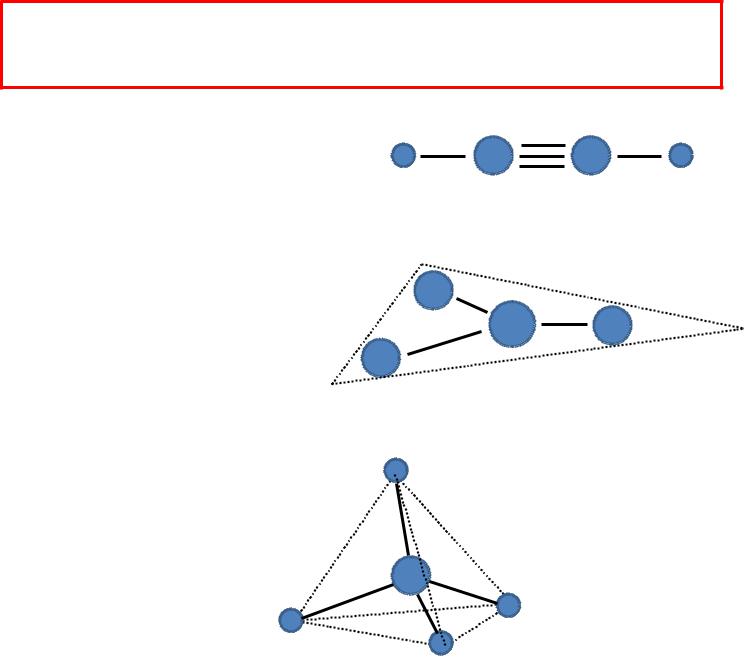
Тип гибридизации и пространственная форма молекулы тесно связаны
Н — С ≡≡ С — Н
sp-гибридизация
(2 соседних атома)
BF3
sp2-гибридизация
(3 соседних атома)
СН4
sp3-гибридизация
(4 соседних атома)
Линейная форма
Плоская форма
Тетраэдрическая
форма
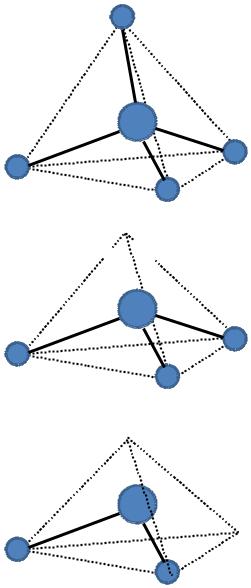
Влияние неподеленных электронных пар
СН4
sp3-гибридизация
(4 соседних атома)
NН3
sp3-гибридизация
(3 соседних атома + 1 неподеленная пара)
Н2О
sp3-гибридизация
(2 соседних атома + 2 неподеленные пары)
Тетраэдрическая
форма
••







 Тетраэдрическая
Тетраэдрическая
форма
•• |
Тетраэдрическая |
|
форма |
|
• |
|
• |
