
- •Метод ЛМО
- •Метод канонических молекулярных орбиталей (КМО) не согласуется с классическими структурными представлениями о молекуле,
- •Основная идея метода ЛМО: любую молекулу можно построить из двух фрагментов:
- •Метод КМО
- •Узловая структура ЛМО
- •Симметрия ЛМО
- •Узловая структура ЛМО -типа
- •МО -типа
- •Правило «перекрывания»
- •Корреляционная диаграмма
- •Корреляционная диаграмма молекулы Н2О
- •Кратные связи
- •Образование канонических МО
- •Специфика образования локализованных МО
- •На основе молекулярных ЛМО-моделей химики получают возможность решения ряда важных задач:
- •Модель ЛМО имеет два существенных недостатка
- •Гибридизация АО
- •Орбитально-оболочечная модель иона никеля
- •Шаровые АО (типа s-, p-, d-, …) образуют лишь один из возможных базисных
- •Наиболее распространенные типы гибридизации
- •Пространственная форма ГАО
- •Все ГАО «вытянуты» в направлении некоторой пространственной оси и имеют не шаровую, а
- •sp2-гибридизация
- •sp3-гибридизация
- •Тип гибридизации и пространственная форма молекулы тесно связаны
- •Влияние неподеленных электронных пар
- •Эффекты сопряжения
- •( – )-сопряжение.
- •(n– )-сопряжение
- •(p– )-сопряжение
- •( – )-сопряжение (гиперконъюгация)
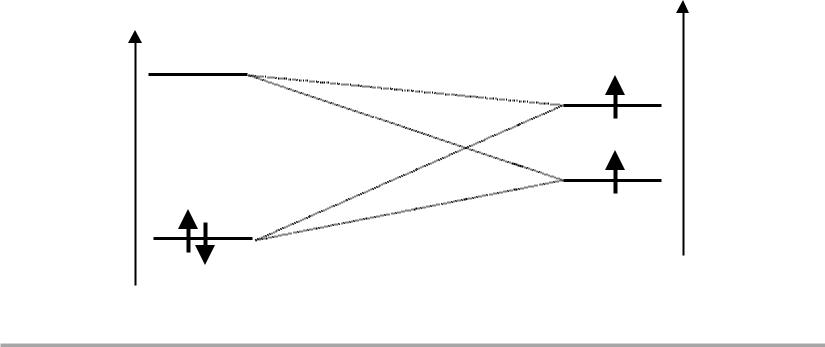
Корреляционная диаграмма
A—B |
A + B |
EМО |
EАО |
* = C21 ψa – C22 ψb |
ψa |
2 |
|
1 |
ψb |
= C11 ψa + C12 ψb
— «связывающая» ЛМО
* — «разрыхляющая» ЛМО
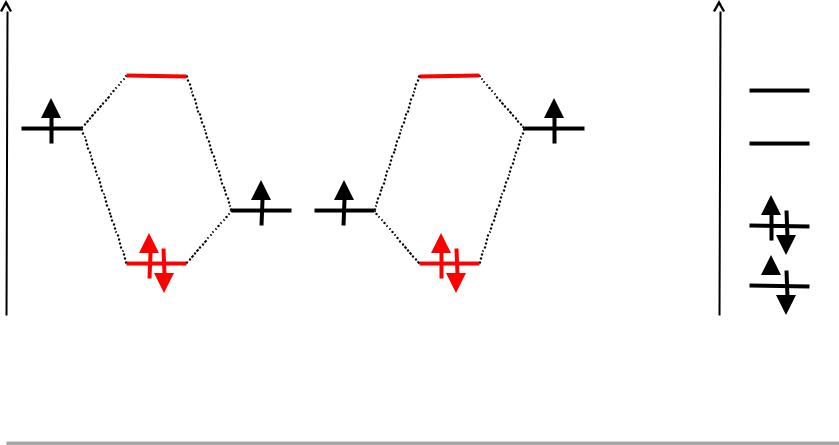
Корреляционная диаграмма молекулы Н2О
Е |
A* |
Е |
|
B* |
1sA |
1sB |
2pO |
2pO |
A |
B |
|
|
|
|||
Модель ЛМО |
Модель КМО |
||
(неправильная) |
(правильная) |
||
Группа С2v не имеет двумерных неприводимых представлений и поэтому у молекулы Н2О не может быть вырожденных по энергии состояний
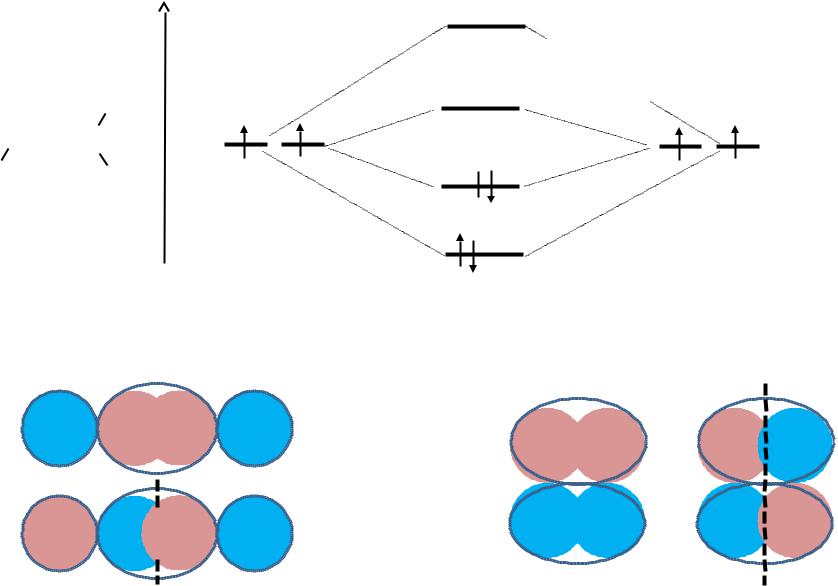
Кратные связи
E
px pz
 С
С  С
С
= (px)1 + (px)2
* = (px)1 – (px)2
–+ + –
+ –  + –
+ –
*
* 
















































 pz px
pz px

= (pz)1 + (pz)2
* = (pz)1 – (pz)2
+ |
+ |
+ |
– |
– |
– |
– |
+ |
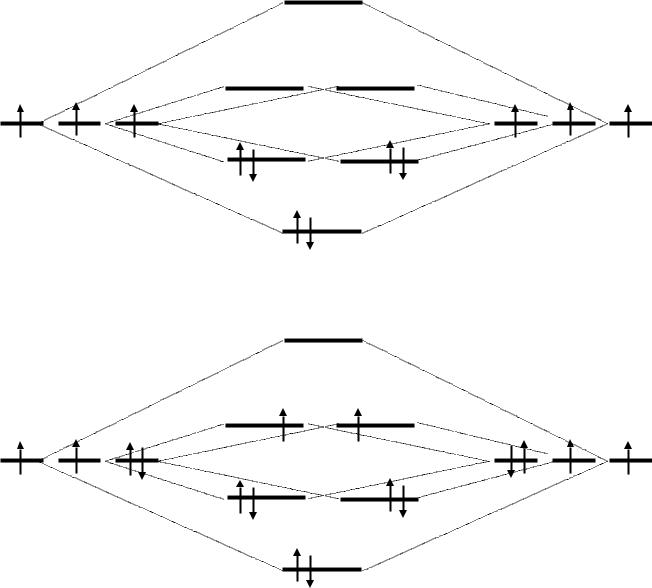
|
* |
px py pz |
pz py px |
* |
* |
N  N
N
|
|
|
|
Валентно-насыщенная молекула (все электроны спарены)
|
* |
px py pz |
pz py px |
* |
* |
O  O
O
|
|
|
|
Валентно-ненасыщенная молекула (бирадикал)
Образование канонических МО |
|
Каждая АО |
||||
1 |
|
С11 |
С12 |
… С1n |
1 |
участвует в |
|
образовании |
|||||
2 |
|
С21 |
С22 |
… С2n |
2 |
каждой МО |
… |
= |
………………. • |
… |
(атомно- |
||
молекулярная |
||||||
n |
|
Сn1 |
Сn2 |
… Сnn |
n |
матрица не |
|
содержит нулей) |
|||||
Образование локализованных МО
1 |
С |
С |
2 |
11 |
12 |
С |
С |
|
|
21 |
22 |
3 |
= |
С33 |
4 |
С43 |
|
|
|
…
… 0
n
С34
 0
0
С44 


 Сjj
Сjj



••••
12
3
• 4
…
…


 Сnn
Сnn

 n
n
Специфика образования локализованных МО
1 |
С |
С |
|
2 |
11 |
12 |
|
С |
С |
|
|
|
21 |
22 |
|
3 |
= |
С33 |
С34 |
4 |
С43 |
С44 |
|
|
|
|
…
… 0
n
0
•••• ••••••
•

 Сnn
Сnn


1. Суперпозиция АО осуществляется попарно
1 |
|
2 |
3 |
4 |
|
2. Некоторые АО не участвуют в образовании МО (например, n). Они описывают Льюисовские
«неподеленные электронные пары» и «лакуны»)
12
34
…
…
n
••
N
B
|
|
|
• |
• |
|
|
|
О |
|
• |
• |
|
|
|
|
• |
О |
• |
|
|
|
|
|
|
|
||
Н |
Н |
Н |
• |
• |
Н |
|
|
|
|
||||
Классические структурные модели с локализованными взаимодействиями
Модель ЛМО
1)согласована с классическими структурными представлениями;
2)отражает динамический характер электронов — растягивает
льюисовский «электрон-точку» в квантовомехнический «электрон- облако»;
О
Н Н
Н
Модель КМО
• |
|
• |
|
• |
|
|
|
|
• |
|
|
|
О |
|
|
• |
• |
|
|
|
|
||
Н • |
|
• |
Н |
3) допускает вычисление локальных |
|
характеристик (заряды атомов, |
Модель ЛМО |
порядки связей, ИСВ и др.). |
На основе молекулярных ЛМО-моделей химики получают возможность решения ряда важных задач:
1)обсуждать и объяснять установленные экспериментально химические свойства (реакционную способность) молекул;
2)интерпретировать классические структурные характеристики молекул с учетом движения электронов;
3)вводить и использовать новые характеристики химических атомов и связей в составе молекул, такие как:
•симметрия и узловая структура электронного облака;
•тип связи: -, -, - связи, s-s, s-p, p-p-связи и т.д.;
•частичные электрические заряды атомов;
•порядки связи;
•индексы свободной валентности;
•поляризуемости различных типов и др.

Модель ЛМО имеет два существенных недостатка
1.Модель ЛМО явным образом противоречит квантовой механике: всякий электрон в составе молекулы должен двигаться во всем ее объеме и не может быть локализован в окрестности одного или двух ядер.
2.Модель ЛМО в ряде важных случаев приводит к противоречию с опытом, что требует введения определенных поправок и дополнений в структурную модель молекулы, получаемую в рамках метода ЛМО.
Гибридизация |
Сопряжение |
АО |
ЛМО |
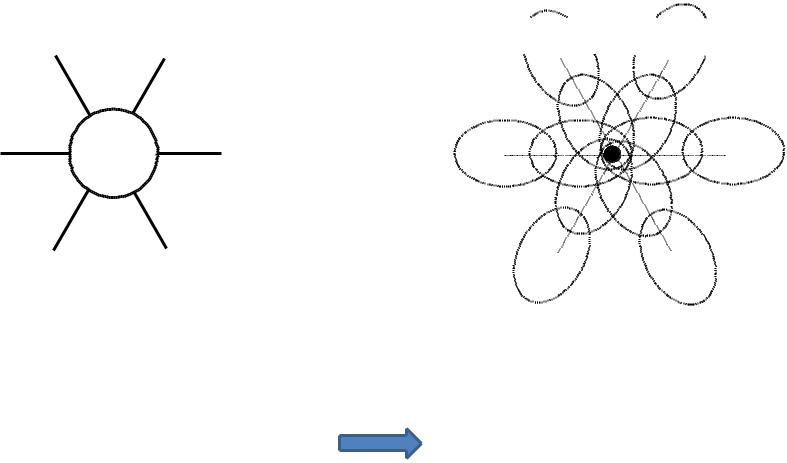
Гибридизация АО
[Ni(NH3)6]2+
L L 
 L
L 




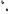






 L
L 
L |
Ni2+ |
L |
L |
L |
L |
L |
L |
L |
Классическая модель |
Модель ЛМО |
||
Шесть одинаковых |
Шесть одинаковых |
химических связей |
АО у иона никеля |
