
- •1. Теоретическая часть.
- •1.2. Работа газа а.
- •1.3. Первое начало термодинамики.
- •1.4. Теплоемкость.
- •1.5. Классическая теория теплоемкости идеального газа.
- •2. Экспериментальная часть.
- •2.1.2. Описание установки и теория метода измерения показателя адиабаты.
- •2.1.3. Измерение и обработка результатов.
- •2.1.3. Контрольные вопросы.
- •2.2. Определение скорости звука в газах и числа степеней свободы молекул.
- •2.2.1. Краткая теория.
- •2.2.2. Описание установки.
1.4. Теплоемкость.
Удельная теплоемкость вещества - величина, равная количеству теплоты, необходимому для нагревания 1 кг вещества на 1 К:
(6)
Молярная теплоемкость - величина, равная количеству теплоты, необходимому для нагревания 1 моля вещества на 1 К:
(7)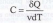
где v = m/М - количество молей вещества, М - его молярная масса, m - масса. Удельная и молярная теплоемкость вещества связаны между собой соотношением.

Так как количество теплоты δQ зависит от типа процесса, то и теплоемкость С зависит от типа процесса. Наибольшее значение имеют теплоемкости при постоянном объеме (Cv) и постоянном давлении Ср когда в процессе нагревания вещества его объем или давление поддерживаются постоянными.
Для нахождения Сv и Ср запишем выражение первого начала термодинамики (5) для 1 моля газа с учетом формулы (7) для δQ
(8)
Если газ нагревается при постоянном объеме (V=const), то dV=0 и δA=pdV=0. Тогда сообщаемая газу теплота идет только на увеличение его внутренней энергии U. В результате получаем , что
(9)
Если газ нагревается
при постоянном давлении
(p=const),
то из (8) имеем
(10)
Поскольку в идеальном газе величина внутренней энергии U определяется лишь температурой газа Т и не зависит от р и V, то, учитывая (9), первое слагаемое в (10) равно Сv. Для нахождения второго слагаемого в (10) продифференцируем по Т уравнение Клапейрона - Менделеева pV=RT при p=const. Получаем pdV=RdT. Откуда pdV/dT=R. Подставляя это выражение в (10), получаем
(12)
Выражение (12) называется уравнением Майера; оно показывает, что Ср всегда больше Cv на величину газовой постоянной R. Это объясняется тем, что при нагревании газа при постоянном давлении требуется еще дополнительное количество теплоты на совершение работы по расширению газа, так как постоянство давления обеспечивается увеличением объема газа.
1.5. Классическая теория теплоемкости идеального газа.
В случае идеального газа, у которого пренебрегается потенциальной энергией взаимодействия между молекулами, величина внутренней энергии газа U определяется только средней кинетической энергией его молекул.
Наиболее
просто находится внутренняя энергия
идеального газа, состоящего из одноатомных
молекул, для которого величина U
определяется лишь тремя составляющими
поступательной кинетической энергии
его молекул вдоль оси X, Y,
Z,
т.е. величина U
одного моля такого газа равна: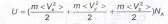
(13)
где т- масса одной молекулы, NA- число Авогадро. При хаотическом движении молекул все направления движения равновероятны, поэтому среднее значение всех трех составляющих энергии в (13) одинаково и, как доказывается в молекулярно-кинетической теории идеального газа, на каждую такую составляющую приходится энергия, равная NA-(kT/2)=RT/2. Учитывая, что у одноатомного газа число таких составляющих равно 3, введя обозначение i=3, получаем для него

(14)
На основании соотношений (14) Больцманом было введено понятие числа степеней свободы молекул i, как числа независимых переменных (координат), позволяющих полностью определить среднюю энергию теплового движения молекул благодаря гипотезе о равнораспределении энергии по степеням свободы. (Данная гипотеза затем была доказана в рамках статистической термодинамики.)
В классической механике молекула многоатомного газа в первом приближении рассматривается как совокупность материальных точек, жестко связанных недеформируемой связью. Такая многоатомная молекула в общем случае имеет 6 степеней свободы, т.к. ее движение складывается из трех поступательных и трех вращательных движений вдоль осей X, Y, Z. В случае двухатомной или многоатомной линейной молекулы вращением вокруг третьей оси, проходящей по линии соединения атомов, можно пренебречь. Поэтому для жестких молекул двухатомного газа и многоатомного газа с линейными молекулами число степеней свободы i=5.
Естественно, что жесткой связи между атомами не существует. Поэтому для реальных молекул необходимо учитывать также степени свободы колебательного движения. Колебательная степень обладает вдвое большей энергией, так как на нее приходится не только кинетическая энергия (как в случае поступательного и вращательного движений), но и потенциальная. Причем, если колебания гармонические, то средние значения кинетической и потенциальной энергий одинаковы.
В соответствии с законом Больцмана о равнораспределении энергии по степеням свободы в системе, находящейся в термодинамическом равновесии, на каждую их поступательную и вращательную степени свободы приходится в среднем кинетическая энергия, равная кТ/2, а на каждую колебательную степень свободы - кТ.
Таким образом, средняя кинетическая
энергия молекулы равна

(15)
где Г - сумма числа поступательных, числа вращательных и удвоенного числа колебательных степеней свободы молекулы:

(16)
Так как в идеальном газе взаимная потенциальная энергия молекул равна нулю (молекулы между собой не взаимодействуют), то внутренняя энергия 1 моля газа будет равна
(17)
На основании полученных выше соотношений
(9) и (12) из (17) получаем выражения для
теплоемкостей Cvи Сридеального газа в виде (18)
Причем для молекул одноатомного газа - i=3, для жестких молекул двухатомного газаi=5, а для нежестких - i=7.
Из (18) можно получить выражение, свойственного каждому газу, равное отношению Срк Сvи называемое показателем адиабаты:
Y = Cp/Cv =(i+2)/i (19)
О
г ; . 1 . . *
100 300 500 700 900 1100 TKi
Рис.
2.
Экспериментальные значения
Ср
(Дж/моль К) некоторых газов.
Пунктиром
отмечены теоретические значения
Ср
для газов из: одноатомных молекул
5R/2=20,8
Дж/моль К; жестких двухатомных молекул
7R/2=29,12
Дж/моль К и жестких многоатомных
молекул, 8R/2=33,3
Дж/мольК
Это можно объяснить, предположив, что, при низких температурах у водорода возбуждается только поступательное движение его молекул, при комнатных - добавляется их вращение, и лишь при очень высоких добавляются колебания молекул.
Согласно проведенному на рис. 2 сопоставлению экспериментальных и теоретических значений Срнекоторых газов, для таких газов, как аргон, водород и азот, при температурах порядка 200К - 700К вполне допустимо использование при расчетах теоретических значений Ср. Однако даже для газа метана СН4со сферически симметричной молекулой наблюдается настолько сильная температурная зависимость Ср, что классическая теория теплоемкости оказывается несправедлива почти во всем диапазоне температур. Еще более сильное отличие теоретических и экспериментальных значений наблюдается у паров спиртов (метанола, этанола и др.). Таким образом, точное вычисление теплоемкости многоатомных молекулярных систем при различных температурах в рамках классической теории осуществить невозможно.
