
- •1. Теоретическая часть.
- •1.2. Работа газа а.
- •1.3. Первое начало термодинамики.
- •1.4. Теплоемкость.
- •1.5. Классическая теория теплоемкости идеального газа.
- •2. Экспериментальная часть.
- •2.1.2. Описание установки и теория метода измерения показателя адиабаты.
- •2.1.3. Измерение и обработка результатов.
- •2.1.3. Контрольные вопросы.
- •2.2. Определение скорости звука в газах и числа степеней свободы молекул.
- •2.2.1. Краткая теория.
- •2.2.2. Описание установки.
ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
К ЛАБОРАТОРНЫМ РАБОТАМ
ПО МОЛЕКУЛЯРНОЙ ФИЗИКЕ
ДЛЯ СТУДЕНТОВ ОДО
СПЕЦИАЛЬНОСТИ «ФИЗИКА», «ТЕПЛОФИЗИКА»
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ
Федеральное агентство по образованию Государственное образовательное учреждение высшего профессионального образования «Тюменский государственный университет»
Физический факультет
Кафедра механики многофазных систем
ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ
Методические указания к лабораторным работам по молекулярной физике для студентов ОДО Специальности «Физика», «Теплофизика».
Издательство Тюменского государственного университета 2006
Методические указания печатаются по решению Учебно-методической комиссии факультета.
Первое начало термодинамики
Методические указания к лабораторным работам по молекулярной
физике для студентов ОДО Специальности «Физика»,
«Теплофизика»
Авторы: Семихйна Людмила Петровна к. ф.-м. н„ доцент,
Семихин Виталий Иванович, к. ф.-м. н., доцент,
Ширшова Альбина Вольфовна, к. ф.-м. н., доцент.
Матаев Александр Сергеевич, к.ф.-м. н., ст. преп.
Рецензенты: С.П. Родионов, д.ф.-м.н., М.Я. Флягин, к.ф.-м.н., доцент
Ответственный за выпуск: А.Б. Шабаров.
Краткая аннотация: методические указания предназначены для проведения лабораторных работ по молекулярной физике студентами, обучающимися по специальностям «Физика» и «Теплофизика». Они состоят из теоретической части, включающей основные понятия, соотношения первого начала термодинамики и экспериментальной части, состоящей из описания экспериментальных установок к двум лабораторным работам, контрольных вопросов и литературы.
Методические указания рассмотрены и одобрены на заседании кафедры Механики многофазных систем. Протокол № 4 от 5.12.2005 года.
Зав. Кафедрой А.Б.Шабаров
1. Теоретическая часть.
Введение. Термодинамика - наука о наиболее общих свойствах макроскопических систем, находящихся в состоянии термодинамического равновесия, и о процессах перехода между этими состояниями. Термодинамика строится на основе фундаментальных принципов (начал), которые являются обобщением многочисленных экспериментальных исследований и выполняются независимо от конкретной природы образующих систему тел. Поэтому термодинамика имеет универсальный характер.
Одним из основных параметров в термодинамике является температура. То, что необходимым условием термодинамического равновесия любой системы является равенство температуры во всех ее частях, часто называют нулевым началом термодинамики.
Первое начало термодинамикиявляется обобщением закона сохранения энергии на молекулярные системы, которым свойственны специфические формы энергии: внутренняя энергияUи теплотаQ.
1.2. Внутренняя энергия U.
Важной характеристикой термодинамической системы является ее внутренняя энергия U,равная сумме кинетических энергий хаотического теплового движения микрочастиц системы и потенциальной энергии взаимодействия этих частиц. Из этого определения следует, что к внутренней энергии не относятся кинетическая энергия движения системы как целого и потенциальная энергия системы во внешних полях.
Внутренняя энергия - однозначная функция термодинамического состояниясистемы, т.е. в каждом состоянии
система обладает вполне определенной внутренней энергией, не зависящей от того, как система пришла в данное состояние. Это означает, что при переходе системы из состояния 1 в состояние 2 изменение внутренней энергии ΔUопределяется только разностью значений внутренней энергии в этих состояниях и не зависит от пути перехода, т.е. ΔU=U2-U1. Математически это означает, что для внутренней энергииUимеем право записать полный дифференциал -dU. Именно поэтому на основании правил интегрирования получаем, что2
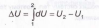
1.2. Работа газа а.
Рассмотрим газ, находящийся под поршнем в цилиндрическом сосуде с площадью сечения S. РаботаА, которую совершает газ при перемещении поршня на расстояниеdx, находится как работа переменной силыF=pS:
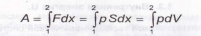
(2)

где p- давление газа, dV-Sdx -изменение объема газа. В отличие от внутренней энергииU, работа газа А при переходе его из состояния 1 в состояние 2 определяетсяи типом процесса, с помощью которого осуществлен этот переход.
Это можно показать, если сопоставить работу газа при переходе его из состояния 1 в состояние 2 с помощью двух разных процессов, например, по участку 1->а->2 и 1->Ь->2 на рис. 1. Из данного факта следует, что для работы газа нельзя записать соотношения, аналогичного (1), т.к. она не является функцией состояния системы. Математически это означает, что элементарная работа газа является не

1.3. Первое начало термодинамики.
Вдвигая поршень в цилиндр, в котором находится газ, мы сжимаем этот газ, в результате чего повышается его температура и внутренняя энергия газа. С другой стороны, температуру газа и его внутреннюю энергию можно увеличить за счет сообщения ему некоторого количества теплоты Q-специфической формы энергии, которой обмениваются контактирующие молекулярные системы, в результате чего их температуры выравниваются.
Таким образом, можно говорить о двух принципиально разных формах передачи энергии от одних тел к другим: работе и теплоте.Причем механическая энергия может превращаться в тепловую, и наоборот. При этих превращениях соблюдается закон сохранения и превращения энергии. Первое начало термодинамики и постулирует такой закон применительно к термодинамическим процессам.
Допустим, что некоторая система, обладая внутренней энергией U1,' получила некоторое количество теплотыQи, перейдя в новое состояние с внутренней энергиейU2, совершила работу А противвнешних сил. (Условились считать, что Q>0, когда тепло подводится к системе. При А>0 -система совершает работу против внешних сил, если же А<0, то работа совершается внешними силами над системой.) Опыт показывает, что в соответствии с законом сохранения энергии при любом способе перехода системы из состояния 1 в состояние 2 изменение внутренней энергии ΔU равно разности между количеством теплоты Q, полученным системой, и работой А, совершенной системой против внешних сил, т.е.
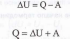
(3)
или
(4)
В дифференциальной форме выражение (4) имеет вид

(5)
Уравнения (4-5) являются интегральной и дифференциальной записью первого начала термодинамики: теплота, сообщаемая системе, расходуется на изменение ее внутренней энергии и на совершение ею работы против внешних сил.
Из уравнения (5) следует, что если работа определяется типом процесса, то и теплота также должна зависеть от типа процесса. Т.е. малое количество теплоты, как и элементарная работа δА, является функционалом - δQ.
