
ТЮМЕНСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
КАФЕДРА МОЛЕКУЛЯРНОЙ ФИЗИКИ
ОПРЕДЕЛЕНИЕ КРИТИЧЕСКОЙ ТЕМПЕРАТУРЫ
ОПРЕДЕЛЕНИЕ КРИТИЧЕСКОЙ ТЕМПЕРАТУРЫ
I.Краткая теория
§ 1.Реальные газы.
Уравнение состояния Клапейрона - Менделеева достаточно хорошо описывает известные из опытов свойства газов. Однако, оно является приближённым и оказывается справедливым только при достаточно малых давлениях. Кроме того опыт показывает, что при определенных значениях давления и температуры газы конденсируется, т.е. приходят в жидкое состояние. Уравнение Клапейрона - Менделеева это явление не описывает. Изотерма для реального газа при этом имеет характерный вид (рис. 1).

Рассмотрим процесс,
соответствующий этому графику, проведённый
в направлении ABCD.
Часть изотермы AB
описывает процесс сжатия газа до начала
конденсации. Она достаточно хорошо
может совпадать
с
изотермой,
рассчитанной
по
уравнению
Клапейрона-Менделеева
(изображена
пунктиром).
Однако
в
процессе,
проведённом
с
реальным
веществом
при
определенном
давлении
начнётся
конденсация
(точка
B
на
графике). Это
давление
называют
давлением
насыщенных
паров
или
просто
давлением насыщения
![]() .
.
Часть
графика
BC
описывает
двухфазное
состояние
вещества.
При
уменьшении
объема
от
![]() до
до
![]() все
большая
доля
вещества
переходит из
парообразного
состояния
в
жидкое.
Точка
C
изображает
состояние,
когда всё
вещество
превратилось
в
жидкость.
Наконец,
CD
описывает
процесс
сжатия жидкости,
график
идет
почти
параллельно
вертикальной
оси,
отражая
известный факт:
жидкости
имеют
гораздо
меньшую сжимаемость,
чем
газы.
все
большая
доля
вещества
переходит из
парообразного
состояния
в
жидкое.
Точка
C
изображает
состояние,
когда всё
вещество
превратилось
в
жидкость.
Наконец,
CD
описывает
процесс
сжатия жидкости,
график
идет
почти
параллельно
вертикальной
оси,
отражая
известный факт:
жидкости
имеют
гораздо
меньшую сжимаемость,
чем
газы.
Если проводить подобные изотермические процессы с одним и тем же количеством вещества при различных температурах, мы получим систему изотерм, изображенную на рис.2.
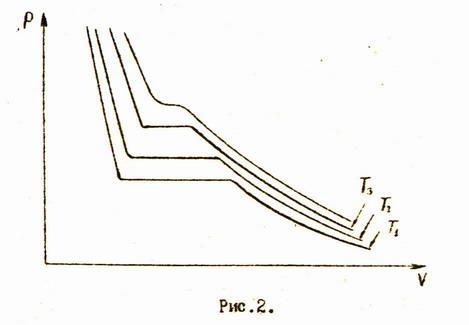
Кривые, соответствующие более высоким температурам, располагаются дальше от начала координат. С повышением температуры горизонтальные части изотерм, описывающие двухфазное состояние, уменьшаются и при некоторой температуре вырождаются в одну единственную точку. Эта температура называется критической.
При температуре выше критической нельзя получить вещество в двухфазном состоянии.
§ 2. Уравнение Ван-дер-Ваальса. Изотермы Ван-дер-Ваальса.
Уравнение состояния идеального газа при больших плотностях не может дать хорошего совпадения с экспериментом, поскольку при eгo написании предполагалось, что молекулы не имеют размеров и не взаимодействуют между собой. Чтобы получить уравнение состояния, удовлетворительно описывающее свойства реальных газов, надо учесть размеры молекул или силы отталкивания, возникающие между молекулами, находящимися на малых расстояниях друг от друга. Кроме того, надо учесть также и силы притяжения между молекулами.
Можно взять за основу уравнение состояния Клапейрона - Менделеева и внести в него соответствующие поправки. Учёт сил отталкивания или размеров молекул произведем, введя поправку к объёму в уравнении Клапейрона - Менделеева для одного киломоля газа
![]() (1)
(1)
или
![]() (2)
(2)
Из
второго
выражения
видно,
что
при
![]() давление
стремится
к
бесконечности,
т.е.
нельзя
сжать
вещество
до
объёма,
равного
нулю.
давление
стремится
к
бесконечности,
т.е.
нельзя
сжать
вещество
до
объёма,
равного
нулю.
При сравнительно больших расстояниях между молекулами существенную роль играют силы притяжения. Их можно учесть, введя соответствующую поправку к давлению в уравнении (2):
![]() (3)
(3)
Эту поправку необходимо взять с отрицательным знаком, полагая, что притяжение молекул приводит к уменьшению давления на стенки содержащего данный газ сосуда. Уравнение (3) можно преобразовать так:
![]() (4)
(4)
Это и есть уравнение состояния реальных газов, впервые полученное Ван-дер-Ваальсом. Можно записать его для произвольного количества вещества:
![]() (5)
(5)
где
![]() относительная
молекулярная
масса.
относительная
молекулярная
масса.
Уравнение (4) можно представить в виде степенного ряда по объему:
![]() (6)
(6)
При
фиксированных
давлении
и
температуре
оно
будет
являться
уравнении
третьей
степени
относительно
объема
![]() и
должно
иметь три
корня.
Наиболее
интересные
результаты
получаются
при
анализе
изотерм
Ван-дер-Ваальса,
одна
на
которых
изображена,
на
рис.3.
и
должно
иметь три
корня.
Наиболее
интересные
результаты
получаются
при
анализе
изотерм
Ван-дер-Ваальса,
одна
на
которых
изображена,
на
рис.3.

При
фиксированной
температуре
каждому
значению
давление
будут
соответствовать
три
корня
уравнении
(6).
Давлению
![]() соответствуют
три
вещественных
корня
соответствуют
три
вещественных
корня
![]() ,
,
![]() ,
,
![]() .
Давлениям
.
Давлениям
![]() и
и
![]() соответствуют
один
вещественный
корень
и
два
комплексно
сопряжённых
корня,
которые
физического
смысла
не
имеют
и
в
дальнейшем
рассматриваться
не
будут.
соответствуют
один
вещественный
корень
и
два
комплексно
сопряжённых
корня,
которые
физического
смысла
не
имеют
и
в
дальнейшем
рассматриваться
не
будут.
Интересно сопоставить изотерму Ван-дер-Ваальса и опытную изотерму. На рис.3 горизонтальный участок опытной изотермы изображен прямой BF. Часть AB описывает газообразное состояние вещества и удовлетворительно совпадает с опытной изотермой. Часть FG описывает изотермическое сжатие жидкости. Таким образом, уравнение Ван-дер-Ваальса сравнительно неплохо описывает поведение вещества в газообразном и жидком состояниях при изотермическом процессе.
Существенно изотермы отличаются на участке BF . Однако ветви BC и EF имеют определённый физический смысл. Состояния вещества, изображаемые участком BC, могут быть экспериментально получены. Это - пересыщенный или переохлаждённый пар. Состояния вещества, соответствующие участку EF также наблюдаются на опыте. Жидкость в таких состояниях называется перегретой. Эти состояния называют метастабильными. Часть изотермы Ван-дер-Ваальса CDE в опытах никогда не наблюдается. Она описывает нестабильное состояние вещества.
