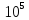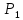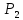- •Тема 1. Второй закон термодинамики.
- •94. Определите изменение энтропии для реакции
- •Решение.
- •Решение.
- •121. Рассчитайте давления, при которых графит и алмаз находятся в равновесии для интервала температур 298—4000 к. При расчете используйте следующие данные для равновесия с (графит) с (алмаз):
- •Решение.
- •Решение.
- •Многовариантные задачи
- •Решение.
- •Тема 2. Характеристические функции
- •Решение:
- •Решение.
- •Решение.
- •Решение.
Тема 2. Характеристические функции
1. Определить изменение энтропии и изобарно-изотермического потенциала при стандартных условиях для реакции:
Fe304
+ СО = ЗFeО
+ С02
если
стандартные энтропии FeO,CO2,
Fe304
СО соответственно равны: 58,79; 213,6;
151,46; 197,4 Дж/моль К,
а стандартные величины
К,
а стандартные величины
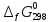 равны: -216,0; -394,89; -1010; -137,4 кДж/моль. Возможен
ли данный процесс при стандартных
условиях?
равны: -216,0; -394,89; -1010; -137,4 кДж/моль. Возможен
ли данный процесс при стандартных
условиях?
Решение.
Вычисляем
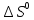 реакции
реакции
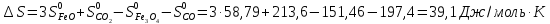
Вычисляем
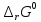 реакции:
реакции:
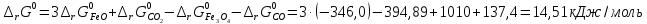
Так как
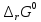 >
0, то при стандартных условиях данный
процесс невозможен.
>
0, то при стандартных условиях данный
процесс невозможен.
Ответ:
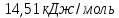
2. Определите
изменение изобарно-изотермического
потенциала для реакции Ni
+ 2Н2О(Ж)
=
NH4NO2
и дайте заключение о возможности ее
протекания при стандартных условиях,
если
 G°(H20(ж))=
-237,5 кДж/моль и
G°(H20(ж))=
-237,5 кДж/моль и
 G°(NH4N02)=+115,94
кДж/моль.
G°(NH4N02)=+115,94
кДж/моль.
Решение.
 G°=
G°= G°(NH4N02)-
G°(NH4N02)- G°(H20(ж))=115,94-2(237,5)=590,94
кДж/моль
G°(H20(ж))=115,94-2(237,5)=590,94
кДж/моль
Ответ: 590,94 кДж/моль
3.
Вычислите
стандартное изменение изобарного
потенциала Δ для
реакции хлорирования метана СН4
+ Сl2
= СНзС1(г)
+ НС1, используя табличные значения ΔН
и ΔS
для всех веществ, участвующих в данной
реакции.
для
реакции хлорирования метана СН4
+ Сl2
= СНзС1(г)
+ НС1, используя табличные значения ΔН
и ΔS
для всех веществ, участвующих в данной
реакции.
Решение.
Δ
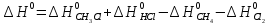
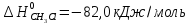



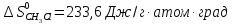
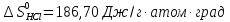

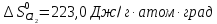
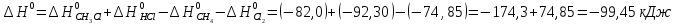
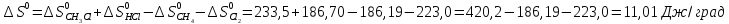
Δ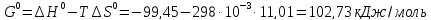
Ответ: -102,73 кДж/моль
4. Вычислите стандартное изменение изобарного потенциала язя реакции горения ацетона СНз-СО-СНз(г), + 402= ЗСО2 + ЗН2Ож). Необходимые величины энтальпии и энтропии реагирующих веществ возьмите из справочника.
Решение.
Δ
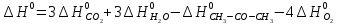

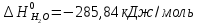


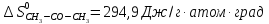


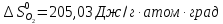
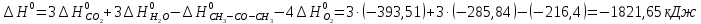
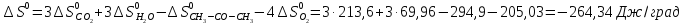
Δ
Ответ: -1742,9 кДж/моль
5. Выясните возможность получения металлического кадмия из сульфида кадмия (II) восстановлением оксидом углерода (II) по реакции:
2CdS (кр.)
+2СO
(г.)=CO2
(г.)+СS2
(г.)+2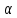 Сd
Сd
Решение.
для СO2
(г.)-
 кДж/моль
кДж/моль
для CS2
(г.)-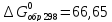 кДж/моль
кДж/моль
для
 -
-
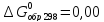 кДж/моль
кДж/моль
для CdS
(кр.)-
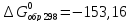 кДж/моль
кДж/моль
для СO
(г.)-
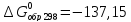 кДж/моль
кДж/моль
Воспользовавшись следствием из закона Гесса, получаем:
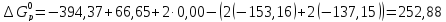 кДж/моль
кДж/моль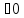
Таким образом, данная реакция при нормальных условиях самопроизвольно протекать не может.
Ответ: реакция протекать не может.
6. Установлено,
что химические процессы, для которых
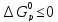 ,
можно использовать в химической
технологии. Определите температурные
границы технологического использования
реакции:
,
можно использовать в химической
технологии. Определите температурные
границы технологического использования
реакции:
C2H6 (г.)=С2H4 (г.)+H2 (г.)
Решение.
По данным задачи требуется определить выполнение условия:
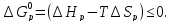
Значения
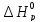 и
и
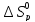 определим, воспользовавшись следствиями
из закона Гесса. Находим:
определим, воспользовавшись следствиями
из закона Гесса. Находим:
для C2H6
(г.) -
 кДж/моль;
кДж/моль;
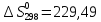 Дж/моль ∙К;
Дж/моль ∙К;
для С2H4
(г.) -
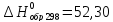 кДж/моль;
кДж/моль;
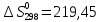 Дж/моль ∙К;
Дж/моль ∙К;
для H2
(г.) -
 кДж/моль;
кДж/моль;
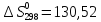 Дж/моль ∙К
Дж/моль ∙К
Далее, воспользовавшись
ранее выведенным выражением, получаем:
T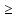 136,97
136,97 /
120,48=1137 K=868
/
120,48=1137 K=868

Ответ:
868
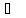
7. Пользуясь
зависимостью:
 (Дж/моль)
(Дж/моль)
Справедливой для неполярных веществ, и принимая пар за идеальный газ, рассчитайте теплоту, работу и изменения энтропии, энтальпии и внутренней энергии при испарении 1 моль нижеприведенных веществ при нормальном давлении:
а) изопрен,
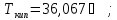 б) бензол,
б) бензол,
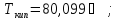 в) циклогексан,
в) циклогексан,
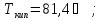 г) гексан,
г) гексан,
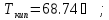 д)
стирол,
д)
стирол,
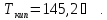
Решение.
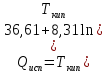 Дж/моль
Дж/моль
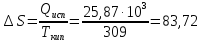 Дж/К
Дж/К
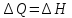

25,87=x+1∙8,314∙309∙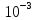
X=23,3
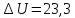 кДж
кДж
A=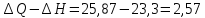 кДж
кДж
Ответ: для а) 25,87 кДж; 2,55 кДж; 84,21 Дж/К; 25,87 кДж; 23,32 кДж.
8. Рассчитайте ΔG, если температура кипения 351 К для процессов:
C2H6O (ж, Р=1,01∙105Па)= C2H6O (г, Р=9,09∙104Па),
C2H6O (ж, Р=1,01∙105Па)= C2H6O (г, Р=1,01∙105Па),
C2H6O (ж, Р=1,01∙105Па)= C2H6O (г, Р=1,11∙105Па).
Решение.
ΔG1=RKlnp2/p1=8,314∙351n9,09∙104/1,01∙105=-307,46Дж/моль
ΔG2=8,314∙351ln1=0
ΔG3=8,314∙351ln1,11∙105/1,01∙105=275,5 Дж/моль
Ответ: -307,46Дж/моль, 0, 275,5 Дж/моль
9. Вычислить изменение изобарного потенциала для процесса перехода 1 моль жидкого бензола при температуре кипения 80,1°С и давлении P1 в газообразный при Р2 и обратно для трех случаев: 1) P1 = 1,013∙105 н/м2 и Р2=9,11∙104 н/м2; 2) P1=1,013∙105 н/м2 и Р2 = 1,013∙105 н/м2; 3) Р1 = 101,3∙105 н/м2 и Р2= 1,114∙105 н/м2.
Решение.
1)
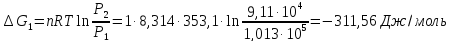
2)
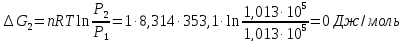
3)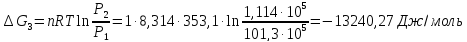
Ответ:
-311,56;0;-13240,27
10-15. Найти изменение изобарного потенциала при сжатии 1 моль указанной жидкости от P1 до Р2 при 0°С. Сжимаемостью жидкости в указанном интервале давлений пренебречь.
|
Номер Задачи |
Жидкость |
Плотность г/см3 |
Давление,
н/м2∙ |
|
|
|
|
|||
|
10 |
Четырёххлористый Углерод |
1,633 |
1,013 |
10,13 |
|
11 |
Анилин |
1,039 |
0,506 |
4,05 |
|
12 |
Нитробензол |
1,223 |
1,013 |
6,078 |
|
13 |
Хлорбензол |
1,128 |
1,216 |
9,72 |
|
14 |
Хлороформ |
1,526 |
1,013 |
8,10 |
|
15 |
Бензол |
0,879 |
1,013 |
5,065 |