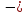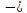- •Тема 1. Второй закон термодинамики.
- •94. Определите изменение энтропии для реакции
- •Решение.
- •Решение.
- •121. Рассчитайте давления, при которых графит и алмаз находятся в равновесии для интервала температур 298—4000 к. При расчете используйте следующие данные для равновесия с (графит) с (алмаз):
- •Решение.
- •Решение.
- •Многовариантные задачи
- •Решение.
- •Тема 2. Характеристические функции
- •Решение:
- •Решение.
- •Решение.
- •Решение.
121. Рассчитайте давления, при которых графит и алмаз находятся в равновесии для интервала температур 298—4000 к. При расчете используйте следующие данные для равновесия с (графит) с (алмаз):
|
T,K |
|
|
|
|
|
|
||
|
298 1400 |
18 967,3
|
—3,364 —4,853 |
2903,7
|
2,602 0.418 |
|
—1,92 —1.90 |
||
Решение.
Отрицательные
значения
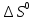 и
и
 V
показывают,
что изменение температуры не
благоприятствует, а повышение давления
благоприятствует превращению графита
в алмаз. Для расчета равновесных
давлений при высоких температурах
используем зависимость
V
показывают,
что изменение температуры не
благоприятствует, а повышение давления
благоприятствует превращению графита
в алмаз. Для расчета равновесных
давлений при высоких температурах
используем зависимость
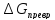 = f(Р,
Т). Для этого
представим
= f(Р,
Т). Для этого
представим
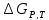 как сумму трех слагаемых :
как сумму трех слагаемых :
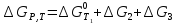
Где
 —
изменение энергии Гиббса при переходе
графита в алмаз при 1,0133
—
изменение энергии Гиббса при переходе
графита в алмаз при 1,0133 106
Па и температуре T1;
106
Па и температуре T1; —
изменение
—
изменение
 за счет повышения температуры от T1
до Т2
при 1,0133
за счет повышения температуры от T1
до Т2
при 1,0133 105
Па;
105
Па;
 —
изменение
—
изменение
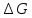 за счет повышения давления от 1,0133
за счет повышения давления от 1,0133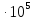 Па до Р при
Т =T2.
Приведенные
данные относятся к Т
Па до Р при
Т =T2.
Приведенные
данные относятся к Т
 1400 К, поэтому принимаемT1=1400
К и вычисляем
1400 К, поэтому принимаемT1=1400
К и вычисляем
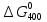 .
Для этого используем уравнение (VII.
21);
.
Для этого используем уравнение (VII.
21);
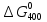 =
= ,
,
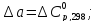 М=0,7595
М=0,7595
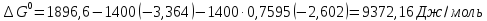
Значение
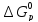 вычисляем по
уравнению (VII.25),
допустив, что
вычисляем по
уравнению (VII.25),
допустив, что
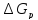 =
= Тогда
Тогда
 =
(
=
(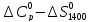 )
(T-1400)-
)
(T-1400)-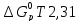 lg
(T/1400).
lg
(T/1400).
Значение
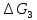 вычисляем по» уравнению (VII.31),
приняв
вычисляем по» уравнению (VII.31),
приняв
 V
= = const
=
V
= = const
=
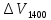 .
Тогда
.
Тогда =
=
 V(P
— I)
V(P
— I)
 1,0133
1,0133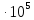 и зависимость
и зависимость
 G
= f
(P,
T)
принимает вид
G
= f
(P,
T)
принимает вид
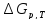 =
=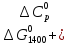 -
-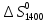 )(T-1400)-
)(T-1400)-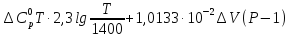
После подстановки чисел получаем
 =9372,16 + 4,435 (T—1400)+
0,962 T
lg
=9372,16 + 4,435 (T—1400)+
0,962 T
lg 19,20
19,20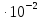 Р.
Р.
При равновесии
 ; это условие используется для расчета
равновесного давления Р.
Объединим
результаты расчета
; это условие используется для расчета
равновесного давления Р.
Объединим
результаты расчета
 и Р:
и Р:
T, К ...... 298 1400 2400 3400 4000
 ,
Дж
.... 2903,7
9372.2 14346.9 19501,6 22656,4
,
Дж
.... 2903,7
9372.2 14346.9 19501,6 22656,4
P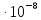 ,Па
…… 15.3 49.35 75.7 102,90
119,57
,Па
…… 15.3 49.35 75.7 102,90
119,57
Таким образом, алмаз более устойчив, чем графит, в области низ ких температур и высоких давлений.
122.
2 моля идеального одноатомного газа при
начальном давлении 1 атм и
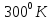 были
проведены через следующий цикл, все
стадии которого обратимы: изотермическое
сжатие до 2 атм ( I
); изобарическое нагревание до
были
проведены через следующий цикл, все
стадии которого обратимы: изотермическое
сжатие до 2 атм ( I
); изобарическое нагревание до
 ( II
), возвращение в начальное состояние по
пути
( II
), возвращение в начальное состояние по
пути
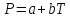 (a
и b
- постоянные) ( III
). Изобразите цикл на диаграмме P
– T
и вычислите
(a
и b
- постоянные) ( III
). Изобразите цикл на диаграмме P
– T
и вычислите
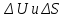 рабочего тела для каждой стадии цикла.
рабочего тела для каждой стадии цикла.
Решение.
Процесс представлен на рисунке:
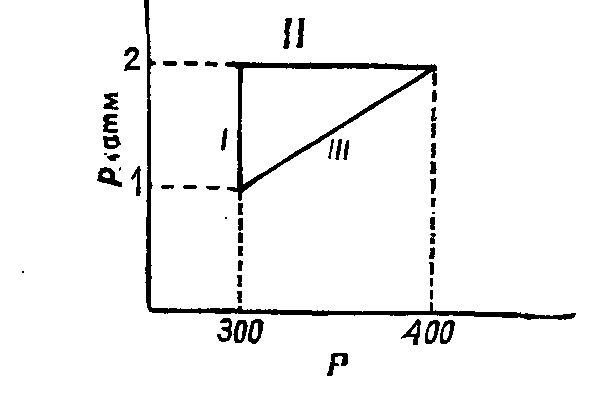
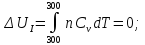
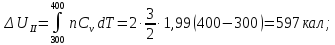
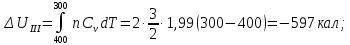
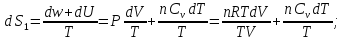
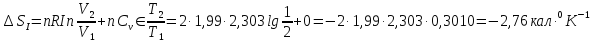
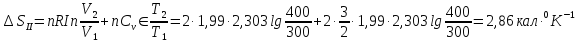

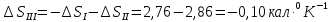
Ответ: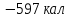 ;
;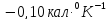
123.
1 г жидкой воды при 100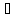 и исходном давлении 1 атм. ограничен
объёмом, в котором отсутствует пар.
Затем был открыт клапан и вода испарилась
в эвакуированное пространство, причём
конечное давление равно 0,10 атм. Вся
аппаратура находилась в тепловом
резервуаре при 100
и исходном давлении 1 атм. ограничен
объёмом, в котором отсутствует пар.
Затем был открыт клапан и вода испарилась
в эвакуированное пространство, причём
конечное давление равно 0,10 атм. Вся
аппаратура находилась в тепловом
резервуаре при 100 .
.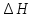 испарения воды при 100
испарения воды при 100 .
Составляет 540
.
Составляет 540
 .
Примите, что пар является идеальным
газом и что объём жидкости незначителен
в сравнении с объёмом пара. Найдите q
и
.
Примите, что пар является идеальным
газом и что объём жидкости незначителен
в сравнении с объёмом пара. Найдите q
и
 для а) воды; б) резервуара; в) и всей
системы; г) опишите обратимый процесс,
в котором вода может быть приведена к
тому же конечному состоянию. Покажите,
почему конечное состояние системы после
обратимого процесса будет отличаться
от неё состояния после действительно
проведенного процесса.
для а) воды; б) резервуара; в) и всей
системы; г) опишите обратимый процесс,
в котором вода может быть приведена к
тому же конечному состоянию. Покажите,
почему конечное состояние системы после
обратимого процесса будет отличаться
от неё состояния после действительно
проведенного процесса.
Решение.
а) При постоянном общем объёме
W=0; q=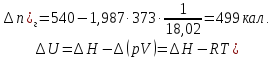
Для нахождения
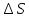 проведём двухстадийный процесс, в
котором исходное и конечное состояние
воды будет таким же, как и в данном
процессе.
проведём двухстадийный процесс, в
котором исходное и конечное состояние
воды будет таким же, как и в данном
процессе.
Испарение газа при 1 атм. :

Расширение от 1 до 0,10 атм.:
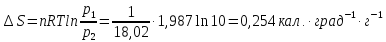
Общее:
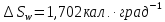
б)
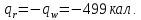

(Для резервуара w=0
и
 .
Изменение состояния источника,
определяемое только его энергией, будет
тем же самым, независимого от того, будет
теплота отводиться от него обратимо
или необратимо. Поэтому
.
Изменение состояния источника,
определяемое только его энергией, будет
тем же самым, независимого от того, будет
теплота отводиться от него обратимо
или необратимо. Поэтому
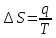 , даже если описываемый процесс необратим.)
, даже если описываемый процесс необратим.)
В)
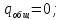
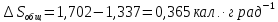
г) Вода испаряется
обратимо при давлении 1 атм. Вода
испаряется обратимо против внешнего
давления, равного собственному давлению
пара. Оба этапа проводятся изотермически
при 100
В обратимом процессе испарение и расширение воды производит работу. Эта работа, сохранившись в окружающей среде, будет доступна, если потребуется, в обратном процессе. В необратимом процессе вода не будет производить работы и возможность получения работы от неё будет потеряна. Следовательно, в необратимом процессе от резервуара отводится меньше тепла.
Ответ:
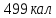 ;
;
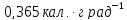
124. При
начальной температуре 373 К 1 моль кислорода
совершает цикл в идеальной машине Карно.
Сначала он расширяется изотермически
до двукратного объёма, затем расширяется
адиабатически до трёхкратного объёма
(по сравнению с первоначальным), затем
сжимается изотермически до такого
объёма, чтобы в результате последующего
адиабатического сжатия вернуться к
первоначальному состоянию. Приняв
 , рассчитайте работу, совершенную газом
в каждом части цикла; работу, произведенную
за счёт теплоты в цикле, и КПД цикла.
, рассчитайте работу, совершенную газом
в каждом части цикла; работу, произведенную
за счёт теплоты в цикле, и КПД цикла.
Решение.
1. Для первой стадии цикла – изотермического процесса- работу определяем по уравнению
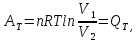
откуда

2. Для второй стадии цикла- адиабатического процесса- работу определяем по уравнению
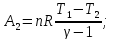
Температуру
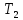 определяем по уравнению
определяем по уравнению
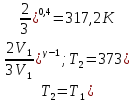
Следовательно,
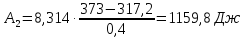
3.
Для третьей стадии цикла работа будет
отрицательна, так как происходит сжатие
газа
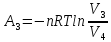 ,
где по условию
,
где по условию
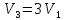 ,
а объём
,
а объём
 должен быть получен согласно указанию
о том, что после адиабатического сжатия
газ должен вернуться в исходное состояние,
следовательно, должно выполняться
равенство
должен быть получен согласно указанию
о том, что после адиабатического сжатия
газ должен вернуться в исходное состояние,
следовательно, должно выполняться
равенство
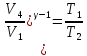
Откуда,
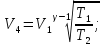
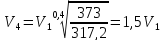
Таким образом,
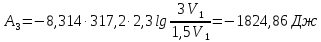
4. Для четвертой стадии цикла работа адиабатического процесса будет отрицательна и численно равна работе во второй стадии, так как в результате адиабатического расширения газ возвращается к первоначальной температуре:
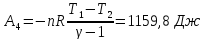
Суммарная работа
за весь цикл
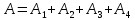 будет равна
будет равна
A=2146,06-1824,86=321,2 Дж
КПД цикла: ɳ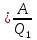 ,
где
,
где
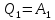 ;
;

К этому же результату придём, если определим ɳ из равенства
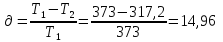
Ответ: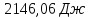 ;
; ;
;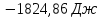 ;
321,2 Дж;
;
321,2 Дж;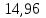
125.
Для реакции Ag+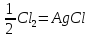 вычислите теплоту обратимого процесса.
Сведя данные справочника и результаты
вычислений в таблицу, покажите что
вычислите теплоту обратимого процесса.
Сведя данные справочника и результаты
вычислений в таблицу, покажите что
 и
и
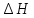 не зависят от пути процесса, а
не зависят от пути процесса, а
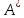 и количество выделяющейся теплоты Q
зависят. Максимальная полезная
и количество выделяющейся теплоты Q
зависят. Максимальная полезная
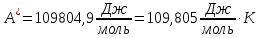
Решение.
Согласно уравнению
(VII.
6) Qобр=TΔS;
используя справочные данные, получаем

Qобр=-57,91∙298=17,263 Дж/моль.
Объединив уравнения
(VII.
37) и (VII.
6), (VII,16),
для р и Т=const
получим
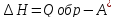 .
Подставим числа, находим
.
Подставим числа, находим
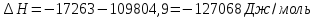
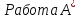 необратимого процесса
равна нулю. Составим таблицу
необратимого процесса
равна нулю. Составим таблицу

Из приведенных
данных видно, что работа
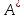 и теплота Q,
выделяющаяся в ходе реакции, зависят
от условий проведения реакции, а изменение
энтальпии не зависит.
и теплота Q,
выделяющаяся в ходе реакции, зависят
от условий проведения реакции, а изменение
энтальпии не зависит.
Ответ:
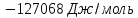
126. 200г олова [теплоемкость 6,1 кал ·(г∙атом)-1] с исходной температурой 1000С и 100г воды (теплоемкость 18 кал·моль-1) с исходной температурой 250С погружены вместе в калориметр. Приняв, что теплоемкость постоянна и что тепло не было потеряно или получено от окружающей среды или калориметра, найдите а) конечную температуру системы, б) изменение энтропии для олова, для воды и для олова и воды вмести.
Решение.
а) Пусть tf – конечная температура.
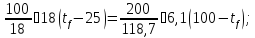
tf =31,90C
б)ΔSводы=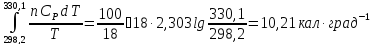
ΔSолова=
ΔSобщее=
ΔSводы+
ΔSолова=10,21
– 1,26=8,95
Ответ:
31,90C;
8,95
127. Коэффициент полезного действия цикла холодильной установки
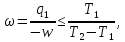
где Т1 и Т2 – температуры холодильных камер и окружающей среды соответственно, q1-теплота, отводимая от холодильных камер, w-потребляемая работа. а) Определите максимальную величину ω для холодильной установки, которая работает между 25 и -50С в окружающую среду с температурой 250С.
Решение.
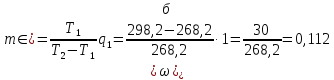 кал.
а)
кал.
а)
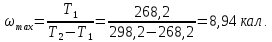
Ответ: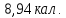 ;
;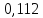 кал.
кал.
128. Тепловой насос является, в сущности, обратным холодильником, т.е. он использует тепло окружающей среды при низкой температуре Т1 на нагревание системы при высокой температуре (перекачивает тепло). Таким образом, этот тепловой насос может использоваться для обогрева помещений путем передачи тепла от холодного открытого воздуха к теплому внутреннему помещению. Преимущество этого метода перед обычным методом нагревания состоит в том, что максимальный коэффициент полезного действия холодильника намного больше, чем в случае обычных методов нагревания.
Решение.
Пусть коэффициент полезного действия теплового насоса равен
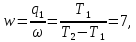
где q1-количество тепла, передающегося от более низкой температуры. Рассчитайте q2/w-отношение полученного тепла при высокой температуре к затраченной работе.


Таким образом, тепловой насос на 1 кал поглощенной энергии выработает в шесть раз больше тепла, чем калорифер с эффективностью 100%.
Ответ: в 6 раз
129. Процесс А: 1 моль одноатомного идеального газа расширяется изотермически в вакуум при 300 К от начального объёма 10 л до конечного объёма 20л.
Процесс Б: 1 моль
этого газа расширяется изотермически
и обратимо при 300 К от объёма 10 л до объёма
20 л. А) Для каждого процесса рассчитайте
q,
w,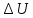 ,
,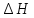 ,
, и
и
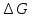 .
б) Опишите процесс, благодаря которому
газ мог бы возвратиться в исходное
состояние после каждого из процесса А
и Б. Покажите, как окружающая среда может
быть возвращена в исходное состояние
после одного из процессов и почему она
не может быть возвращена в исходное
состояние после другого процесса.
.
б) Опишите процесс, благодаря которому
газ мог бы возвратиться в исходное
состояние после каждого из процесса А
и Б. Покажите, как окружающая среда может
быть возвращена в исходное состояние
после одного из процессов и почему она
не может быть возвращена в исходное
состояние после другого процесса.

 Дж/моль
Дж/моль Дж/(г
Дж/(г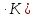
 Дж/моль
Дж/моль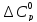 Дж/(г
Дж/(г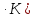
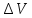 ,см3
,см3