
- •Тема 1. Второй закон термодинамики.
- •94. Определите изменение энтропии для реакции
- •Решение.
- •Решение.
- •121. Рассчитайте давления, при которых графит и алмаз находятся в равновесии для интервала температур 298—4000 к. При расчете используйте следующие данные для равновесия с (графит) с (алмаз):
- •Решение.
- •Решение.
- •Многовариантные задачи
- •Решение.
- •Тема 2. Характеристические функции
- •Решение:
- •Решение.
- •Решение.
- •Решение.
94. Определите изменение энтропии для реакции
Cd+2AgCl=CdCl2+2Ag
Если проводить её
в гальваническом элементе при 1,0133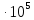 Па и 298,2 К, ЭДС элемента компенсируется
приложенной извне и равной 0,6753 В.
Стандартные теплоты образования хлоридов
кадмия и серебра соответственно равны
-389,0 и -126,8 кДж/моль
Па и 298,2 К, ЭДС элемента компенсируется
приложенной извне и равной 0,6753 В.
Стандартные теплоты образования хлоридов
кадмия и серебра соответственно равны
-389,0 и -126,8 кДж/моль
Решение.
Тепловой эффект реакции в соответствии с законом Гесса равен:
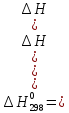
Так как реакция
необратима, то
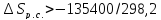
Для расчёта
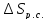 необходимо провести обратимо. Если же
осуществить эту реакцию в помещенном
в термостат гальваническом элементе,
в котором поддерживаются неизменными
температура и давление, и если ЭДС
элемента Е компенсируется ЭДС, приложенной
извне, то процесс будет практически
необратим. При этом будет произведена
работа
необходимо провести обратимо. Если же
осуществить эту реакцию в помещенном
в термостат гальваническом элементе,
в котором поддерживаются неизменными
температура и давление, и если ЭДС
элемента Е компенсируется ЭДС, приложенной
извне, то процесс будет практически
необратим. При этом будет произведена
работа
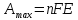 ,
тепловой эффект Q
будет равен T
,
тепловой эффект Q
будет равен T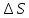 .
.
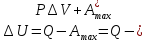 )
)
или Q= =
=
Подставляя в последнее
уравнение значения
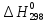 ( изменение энтальпии не зависит от пути
процесса, поэтому оно будет одинаковым
как в необратимом, так и в обратимом
процессах) и n=1,
E=0,6753
B,
F=96487
Кл , получаем
( изменение энтальпии не зависит от пути
процесса, поэтому оно будет одинаковым
как в необратимом, так и в обратимом
процессах) и n=1,
E=0,6753
B,
F=96487
Кл , получаем
Q= -135400+2∙0,6753∙96487=-5084,7 Дж
Следовательно,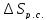 =-5084,7/298,2=-17,05
Дж/моль∙ К . Изменение энтропии
изолированной системы в целом (т.е.
рабочая система плюс термостат) при
фактическом процессе будет равно
=-5084,7/298,2=-17,05
Дж/моль∙ К . Изменение энтропии
изолированной системы в целом (т.е.
рабочая система плюс термостат) при
фактическом процессе будет равно
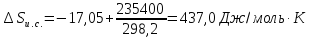 что
подтверждает необратимость процесса.
что
подтверждает необратимость процесса.
Ответ:
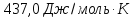
95. Определите стандартное изменение энтропии при 298 К для следующих реакций:
MgO+H2=H2Oж+ Mg (1)
C+CO2=2CO (2)
2SO2+O2=2SO3 (3)
FeO + CO=Fe+CO2 (4)
Решение.
Mg H2Oж H2 MgO C CO2 CO SO2 SO3
32,68 69,95 130,52 27,07 157,99 213,66 197,55 248,07 256,69
FeO Fe
60,95 27,15
ΔS1=(32,68=69,95)-(130,52+27,07)=102,63-157,59=-54,96Дж/моль∙К
ΔS2=2∙197,55-(213,66+157,99)=395,1-371,65=23,45 Дж/моль∙К
ΔS3=2∙256,69-(157,69+2∙248,07)=513,38-653,83= -140,45 Дж/моль∙К
ΔS4=(213,66+27,15)-197,55+60,95)=240,81-258,2=-17,39 Дж/моль∙К
Ответ: -54,96Дж/моль∙К; 23,45 Дж/моль∙К; -140,45 Дж/моль∙К; -17,39 Дж/моль∙К
96. Определите стандартное изменение энтропии при 298К для следующих реакций:
MgO+ Н2 = Н2О(ж) +Mg (1)
C + CО2= 2CO (2)
2SО2 + О2 = 2 SО3 (3)
FeO+CO=Fe + CО2 (4)
Решение.
Для 1-го уравнения:
ΔS=70,08+32,7-130,52+26,9=-54,64 Дж/(моль∙К).
Для 2-го уравнения:
ΔS= 2∙197,54 – 213,68=181,4 Дж/(моль∙К).
Для 3-го уравнения:
ΔS=2∙248,1-2∙256,4=-16,4 Дж/(моль∙К).
Для 1-го уравнения:
ΔS=(27,15+213,68)-(197,54+60,75)=-17,46 Дж/(моль∙К).
Ответ: -54,64; 181,4; -16,4; -17,46 Дж/(моль∙К).
97. Идеальная тепловая машина, работающая по циклу Карно, совершает за один цикл работу 80 кДж. Температура термостатов соответственно равна 100 и 00С. Найти : а) количество теплоты, получаемым рабочим телом за один цикл от нагревателя; б) количество теплоты, передаваемое за каждый цикл холодильнику; в) КПД цикла.
Решение.
а)
 =
= ;
;
 =
=
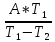
Q1=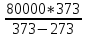 =298,4
кДж
=298,4
кДж
б)
 =
= ;
Q2=
;
Q2=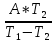
Q2=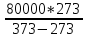 =
218,4 кДж
=
218,4 кДж
в) ɳ= =
= =0,2681
=0,2681
Ответ: 298,4 кДж; 218,4 кДж; 0,2681
98. Идеальная тепловая машина работает по циклу Карно. Определить КПД цикла, если известно, что за один цикл произведена работа 5 кДж и холодильнику передано 25 кДж тепла.
Решение.
ɳ= Q1=
A+Q2=
5000+ 25000= 30 000
Дж
Q1=
A+Q2=
5000+ 25000= 30 000
Дж
ɳ=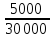 =0,167
=0,167
Ответ: 0,167
99. Идеальная холодильная машина Карно передаёт тепло от холодильника с водой при 00С к холодильнику при 1000С. Какое количество воды надо заморозить в холодильнике, чтобы превратить в пар 3 кг воды в кипятильнике? Энтальпия плавления льда и испарения воды соответственно равны 6,02 и 40,30 кДж/моль.
Решение.
Qисп.
= Hисп.∙
n
Hисп.∙
n
n
(H2O)= =166,67
моль
=166,67
моль
Qисп.= 40,30∙166,67=6716,80 кДж
Q1=A+Q2 Q2= Q1-A
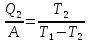
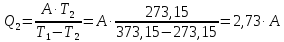
Q1=2,73∙А+А, 6716,80=3,73∙А, А=1800,75 Дж
Q2=Q1-A= 6716,80-1800,75= 4916,05 кДж
n
=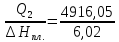 = 816,62 моль
= 816,62 моль
m (H2O)= 18∙816,62= 14699,2 г.
Ответ: 14699,2 г.
100. Тепловой насос (холодильная машина) работает обратимо между 00С и температурой t. Она потребляет энергию 1000 Дж и отдаёт в окружающую среду 10 000 Дж. Чему равна температура t ? Определить теплоту, которую отнимает холодильная машина от охлаждаемого тела при температуре 00С.
Решение.
Q1= A+Q2 Q2= Q1-A
Q2= 10 000- 1000= 9000 Дж
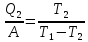 ,
,
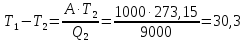
T1-T2= 30,3
T1- 273,15= 30,3
T1= 303,5 К
Ответ: 303,5 К; 9000 Дж
101. Холодильная машина по производству льда работает между температурами 0 и 250С. Она замораживает воду. Взятую при 00С. За 8 часов работы было получено 100 кг льда и при этом в окружающую среду при 250С выделилось 40 000 кДж. Какое количество электроэнергии необходимо для работы холодильной машины? Сколько электроэнергии понадобилось бы для работы идеальной холодильной машины для получения такого же количества льда? Энтальпия плавления льда 6013 Дж/моль.
Решение.
Q2=ΔU∙n=6013∙
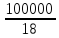 =33405
кДж
=33405
кДж
Aидеальн.=Q2∙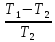 =33405∙
=33405∙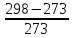 =3059,1
кДж
=3059,1
кДж
Q1=40000 кДж
Q2+A=40000 кДж
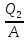 =∙
=∙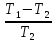 =
=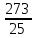 =10,92
=10,92
Ответ: 3059,1 кДж; 40000 кДж
102. На рис.(а) дано классическое изображение цикла Карно в координатах P-V. Цикл Карно можно также представить в координатах S-T рис.(б).а) Какие процессы отражают кривые А, В, С, D на рис. (а). Указать соответствующие этим процессам отрезки прямых на рис. (б). б) Предположим, что идеальная тепловая машина работает между температурами T1 и T2, причём T2=300 К. за один цикл совершает работу 5000 Дж. Изменение энтропии газа для отдельных стадий цикла показано на рис. (б). Рассчитать теплоту Q1, которая поступает к машине от нагревателя, и теплоту Q2, которую машина отдаёт холодильнику. Чему равна температура нагревателя T1?
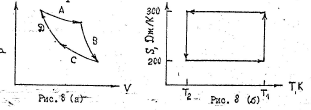
Решение.
S2-S1=


Ответ: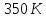 ;
;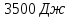
103. Определите максимальную работу, которую можно получить, если к воде при 100°С подводится 4000 Дж теплоты, а температура конденсата 20 °С.
Решение.
A=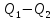
КПД=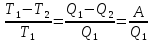
КПД=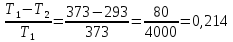
0,214=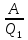
A=856 Дж
Ответ: 858 Дж
104. В термостате поддерживается температура 96,6 °С. Температура воздуха в комнате 26,9 °С. Потеря теплоты через изоляцию термостата за некоторый промежуток времени составляет 4187 Дж. Найдите общее изменение энтропии.
Решение.
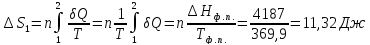

ΔS=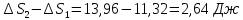
Ответ:
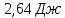
105. Рассчитайте КПД идеальной машины Карно, получающей пар при 140 °С и выпускающей его при 105 °С.
Решение.
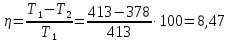
Ответ:
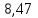
106. Максимальная температура в двигателе внутреннего сгорания 1800 °С, а минимальная, с которой газы выходят из цилиндра машины, 300 °С. Определите максимально возможный термический КПД, если двигатель будет работать по циклу Карно.
Решение.

Ответ: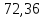
107. К газу при круговом процессе подведено 270 кДж теплоты. Термический КПД равен 0,48. Определите работу цикла и количество теплоты, отданное теплоприемнику.
Решение.
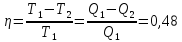
0,48=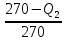

A=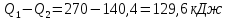
Ответ: 129,6 кДж; 140,4 кДж
108. В результате осуществления кругового процесса получена работа, равная 70 кДж, а отдано теплоприемнику 47 кДж теплоты. Определите термический КПД цикла и количество теплоты, сообщенное рабочему телу от теплоотдатчика.
Решение.
A=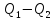


Ответ: 59,82 %; 117кДж
109. Идеальная машина Карно, работающая в интервале между 350 и 50 °С, дает 33,52 кДж работы за цикл. Какое количество теплоты сообщается машине и отдается теплоприемнику за этот же цикл?
Решение.
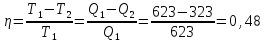
0,48=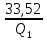
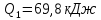
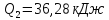
Ответ: 69,61 кДж; 36,09 кДж
110. В обратном цикле Карно от теплоотдатчика при 0 °С отнимается 419 кДж теплоты и передается теплоприемнику с температурой 77 °С. Определите работу, расходуемую на осуществление этого цикла.
Решение.
A=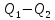
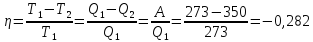
-0,282=
A=-118,1 кДж
Ответ: -118,1 кДж
111. В цикле Карно 1кг воздуха в пределах температур 800-273 К совершает работу, равную 50,28 кДж. Определите КПД цикла и количество отведенной теплоты.
Решение.
A=
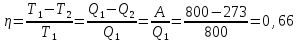
0,66=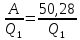
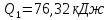
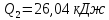
Ответ: 65,88 %; 26,05 кДж
112. Сравните термодинамическую эффективность паровой машины и машины, работающей на ртутном паре, если котел первой имеет температуру 200 °С, второй 460 °С, а холодильник каждой из машин имеет температуру 30 °С.
Решение.
-
 =
=
-
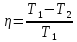 =
=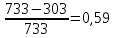
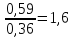
Ответ: 1,6
113.
Практический коэффициент полезного
действия (КПД) двигателя внутреннего
сгорания равен
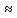 28%.
Насколько можно повысить КПД этого
двигателя, если температура газов
сгорания в его цилиндрах равна 1200 К, а
температура выхлопных газов - 400 К?
28%.
Насколько можно повысить КПД этого
двигателя, если температура газов
сгорания в его цилиндрах равна 1200 К, а
температура выхлопных газов - 400 К?
Решение.
Рассчитаем термодинамический КПД этого двигателя:
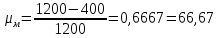
Отсюда следует, что КПД данного двигателя может быть повышен на (66,67-28)=38,7 %
Ответ: 38,7 %
114.
Спиральный электронагреватель за сутки
расходует на обогрев помещения 86,4 кВт∙ч
электроэнергии. Сколько энергии может
быть сэкономлено, если этот нагреватель
заменить тепловым нососом? Температуру
обогреваемого помещения принять равной
18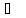 ,
а температуру уличного воздуха принять
равной минус 25
,
а температуру уличного воздуха принять
равной минус 25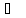 .
.
Решение.
Рассчитываем термодинамический КПД теплового насоса в заданных условиях:
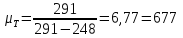
Допустим, что практический КПД теплового насоса, вследствие несовершенства исполнения, вдвое меньше теоритического:
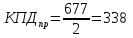
Тогда, для обогревания рассматриваемого помещения до того же состояния, что и спиральным нагревателем, тепловому насосу за сутки потребуется энергии:
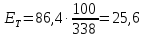 кВт∙ч
кВт∙ч
Следовательно,
экономия энергии составит:
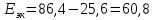 кВт∙ч/сут.
кВт∙ч/сут.
Ответ:
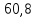 кВт∙ч/сут.
кВт∙ч/сут.
115. Идеальная машина Карно, работающая в интервале температур от 200 до 300К, превращает в работу теплоту, равную 83,8 Дж. Какое количество теплоты отдано резервуару при 200К?
Решение.
n=T1-T2/T1=A/Q
n=T1-T2/T1=200-300/200=-0,5
Q=A/n=83,8/-0,5=-167,6 Дж
Ответ: -167,6 Дж
116. Какое количество теплоты будет превращено в работу идеальной машины Карно, работающей при температуре между 200 и 100 К, если она получит при 200 К сколько же теплоты, сколько получает машина в задаче 1 при 300 К?
Решение.
83,8/Q1=200-300/200
Q1=-167, 6
Q1- Q2=83,8
Q2=-167, 6-83,8=-251,4
4-x/-251,4=200-100/200
x=-129,7 Дж
Ответ:-129,7 Дж
117. При начальной температуре 348К 1 моль Н2 по циклу Карно сначала расширяется до двойного объёма изотермически, затем расширяется до учетверенного первоначального объёма адиабатически, затем сжимается изотермически до такого объёма, чтобы при последующем адиабатическом сжатии вернутся в исходное положение. Вычислите работу каждой части цикла и КТД цикла γ=1,4
Решение:
Для первой стадии:
WT= n∙R∙T∙ln(V2/V1)=QT
W1=1∙8,314∙348∙ ln(2V2/V1)=2005,5 (Дж)
Для второй стадии:
W2=n∙R∙(T1- T2)/ (γ-1);
T2= T1∙(2V1/4V1)(1,4-1)=348∙(2/4) (0,4)=263,73К.
W2=1∙8,314∙(348-263,73)/0,4=1751,6 (Дж)
Для третьей стадии:
W3= -n∙R∙T∙lnV3/V4, где по условию V3=4V1.
(V4/V1) (γ-1)= T1/ T2
W3=-1∙8,314∙263,73∙ln(4V1/2V1)=-1519,83 (Дж)
Для четвертой стадии:
W4=-n∙R∙(T1- T2)/ (γ-1);
W4=-1 8,314∙(348-263,73)/0,4=-1751,6
(Дж)
8,314∙(348-263,73)/0,4=-1751,6
(Дж)
Суммарная работа за весь цикл:
W=W1+W2+W3+W4
W=2005,5-1519,83=485,67 (Дж)
КПД цикла:
η=W/Q=(485,67/2005,5)∙100%=24,22%
Ответ: 2005,5; 1519,83; -1751,6; 1751,6 (Дж)
118. Вычислите максимальный теоретический коэффициент полезного действия обратимой тепловой машины, работающей между 25 и 1000К.
Решение.
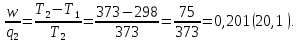
Ответ: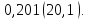
119.
Рассчитайте
стандартную энтропию этилена, если
температуры и теплоты фазовых превращений
этилена соответственно равны: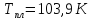 ,
,
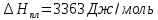 ,
,
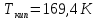 ,
,
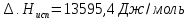 .
Зависимость теплоёмкости от температуры
см. в таблице
.
Зависимость теплоёмкости от температуры
см. в таблице

Решение.
Определяем стандартную энтропию по уравнению:
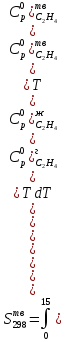
Пересчитав приведенные
значения
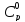 и
и
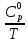 и построив график
и построив график
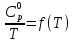 (рис.11) находим энтропию для каждого
интервала температур: 1) методом
графической экстраполяции или по
уравнению Дебая
(рис.11) находим энтропию для каждого
интервала температур: 1) методом
графической экстраполяции или по
уравнению Дебая

Где 0-характеристическая температура:
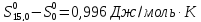
2) Графически
для интервала 15,0-103,9
K 
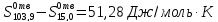
3) Для фазового
перехода
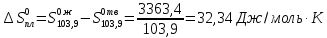
4) Графически для интервала 103,9-169,4 К
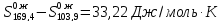
5) Для фазового перехода6) Графически для интервала 169,4-298 К

7) Сумма изменений
энтропий во всех интервалах температур
будет равна

Ответ:
120.
Установите,
осуществима ли при V=const
и 298 К реакция Ag+n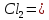 AgCl(тв)+(n-
AgCl(тв)+(n- ,
использовав свойства энтропии.
,
использовав свойства энтропии.
Решение.
Энтропия является
критерием направленности процесса
только в том случае , если процесс
протекает в изолированной системе,
поэтому мысленно проводим исследуемую
реакцию при V=const
и отсутствии теплообмена с окружающей
средой. Чтобы рассчитать ΔS
процесса, принимаем: реакция проходит
мгновенно и до конца при 298 К; выделившаяся
теплота идёт на нагревании избытка Cl2
и твёрдого AgCl;
реакционный сосуд теплоту не поглощает;
тогда общее изменение энтропии
складывается из энтропии реакции ( и энтропии нагревания AgCl
и Cl2
(Δ
и энтропии нагревания AgCl
и Cl2
(Δ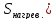 :
:
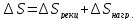
Вычисляем
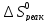 при 298 К по уравнению (VII,13):
при 298 К по уравнению (VII,13):

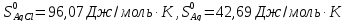 ,
,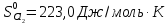 .
После
подстановки чисел и вычислений получаем
.
После
подстановки чисел и вычислений получаем
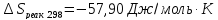
Для вычисления Δ сначала по уравнению теплового баланса
определяем конечную температуру AgCl
(ж) и Cl2(г).
Составляем уравнение теплового баланса
, предположив, что конечная температура
системы выше температуры плавления
AgCl:
сначала по уравнению теплового баланса
определяем конечную температуру AgCl
(ж) и Cl2(г).
Составляем уравнение теплового баланса
, предположив, что конечная температура
системы выше температуры плавления
AgCl:
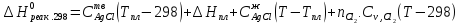
Принимаем, что
избыток Cl2
составляет
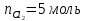 . Из справочников имеем
. Из справочников имеем
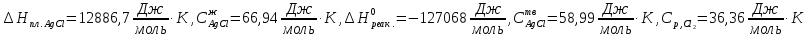 .
Определяем теплоёмкость при постоянном
объёме:
.
Определяем теплоёмкость при постоянном
объёме:
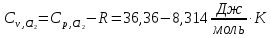
Вычисляем конечную температуру, а затем рассчитываем изменение энтропии при нагревании:
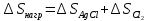
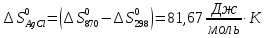
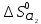 ,
вычисляем по уравнению (VII,
4) и соотношению
,
вычисляем по уравнению (VII,
4) и соотношению

Рассчитываем интегралы:
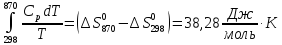

Подставляем полученные
числа в уравнение для расчёта
 :
:
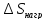 =
=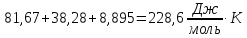
Отсюда общая энтропия процесса:
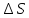 =-57,91+228,6=170,70
=-57,91+228,6=170,70
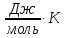
Таким образом,
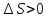 .
Реакция в принятых условиях (
.
Реакция в принятых условиях (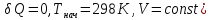 осуществима.
осуществима.
