
- •Г л а в а 1. Теоретические основы технологических
- •1.2. Закономерности энергетических воздействий
- •1.3. Классификация традиционных технологических процессов апк
- •Движущей силе
- •1.4. Стационарные и нестационарные технологические процессы апк
- •1.5. Способы организации технологического процесса
- •1.6. Системный подход к проблеме повышения энергоэффективности производства сельскохозяйственной продукции
- •1.7. Законы сохранения, переноса субстанций и термодинамического равновесия. Материальные и энергетические балансы
- •1.8. Законы равновесия. Равновесное состояние. Направление протекания и движущая сила технологического процесса
- •1.9. Кинетические закономерности процессов переноса субстанций
- •1.10. Основы теории подобия процессов преобразования энергии
1.7. Законы сохранения, переноса субстанций и термодинамического равновесия. Материальные и энергетические балансы
Каждая научная дисциплина базируется на определенном теоретическом фундаменте, обладает единой методологией и логической последовательностью изложения материала.
Теоретическим фундаментом дисциплины «Энергетика технологических процессов в АПК» являются следующие основные законы:
Законы сохранения массы, энергии и импульса допускают только такие превращения, при которых суммы массы, энергии и импульса внутри системы остаются неизменными (т.е. конечная сумма равна сумме в начальном состоянии). Законы сохранения принимают форму уравнений балансов (например, материального и теплового), составление которых является важной частью анализа энергоемкости технологических процессов.
Законы термодинамического равновесия определяют условия, при которых процесс переноса любой субстанции (массы, энергии, импульса) приходит к своему завершению. Состояние системы, при котором необратимый перенос субстанции отсутствует, называют равновесным. Равновесное состояние описывается такими законами, как законы Генри, Рауля и др. Знание условий равновесия позволяет решать очень важные для анализа и расчета технологических процессов задачи - определение направления процесса пере носа (из какой фазы в какую переходит субстанция, перераспределение энергетических потоков) и границ его течения, расчет движущей силы процесса.
Законы переноса массы, энергии и импульса определяют плотность потока любой из этих субстанций в зависимости от градиента сопряженного с ней потенциала переноса, т. е. от удельной, отнесенной к единице объема потока массы, энергии или импульса. Потенциалом переноса в случае переноса массы является плотность (
 )или
концентрация (С), переноса энергии -
энтальпия (cpt
)или
концентрация (С), переноса энергии -
энтальпия (cpt ),
переноса импульса - количество движения
единицы объема жидкости (w
),
переноса импульса - количество движения
единицы объема жидкости (w ).
).
Таким образом, законы переноса определяют интенсивность протекающих технологических процессов и в конечном счете – энергоемкость продукции.
Перечисленные законы составляют теоретическую основу анализа энергоэффективности всех технологических процессов - гидромеханических, тепловых и массообменных.
Закон сохранения массы
В покоящейся системе законы сохранения массы и энергии означают, что внутри системы они могут превращаться, оставаясь в совокупности неизменными. Если система состоит из нескольких компонентов n и одной фазы Ф, то при отсутствии химических взаимодействий по закону сохранения массы сумма масс всех компонентов должна быть равна массе всей системы, т.е.
М1
+ М2+
... + Мn
= M,
![]() =M
(1.3)
=M
(1.3)
Если система состоит из нескольких компонентов (m) и одной фазы Ф, то сумма масс должна быть равна массе всей системы, т.е.
Мф1
+ Мф2
+ ... + МФт
= М,
![]() =
М
(1.4)
=
М
(1.4)
Из последнего выражения закона сохранения массы следует, что чем больше станет масса одной фазы, тем меньше будет масса другой, но сумма масс всех фаз останется неизменной. С помощью рассмотренных выше двух предельных случаев можно получить балансовые уравнения для каждого компонента и каждой фазы, участвующих в процессе.
Обычно в технологических процессах все вещества находятся в движении или, как принято говорить, в потоке. Под потоком понимают перемещение какой-либо среды в пространстве. Наиболее часто приходится иметь дело с конвективными потоками, которые характеризуются движением множества частиц под действием какой-либо силы из одного места пространства в другое. Если конвективный поток отнесен к единице площади, через которую он переносится, то говорят о плотности конвективного потока. Плотность потока является вектором, направление которого совпадает с направлением движения потока; размерность плотности потока [д] = [ед. количества/(м2-с)].
Для характеристики любой системы достаточно трех потоков: массы (или компонента), теплоты (или энтальпии) и импульса.
Законы сохранения массы, энергии и импульса обычно рассматривают совместно. Поэтому и подход к составлению балансов этих субстанций должен быть идентичным.
Материальный баланс
По веществам, участвующим в технологическом процессе, материальные балансы различают следующим образом:
общий по всему веществу (брутто – баланс);
частный – для одного компонента (например, баланс кислорода, углерода, водорода и т.д.).
Материальный баланс должен включать в себя столько уравнений, сколько компонентов в перерабатываемом веществе.
По иерархической структуре производства материальные балансы подразделяют на следующие виды:
части аппарата (т.е. части элемента процесса);
аппарата (т. е. всего элемента процесса);
установки (т.е. части производства);
всего производства – от сырья до готового продукта (т.е. участка цеха, цеха или нескольких цехов); многих производств (т.е. комбината);
отрасли АПК.
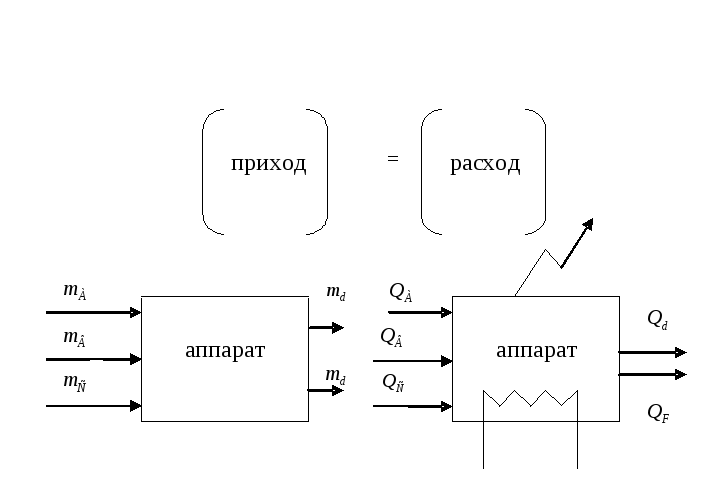
Рис. 1.4. К составлению материальных и энергетических балансов
На основе материального баланса определяют выход продукта по сравнению с теоретически возможным (в %), а также количество (массу) получаемых продуктов в единицу времени. Согласно закону сохранения, масса (количество) поступающих на переработку веществ должна быть равна массе веществ, получаемых в результате проведения процесса.
Например, на вход в аппарат поступают компонента А, В и С (рис. 1.4.), а на выходе из аппарата имеем компоненты D и F. Для этого аппарата уравнение материального баланса можно записать
![]()
или
![]() (1.5)
(1.5)
В практических условиях при проведении технологического процесса происходят необратимые потери вещества Gn (например, со сточными водами или газовыми выбросами, через неплотности аппаратуры и т. п.), поэтому материальный баланс в общем случае принимает вид
![]() mH
=
mH
=
![]() mK
+
mK
+
![]() mнакропл.
(1.6)
mнакропл.
(1.6)
Для нестационарных процессов материальный баланс имеет несколько иной вид, так как потоки, направленные внутрь рассматриваемого объема (приход), и потоки, направленные наружу (расход), могут быть не равны (например, происходит накопление массы), т.е.
Приход — Расход = Накопление,
или
![]() mH
-
mH
-
![]() mK
=
mK
=
![]() mнакропл
(1.7)
mнакропл
(1.7)
Для стационарных процессов правая часть выражения (5) равна нулю, и без учета потерь оно приобретает вид уравнения (3).
Материальный и энергетический балансы в макрообъемах (например, в аппарате) при взаимодействии, например, двух фаз для тепло- или массопереноса будут зависеть от их относительного движения.
Температуры (для теплопереноса) или концентрации (для массопереноса) потоков на выходе из аппаратов могут существенно различаться, например, для прямоточного (рис. 1.5,а; 1.7,a) и противоточного (рис. 1.5,б; 1.7,б) движения потоков при одних и тех же их значениях (начальных температур и концентраций) на входе в аппараты. Следовательно, изменяются значения движущих сил процесса, и, как следствие, изменяется энергоемкость получаемой продукции.
Проиллюстрируем это положение на примере теплового процесса в рекуперативном теплообменнике (пример1) и массобменного процесса абсорбции (пример 2).
Пример 1. Наиболее распространенные виды относительного движения потоков в тепловом процессе представлены на рис. 1.5.
При изменении агрегатного состояния
температура теплоносителя не изменяется
(рис.1.6), т.к. теплота расходуется на
изменение агрегатного состояния. При
этом движущая сила теплового процесса
также остается неизменной. Критерий
фазового превращения представляет
отношение теплоты, расходуемой на
изменение агрегатного состояния вещества
к теплоте перегрева или охлаждения
![]() одной из фаз относительно температуры
фазового превращения:
одной из фаз относительно температуры
фазового превращения:
![]() ,
(1.7)
,
(1.7)
где r–теплота
парообразования; с – удельная теплоемкость;![]() -
разность температур между
температурой фазового перехода и
температурой одной из фаз.
-
разность температур между
температурой фазового перехода и
температурой одной из фаз.
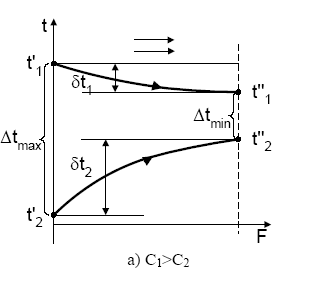
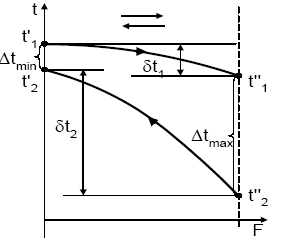
Рис. 1.5. Взаимное направление движения потоков в аппаратах:
а -прямоток; б – противоток
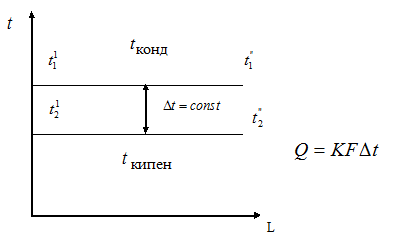
Рис.1.6. К определению движущей
силы
![]() теплового
технологического
теплового
технологического
процесса при
![]()
Среднюю разность температур рассчитывают по формулам
![]() ,
если
,
если![]()
или
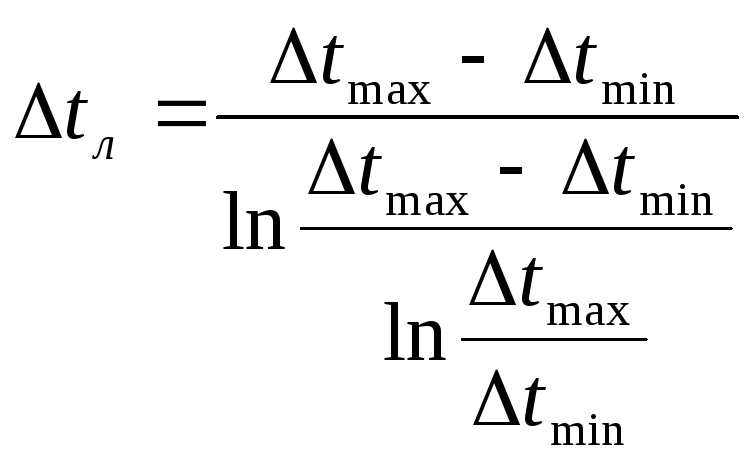 ,
если
,
если![]()
где
![]() и
и![]() - максимальная и минимальная разность
температуры теплоносителей;
- максимальная и минимальная разность
температуры теплоносителей;![]() - среднеарифметическая разность
температур;
- среднеарифметическая разность
температур;![]() - среднелогарифмическая разность
температур.
- среднелогарифмическая разность
температур.
Для теплового расчета рекуперативного теплообменника используют следующие основные уравнения:
а) уравнение теплового баланса
Q1 = Q2 + QПОТ (1.8)
или в развернутом виде для однофазных теплоносителей
![]() ;
;
если греющим теплоносителем является сухой насыщенный водяной пар
![]() ,
,
б) уравнение теплопередачи
Q=K∆tF
В формулах (№№) –(№№) Q1– тепловой поток, отдаваемый горячим
теплоносителем в единицу времени, Вт;Q2 – тепловой поток,
получаемый холодным теплоносителем в
единицу времени, Вт;QПОТ
– тепловой поток потерь в окружающую
среду – в данной задаче принимается
равным нулю, Вт;G1иG2– массовые
расходы горячего и холодного теплоносителей,
кг/с;![]() и
и![]() - удельные массовые изобарные теплоемкости
горячего и холодного теплоносителей,
Дж/(кг·К);
- удельные массовые изобарные теплоемкости
горячего и холодного теплоносителей,
Дж/(кг·К);![]() и
и![]() -
температура горячего теплоносителя на
входе и выходе из теплообменника, ̊ С;
-
температура горячего теплоносителя на
входе и выходе из теплообменника, ̊ С;![]() и
и![]() - температура холодного теплоносителя
на входе и выходе из теплообменника.
- температура холодного теплоносителя
на входе и выходе из теплообменника.
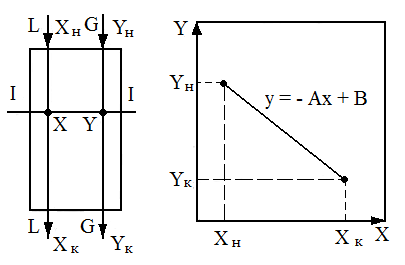
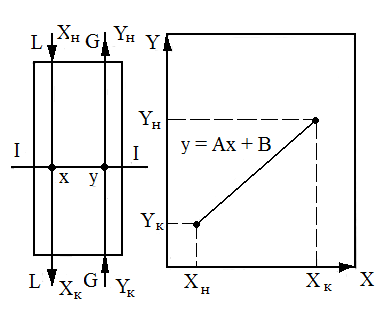
Пример 2.Рассмотрим установившийся процесс поглощения газа жидкостью (абсорбцию), например, поглощение аммиака водой из аммиачно–воздушной смеси (рис. 1.7) при условии отсутствия перемешивания фаз по высоте аппарата. Количество компонента (аммиака), переходящего из газовой фазы в жидкую
M = M1=G(y![]() -
-
![]() )
= L(x
)
= L(x![]() -x
-x![]() )
(1.14)
)
(1.14)
где G иL-расходы соответственноинертного
газа и жидкости, кмоль/с; y![]() и
и![]() -концентрации компонентов газа
на входе в аппарат и выходе из него,
кмоль/кмоль инертного газа;x
-концентрации компонентов газа
на входе в аппарат и выходе из него,
кмоль/кмоль инертного газа;x![]() иx
иx![]() - концентрации компонента в жидкостина входе в аппарат
и выходе из него, кмоль/кмоль инертной
жидкости.
- концентрации компонента в жидкостина входе в аппарат
и выходе из него, кмоль/кмоль инертной
жидкости.
а
б
Рис. 1.7. К выводу уравнений материального баланса и рабочей линии процесса (на примере абсорбции): а - противоток; б - прямоток
Для того чтобы получить связь между текущими концентрациями в фазах, запишем материальный баланс для верхней части аппаратов (сечение 1-1, рис. 4, а):
LxH
+ Gy = Lx
+ Gy![]() ,
или
,
или
y = (L/G)x + [yK - (L/G) xH (1.15)
Поскольку L/G=const,aвторой член правой части уравнения (7) также является постоянной величиной, получим
у = Ах + В, (1.16)
где А = L/G -тангенс угла наклона прямой линии;В– отрезок, отсекаемый на оси ординат прямой линией.
Уравнение (1.16) описывает связь рабочих концентраций компонента в потоках, обычно его называют уравнением рабочей линии.
Для прямоточного движения потоков уравнение рабочей линии получают по аналогии с предыдущим случаем:
у=-Ах + В. (1.17)
Уравнение (1.17) отличается от (1.16) знаком перед коэффициентом А. На рис. 1.7, а и 1.7,б построены линии рабочих концентраций по уравнениям (1.16) и (1.17), которые в дальнейшем, после рассмотрения условий равновесия систем, позволяют подойти к определению движущих сил процессов переноса массы и энергетических потоков, необходимых для реализации технологического процесса.
Закон сохранения энергии
Из первого закона термодинамики может быть сформулировано выражение закона сохранения энергии: внутренняя энергия U изолированной от внешней среды системы постоянна, т. е. U = const. Тогда
dU=
![]() .
(1.18)
.
(1.18)
В уравнении (10)
величины теплоты
![]() Q
и производимой
работы
Q
и производимой
работы
![]() А
характеризуют
не систему, а процессы ее взаимодействия
с окружающей средой, поэтому они не
являются полными дифференциалами.
Переход системы из одного энергетического
состояния в другое характеризуется
новым значением внутренней энергии
U,
так как U
меняется на определенную величину
независимо от пути перехода.
А
характеризуют
не систему, а процессы ее взаимодействия
с окружающей средой, поэтому они не
являются полными дифференциалами.
Переход системы из одного энергетического
состояния в другое характеризуется
новым значением внутренней энергии
U,
так как U
меняется на определенную величину
независимо от пути перехода.
Уравнение (10) без большой ошибки может быть использовано в качестве закона сохранения теплоты.
Энергетический баланс
Для определения энергоемкости технологических процессов необходимо определить расход энергии на его проведение. Чтобы определить расход теплоты, составляют тепловой баланс как часть общего энергетического баланса. Тепловой баланс составляют для многих процессов, протекающих в теплообменных аппаратах, массообменных аппаратах (перегонка жидкостей, сушка и т.п.).
По аналогии с материальным балансом тепловой баланс в общем виде выражается следующим образом:
![]()
или
![]() ,
(1.19)
,
(1.19)
где Σ Qвx – теплота, поступающая в аппарат с исходными компонентами;
Q – дополнительная теплота. подводимая к аппарату от внешних источников (например с помощью встроенного калорифера); Σ Qвых – теплота, уходящая из аппарата; Qn – тепловые потери.
На рис. 1.8 приведены примеры нагревания жидкости в аппаратах идеального вытеснения и идеального смешения.
В аппарате идеального вытеснения температура жидкости плавно изменяется по длине аппарата l от начальной tн до конечной tK, так как текущие в аппарате объемы жидкости вытесняют друг друга, не смешиваясь.
В аппарате идеального смешения поступающая жидкость практически мгновенно смешивается с находящейся в аппарате, поэтому начальная температура tH жидкости в таком аппарате мгновенно изменяется до конечной tK.
Средняя разность
температур
![]() tcp
при условии сохранения начальных
температур нагреваемой жидкости tн
и греющего
пара ta
(средняя
движущая сила процесса) в аппарате
идеального вытеснения выше, чем в
аппарате идеального смешения.
Следовательно, и количество переданной
при этом теплоты в аппарате идеального
вытеснения больше, т. е. QK
выт
> QK
смеш
tcp
при условии сохранения начальных
температур нагреваемой жидкости tн
и греющего
пара ta
(средняя
движущая сила процесса) в аппарате
идеального вытеснения выше, чем в
аппарате идеального смешения.
Следовательно, и количество переданной
при этом теплоты в аппарате идеального
вытеснения больше, т. е. QK
выт
> QK
смеш
Тепловой баланс для обоих случаев идентичен:
Q![]() +Q
+Q
![]() =Q
=Q
![]() +Q
+Q
![]() ,
(1.20)
,
(1.20)
но значения величин, входящих в уравнение (1.20), различны. Поэтому при составлении тепловых балансов часто приходится принимать модель, по которой работает данный аппарат (идеальное вытеснение, идеальное смешение и т. д.).
Помимо расхода теплоты, энергетический баланс позволяет определить расходы кинетической и потенциальной энергии на проведение процесса (премешивание жидкостей, транспортирование газов и т.д.).
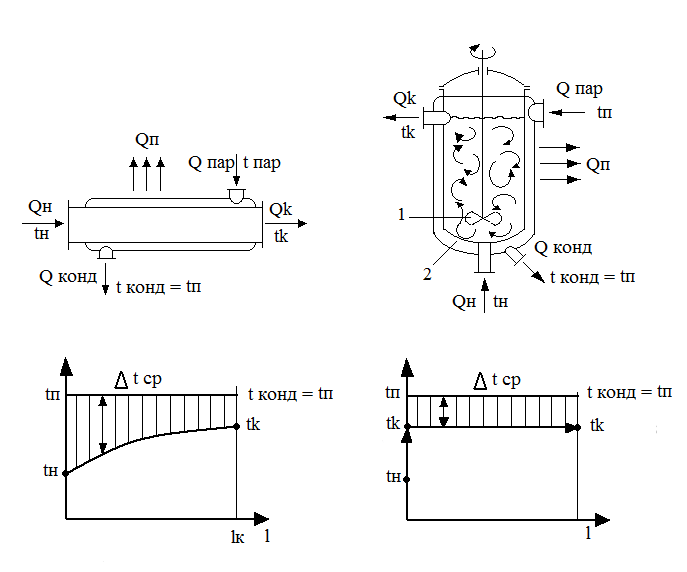
Рис. 1.8. Конструктивные схемы и температурные графики теплообменников:
а – идеального вытеснения; б - идеального смешения.
Основные уравнения переноса субстанций
Выделим в
жидкости, находящейся в движении,
произвольный объем V,
ограниченный поверхностью S.
Объем V
жидкости расположен в неоднородном
поле физического потенциала переноса
![]() .
Задача сводится к выводу дифференциальных
уравнений, описывающих распределение
скоростей, концентраций и температур
во времени и пространстве, что необходимо
для решения многих задач гидродинамики,
тепло- и массообмена. Если объемные силы
консервативны, т. е. не изменяются
во времени, то их можно заменить
потенциалом переноса.
.
Задача сводится к выводу дифференциальных
уравнений, описывающих распределение
скоростей, концентраций и температур
во времени и пространстве, что необходимо
для решения многих задач гидродинамики,
тепло- и массообмена. Если объемные силы
консервативны, т. е. не изменяются
во времени, то их можно заменить
потенциалом переноса.
Потенциал переноса
представляет собой удельную (отнесенную
к единице объема) массу, энергию или
количество движения. В случае переноса
массы в качестве потенциала переноса
рассматривают плотность (![]() )
или концентрацию (С):
)
или концентрацию (С):
![]() =
=![]() =
=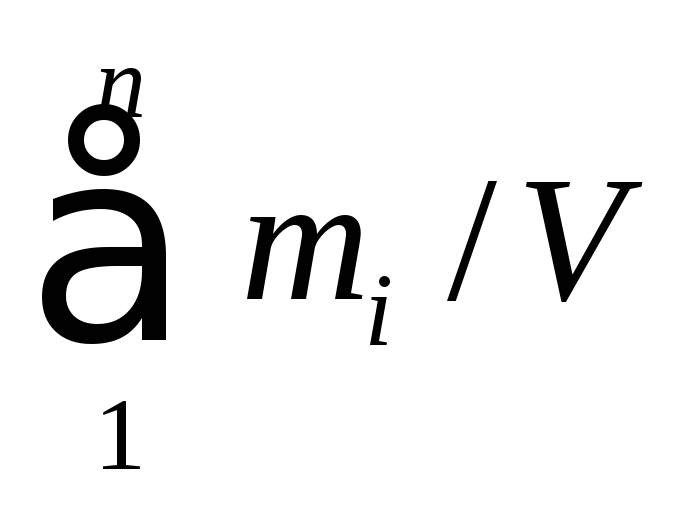 или
или![]() =C=
=C=![]() , (1.21)
, (1.21)
где
![]() –
масса i-го
компонента смеси; [
–
масса i-го
компонента смеси; [![]() ]
= [С] = [кг/м3].
]
= [С] = [кг/м3].
В случае переноса энергии (теплоты) потенциалом переноса является энтальпия единицы объема жидкости:
![]() =
cpt
=
cpt![]() V/V=cpt
V/V=cpt![]() ,
(1.22)
,
(1.22)
где ср–
теплоемкость
среды; [cpt![]() ]
= [Дж/м3].
]
= [Дж/м3].
В гидродинамических процессах потенциалом переноса является количество движения (импульса) единицы объема жидкости:
![]() =
w
=
w![]() V/V=w
V/V=w![]() ,
(1.23)
,
(1.23)
где [w![]() ]
= [кг/(м2-с)].
]
= [кг/(м2-с)].
В рассматриваемом
объеме жидкости существуют источники
потенциала переноса, характеризующиеся
удельной объемной плотностью притока
![]() ,
т.е. скоростью притока энергии [
,
т.е. скоростью притока энергии [![]() ]
= [Дж/(м3-с)],
массы [
]
= [Дж/(м3-с)],
массы [![]() ]
= [кг/(м3
с)] или импульса [
]
= [кг/(м3
с)] или импульса [![]() ]
= [кг/(м2
с)] в единице объема.
]
= [кг/(м2
с)] в единице объема.
Процессы тепло – и массопереноса через рассматриваемую поверхность S осуществляются двумя видами механизма переноса:
1) молекулярным, т. е. переносом, возникающим в результате стремления системы к термодинамическому равновесию, отклонения от которого объясняются неоднородностью поля потенциала;
2) макроскопическим – конвективным переносом, вызванным наличием поля скоростей жидкости в объеме V. В случае переноса количества движения (импульса) к указанным двум видам переноса добавляется также перенос, вызванный наличием поля гидростатического давления, а при переносе теплоты – перенос за счет теплового излучения.
Поток субстанции, вызванный стремлением системы к термодинамическому равновесию (молекулярный перенос), определяется хаотическими перемещениями молекул среды, переносящих массу, энергию и импульс и тем самым усредняющих потенциал в рассматриваемом объеме. Молекулярный перенос является определяющим в неподвижных средах и в ламинарно движущихся потоках и описывается следующими известными линейными градиентными законами:
для переноса массы – первым законом Фика:
![]() =
- D
gradC,
(1.24)
где D
- коэффициент
молекулярной диффузии, м2/с.
=
- D
gradC,
(1.24)
где D
- коэффициент
молекулярной диффузии, м2/с.
для переноса энергии (теплоты) – законом Фурье:
![]() =
–
=
–![]() grad
t,
(1.25)
grad
t,
(1.25)
где
![]() –
коэффициент
теплопроводности.
–
коэффициент
теплопроводности.
для переноса импульса (с учетом закона внутреннего трения Ньютона):
![]() =–
=–![]() grad
grad
![]() .
(1.26)
.
(1.26)
