- •1. Основные понятия химии: атом, молекула, химический элемент, протон, нейтрон, электрон.
- •2. Изотопы, изотоны, аллотропия.
- •3. Стехиометрия. Основны законы стехиометрии.
- •5. Дальтониды и бертоллиды.
- •6. Атомная масса, относительная атомная масса, связь между атомной и молярной массой.
- •7. Молекулярная масса. Моль. Молярная масса.
- •8. Число Авогадро. Связь между колличеством вещества, массой, объемом, и числом атомов.
- •16. Строение атома: планетарная модель атома Резерфорда.
- •19. Характеристика квантовых чисел.
- •21. Правило Хунда.
- •22. Принцип наименьшей энергии (правило Клечевского)
- •25. Σ, π, δ связь
- •26. Ковалентная, ионная, металлическая и водородная связь.
- •27. Виды и номенклатура комплексных соединений.
- •28. Комплексообразователи и лиганды.
- •Классификация дисперсных систем по агрегатным состояниям фаз.
- •36. Механизм образования жидких растворов. Сольватация и гидратация.
- •37. Автопротолиз воды. Водородный показатель. Кислотность среды.
- •48. Устройство свинцово- кислотного аккумулятора.
8. Число Авогадро. Связь между колличеством вещества, массой, объемом, и числом атомов.
Для
определения числа атомов (молекул) в
определенном количестве вещества
необходимо воспользоваться следующей
формулой: N = ν · NA,
где
N - число частиц (атомов или молекул).
Например,
определим количество атомов алюминия,
содержащиеся в 2 моль вещества алюминия:
N (Al) = ν (Al) · NA.
N
(Al) = 2 моль · 6,02 · 1023
![]() = 12,04 · 1023
(атомов).
Кроме того, можно определить
количество вещества по известным числом
атомов (молекул):
= 12,04 · 1023
(атомов).
Кроме того, можно определить
количество вещества по известным числом
атомов (молекул):
![]() .
Например,
определим количество вещества
молекулярного кислорода, которая
содержит 3,01 · 1023
молекул кислорода:.
.
Например,
определим количество вещества
молекулярного кислорода, которая
содержит 3,01 · 1023
молекул кислорода:.
![]() .
.
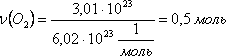 .
Количество вещества определяется числом
структурных единиц (атомов, молекул,
ионов или других частиц) этого вещества.
Количество вещества обозначается
буквой.
.
Количество вещества определяется числом
структурных единиц (атомов, молекул,
ионов или других частиц) этого вещества.
Количество вещества обозначается
буквой.
9. Уравнение Менделеева- Клайперона.
PV=(m/M)RT, где R- универсальная газовая постоянная, равная 8,31 Дж/(К*моль)
10. Эквивалент. Закон эквивалентов.
Эквивалент- часть вещества, реагирующая без остатка с одним эквивалентом водорода или вообще с одним эквивалентом любого другого вещества.
Закон эквивалентов: «Вещества взаимодействуют друг с другом в эквивалентных количествах» , или «массы реагирующих веществ пропорциональны их эквивалентам либо эквивалентным массам (объемам): m1/m2= Э1/Э2».
11. Значения эквивалентов водорода и кислорода.
Эm(Н2)=1 г/экв
Эm(О2)= 8 г/экв
12. Молярная масса эквивалента, молярный объем эквивалента.
Молярная масса эквивалента элемента в соединении не является величиной постоянной, зависит от валентности элемента в данном соединении и выражается уравнением:
 ,
,
где М – молярная масса элемента, г/моль; Z – валентность элемента в данном соединении; 1/z – фактор эквивалентности
Эквивалентный объем или объем моля эквивалента Vэ(X) – это объем, который занимает один моль эквивалентов газообразного вещества при нормальных условиях (н.у.).
13. Эквивалент кислоты, основания, соли.
Кислоты: определяется отношением Mr основания к числу атомов водорода в формуле кислоты, способных заместиться на металл (основность кислоты). Например эквивалент серной кислоты Н2SO4= 98/2= 49 (1/2*М)
Основания: определяется отношением Mr основания к числу гидроксильтных групп ОН в формуле основания, способных заместиться на кислотный остаток (кислотность основания). Например, эквивалент едкого натра равен ЭNaOH= 40/1= 40, т.е. у этого вещества значения эквивалента и молекулярной массы совпадают. (1/3*М)
Соли: определяется как частное от деления Mr соли на суммарный заряд катионов. Так, эквивалент сульфата аллюминия ЭAl2SO4= 342/6= 57. (М/ сумм. Заряд)
Оксида: равен сумме эквивалентов кислорода и элемента, образующего данный оксид. Например, эквивалент оксида аллюминия равен: Al2O3= ЭAl+ ЭО. Поскольку алюминий трехвалентен, то ЭAl= ArAl/B= 27/3=9, следовательно, ЭAl2O3= 9+8=17. Тоже получим, разделив Mr оксида на суммарный заряд катионов металла: 102/6=17.
14. Закон Авогадро. Следствия из закона Авогадро.
Закон: «В равных объемах любых газов при одинаковых условиях содержится одинаковое число молекул» .
Следствия:
- одинаковое число молекул различных газов при одинаковых условиях ( давлении и температуре) занимает одинаковый объем.
- один моль любого газа при определенных условиях занимает постоянный объем.
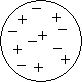
15. Строение атома: модель Томпсона.
В
атоме Томсона положительное электричество
«размазано» по сфере, в которую вкраплены,
как изюм в пудинг, электроны. В простейшем
атоме водорода электрон находится в
центре положительно заряженной сферы.
При смещении из центра на электрон
действует квазиупругая сила
электростатического притяжения, под
действием которой электрон совершает
колебания. Частота этих колебаний
определяется радиусом сферы, зарядом
и массой электрона, и если радиус сферы
имеет порядок радиуса атома, частота
этих колебаний совпадает с частотой
колебания спектральной линии атома. В
многоэлектронных атомах электроны
располагаются по устойчивым конфигурациям,
рассчитанным Томсоном. Томсон считал
каждую такую конфигурацию определяющей
химические свойства атомов. Он предпринял
попытку теоретически объяснить
периодическую систему элементов Д. И.
Менделеева. Эту попытку Бор позднее
назвал «знаменитой» и указал, что со
времени этой попытки «идея о разделении
электронов в атоме на группы сделалась
исходным пунктом и более новых воззрений».
Отметив, что теория Томсона оказалась
несовместимой с опытными фактами, Бор
тем не менее считал, что эта теория
«содержит много оригинальных мыслей и
оказала большое влияние на развитие
атомной теории».