
параметризация процессов трансформации / lec_4
.docРасширенное уравнение баланса газовых примесей в атмосфере
Уравнение баланса газовых примесей, полученное из закона сохранения массы, которое в потоковой форме можно переписать в декартовой системе координат виде:
![]()
Показывает скорость изменения концентрации газа (молекул в единице объема за единицу времени) в точке пространства за счет адвективного потока массы, т.е. дивергентная изменчивость. В этом уравнении не учитывается локальная и диффузионно-турбулентная изменчивость массы в объеме. Локальная изменчивость может происходить в результате фото- и термодиссоциационных и химических процессов, эмиссий и разрушения на поверхности земли и аэрозолей, фазовых переходов.
Диффузионно-турбулентные процессы приводят к изменению содержания газов за счет хаотичного движения молекул (диффузия), или объемов воздуха (турбулентность), в результате чего происходит перенос массы в направлении выравнивания концентрация (против градиентов).
Для учета этих процессов в расширенном уравнении баланса атмосферных газов в правой части добавляются слагаемые, также как и дивергентные имеющие размерность скорости изменения концентрации (мол/см3с):
![]()
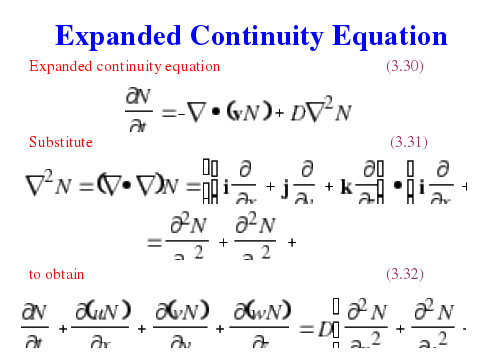
Параметризация химических процессов в моделях газового состава атмосферы
Математическая формулировка задачи базируется на системе уравнений неразрывности многокомпонентной среды при наличии химических реакций:
![]()
где
![]() - вектор отношений смеси рассматриваемых
примесей, N
- число рассматриваемых примесей,
- вектор отношений смеси рассматриваемых
примесей, N
- число рассматриваемых примесей,
![]() - линейный дифференциальный оператор,
описывающий пространственный перенос
примеси, S
- скорость фотохимического изменения,
которая определяется протекающими в
атмосфере процессами фотодиссоциации,
бимолекулярными и трехмолекулярными
химическими реакциями, мономолекулярным
распадом и гетерогенными процессами.
- линейный дифференциальный оператор,
описывающий пространственный перенос
примеси, S
- скорость фотохимического изменения,
которая определяется протекающими в
атмосфере процессами фотодиссоциации,
бимолекулярными и трехмолекулярными
химическими реакциями, мономолекулярным
распадом и гетерогенными процессами.
Отношение смеси представляет собой безразмерную величину, соответственно, размерность источникова члена в правой части уравнения будет с-1 . В химической же кинетике, которая используется для параметризации химических процессов в атмосфере, применяются скорости химических реакций в размерности мол/(см3с). Т.е. химия атмосферы рассматривается в абсолютных единицах, т.к. скорости реакций зависят от концентраций, а не от отношений смеси. Поэтому после параметризации скоростей химических реакций в абсолютных единицах для подстановки в систему уравнений баланса нужно перейти в относительные единицы путем деления на концентрацию воздуха, т.к.
![]()
Реакция фотодиссоциации представляет собой первичный процесс, с которого, по сути, начинаются химические реакции в атмосфере. Фотодиссоциация представляет собой реакцию первого порядка вида:
![]()
Скорость фотодиссоциации Si компоненты с концентрацией Xi описывается, согласно реакцией первого порядка в абсолютных единицах:
![]()
где
Ji
- коэффициент
фотодиссоциации,
![]() концентрация воздуха. Это скорость
разрушения
концентрация воздуха. Это скорость
разрушения
![]() и, одновременно, скорость образования
и, одновременно, скорость образования
![]() и
и
![]() :
:
![]()
Коэффициент фотодиссоциации определяется условиями прохождения солнечной радиации через атмосферу
![]()
где
![]() - длина волны солнечного излучения,
- длина волны солнечного излучения,
![]() -
спектральная область фотодиссоциации
i-й компоненты,
-
спектральная область фотодиссоциации
i-й компоненты,
![]() -
сечения поглощения,
-
сечения поглощения,
![]() -
квантовый выход реакции,
-
квантовый выход реакции,
![]() -
суммарный поток радиации с длиной волны
-
суммарный поток радиации с длиной волны
![]() в данной точке пространства.
в данной точке пространства.
Скорости химических реакций и мономолекулярного распада параметризуются в терминах химической кинетики. При этом скорости бимолекулярных реакций типа
![]()
описываются выражением
![]()
где
![]() - лабораторная константа данной химической
реакции, рассчитываемая по формуле
Аррениуса:
- лабораторная константа данной химической
реакции, рассчитываемая по формуле
Аррениуса:
![]()
Здесь A - лабораторная константа, E - энергия активации данной реакции, R - универсальная газовая постоянная, T - температура.
Более сложным образом описываются скорости протекающих в атмосфере трехмолекулярных реакций типа
![]()
где M - концентрация воздуха. Фактически эти реакции происходят в два бимолекулярных этапа. Сначала происходит реакция образования промежуточного неустойчивого энергизированного (возбужденного) комплекса:
![]()
Далее этот комплекс может или дезактивироваться, или распадся:
![]()
![]()
Реакции такого типа сильно зависят от давления. При низких давлениях время между столкновениями образующегося на первой стадии реакции возбужденного комплекса с дезактивирующей молекулой больше или сравнимо со временем жизни возбужденного комплекса и реакция является тримолекулярной. При высоких давлениях время между столкновениями мало по сравнению со временем жизни возбужденного комплекса и он успевает дезактивироваться до распада. Реакция при этом является бимолекулярной.
Если
скорость реакции образования возбужденного
комплекса обозначить
![]() ,
скорость деактивации -
,
скорость деактивации -
![]() ,
а скорость распада -
,
а скорость распада -
![]() ,
то баланс образующейся компоненты
,
то баланс образующейся компоненты
![]() определяется по формуле
определяется по формуле
![]()
А концентрация возбужденного комплекса определяется их условия равновесия между продукцией и разрушением:
![]()
Откуда можно рассчитать равновесную концентрацию
![]()
С учетом этого скорость трехмолекулярной реакции описывается по аналогии с бимолекулярными реакциями:
![]()
где кр описывается универсальной формулой Линдемана-Хиншельвуда [76]:
![]()
где
![]()
![]()
![]()
а
F0
, A0
,
![]() , n, m -
лабораторные константы данной химической
реакции.
, n, m -
лабораторные константы данной химической
реакции.
Процессы мономолекулярного распада типа
![]()
являются обратными по отношению к трехмолекулярным и рассматриваются как реакции второго порядка и их скорости записываются в виде
![]()
где k определяется по формуле Аррениуса (1.5).
Гетерогенные процессы на атмосферном аэрозоле в фотохимических моделях описываются уравнениями первого порядка:
![]()
Константы гетерогенных реакций ka вычисляются в предположении свободномолекулярного режима.
Таким образом, слагаемые в правой части системы (1.1), выражающие скорости фотохимического изменения рассматриваемых малых газов, можно записать в виде:
![]()
j=1,2,...N,
где члены в правой части с положительным знаком описывают фотохимическую продукцию (за счет химических реакций и фотодиссоциационных процессов), а члены с отрицательным знаком - фотохимическое разрушение (за счет химических реакций, фотодиссоциационных процессов, мономолекулярного распада и гетерогенных процессов).
