
3243
.pdf
G0 |
= |
H 0 |
−T S 0 |
(4.12) |
T |
|
T |
T |
|
HT0 , ST0 вычисляются как соответствующие разности суммы для продуктов и реагентов реакции.
В качестве первого приближения в расчетах |
G0 |
пренебрегают за- |
|||||||
висимостью H 0 |
|
S 0 |
|
|
|
|
|
T |
|
и |
от температуры: |
|
|
|
|
||||
T |
|
T |
|
|
|
|
|
|
|
|
|
|
G0 = H 0 |
−T S 0 |
; |
|
(4.13) |
||
|
|
|
T |
298 |
|
298 |
|
|
|
|
|
|
H2980 |
= ∑ Hпрод0 |
− ∑ H 0реаг ; |
|
|||
|
|
|
S2980 |
= ∑ Sпрод0 |
− ∑ S 0реаг |
|
|||
В точных расчетах величины энтальпии и энтропии реакций вычисляются на основе выражений
HT0 = |
H2980 + ∑Lпрод − ∑ Lреаг + ∑ H ; |
(4.14) |
ST0 = |
S2980 + ∑ L Tпрод − ∑ L Tреаг +∑ S |
, |
где L тепловые эффекты превращений участников реакции; H, S - изменения энтальпии и энтропии реакции в связи с изменением температуры.
|
Так как при превращении любого участника реакции функции зави- |
||
симости H и |
S от температуры изменяются, то расчеты |
G0 прихо- |
|
|
|
|
T |
дится |
выполнять последовательно для интервалов |
температур |
|
298 ÷T2; T2 ÷T3 ; |
и т.д., где 298 – исходная нормальная |
температура, |
|
T2 - |
температура первого превращения какого-либо участника реакции; |
||
T3 - температура второго превращения и т.д.
Расчеты H и S для каждого температурного интервала выполня-
ются на основе формулы Кирхгофа |
|
|
|
|
H = ∫ сpdT ; |
S ∫( |
c p |
T )dT , |
(4.15) |
Температурные функции теплоемкости |
c p , имеют вид |
|
||
cp = a + b 10−3T + |
c′105T −2 , |
(4.16) |
||
21

где a = ∑aпрод − ∑a реаг , b и |
|
c′ рассчитываются также. |
|
|
||||||
Интегрирование (4.15) с учетом (4.16) дает расчетные формулы для |
||||||||||
H и |
S : |
|
|
|
|
|
|
|
|
|
H = a(T |
−T )+ |
b 10−3 (T 2 |
−T 2 ) 2 + |
c′ 105 (T |
−T |
) (T T ); |
(4.17) |
|||
|
2 |
1 |
2 |
|
1 |
2 |
1 |
1 |
2 |
|
S = |
a(lnT |
−lnT )+ |
b 10−3 (T |
|
−T )+ |
c′ 105 (T 2 −T 2 )(2T 2 |
T 2 ) |
(4.18) |
||
|
2 |
1 |
2 |
1 |
2 |
1 |
1 |
2 |
|
|
4.2.Задание
Рассчитать для реакции МеО + СО = Ме + СО2:
1)расход газа на 1 кг металла, м3, кг;
2)энтальпии, энтропии, изобарные потенциалы для интервалов, температур из справочных таблиц 4.6 и 4.7;
3)константы равновесия и равновесные составы для крайних температур каждого температурного интервала;
4)с помощью закона Гесса и известных реакций
2СО + О2 = 2 СО2 |
G0 = −565258 +173,64T |
Дж моль; |
С + 1/2О2 = СО2 |
G0 = −111713 −87,65T |
Дж моль - уравнения |
потенциалов реакции окисления 2Ме + О2 = 2МеО и прямого восстановления МеО + С = Ме + СО;
5)кислородный потенциал реакции для крайних значений каждого температурного интервала.
Построить график зависимости изобарных потенциалов реакции от температуры.
4.3.Пример расчетов
4.3.1. Данные для расчета
Реакция СоО + СО = Со + СО2 Молекулярные массы Со – 59, О – 16, С – 12.
1 кал = 4,184 Дж, G0 = −19,14tgK Дж/ моль.
22
Таблица 4.1 Энтальпии, энтропии и тепловые эффекты фазовых переходов веществ
|
Агре- |
− H2980 , |
S2980 , |
|
|
|
|
|
Вещество |
гатное |
Тпр, |
Lпр, |
Тпл, |
Lпл, |
|||
|
состоя- |
кДж/моль |
кДж/моль |
К |
кДж/моль |
К |
кДж/моль |
|
|
ние |
|
|
|
|
|
|
|
Со |
К |
0 |
30,1±0,4 |
713, |
0,06 |
1765 |
16,3±0,4 |
|
1393 |
0,07 |
|||||||
|
|
|
|
|
|
|||
СоО |
К |
239,2±2,0 |
53,0±0,4 |
1258 |
- |
2078 |
50,3 |
|
СО |
Г |
110,7±0,2 |
197,8±0,9 |
- |
- |
- |
- |
|
СО2 |
Г |
394,1±0,1 |
214,0±0,04 |
- |
- |
- |
- |
Примечание: в справочнике характеристики даны в калориях, в таблице они пересчитаны в джоули.
Таблица 4.2 Коэффициенты зависимости от температуры [2]
Вещест- |
Агрегат- |
c p = a + b 103T + c′ 105T −2 |
Температурный |
|||
во |
ное со- |
|
|
|
интервал |
|
стоя-ние |
а |
b |
с′ |
|||
|
|
|||||
α - Со |
К |
19,86 |
16,76 |
- |
298-713 ф |
|
β - Со |
К |
13,83 |
24,55 |
- |
713-1393 ф |
|
γ - Со |
К |
40,22 |
- |
- |
1393-1765 п |
|
Со |
Ж |
40,56 |
- |
- |
> 1765 |
|
СоС |
К |
48,35 |
8,55 |
1,7 |
298-1865 |
|
СО2 |
Г |
44,20 |
9,05 |
-0,55 |
298-3500 |
|
СО |
Г |
28,45 |
4,11 |
-0,47 |
298-2500 |
|
Примечание: коэффициенты уравнений теплоемкостей пересчитаны из калорий в джоули.
4.3.2. Расчет расхода газа
Расход газа при нормальной температуре Т=298 К определяется из уравненияреакции. На1 мольвосстановленногометалларасходуется1 мольгаза.
59кгСо – 28кгСО или 22,4 м3 СО; 1кгСо – 28/59СО = 0,47кгСО = 0,38 м3СО.
При повышении температуры до 1865 К газ расширяется и его расход в м3 увеличивается. Для расчета расхода используется уравнение состояния идеального газа. Для одного моля газа
23
рV = RT, p = 1 атм, R = 0,082 м3 атм/(К моль) V = RT/p = 0,082 1865 = 153,2 м3.
На 1 кг металла расходуется 153,2/59 = 2,61 м3.
4.3.3.Расчет энтальпий, энтропий и изобарных потенциалов
Всоответствии с уравнениями (4.13)
H2980 = HCo0 + HCO0 2 − HCoO0 − HCO0 =
= 0 −394,1 + 239,2 +110,7 = −44,2 кДж/ моль= −44200 Дж/ моль
Такое количество тепла выделится при восстановлении 1 моля кобальта. При восстановлении 1 кг кобальта выделится
H2980  MCo = −44200/ 59 = −749 Дж/ кг тепла.
MCo = −44200/ 59 = −749 Дж/ кг тепла.
Соответственно для энтропии реакции
S 0 |
=30,1 + 214,0 −53,0 −197,8 = −6,7 Дж/(моль град) |
|||||
298 |
|
|
|
|
|
|
Расчеты H |
0 |
и |
S |
0 |
для характерных температур выполнены на ос- |
|
|
|
T |
|
|
T |
|
нове уравнений (14÷18) с учетом параметров при каждом фазовом превращении каждого компонента системы.
Как видно из табл. 4.2, фазовые превращения имеют место при 713, 1393, 1765 К. Соответственно определены расчетные интервалы температур:
Т2 – Т1 = 713 – 298; а =19,86 + 44,20 − 48,35 − 28,45 = −12,74;
b =(16,76 + 9,05 −8,55 − 4,11)10−3 =13,15 10−3 ; с =(0 −8,55 + 047 −1,7)105 = −9,78 105;
H= −12,74(713 − 298)+13,5(7132 − 2982 )10−3  2 −
2 −
−9,78 105(713 − 298) (298 713)= −5287 + 2759 −1910 = −4439 Дж/ моль
(298 713)= −5287 + 2759 −1910 = −4439 Дж/ моль
S= −12,74(ln713 − ln 298)+13,5 10−3(713 − 298)−
−9,78 105 (7132 − 2982 ) (2 7132 2982 )=
= −11,1 + 5,6 − 0,5 = −6,0 Дж/(моль град)
24

Т2 – Т1 = 1393 – 713; а =13,83 + 44,20 − 48,35 − 28,45 = −18,77 ;
b =(24,55 + 9,05 −8,55 − 4,11)10−3 = 20,94 10−3 ; с = −9,78 105 ;
H= −18,77(1393 −713)+ 20,94(13932 − 7132 )10−3 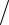 2 −
2 −
−9,78 105(1393 −713)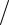 (713 1393)= −12764 +14994 − 670 =1560 Дж/ моль
(713 1393)= −12764 +14994 − 670 =1560 Дж/ моль
S= −18,77(ln1393 − ln713)+ 20,94 10−3(1393 − 713)−
−9,78 105 (13932 − 7132 ) (2 7132 13932 )=
= −12,6 +14,2 − 0,1 =1,5 Дж/(моль град)
Т2 – Т1 = 1765 – 1393; а = 40,22 + 44,20 − 48,35 − 28,45 =7,62 ;
b =(0 +9,05 −8,55 − 4,11)10−3 = −3,6110−3; с = −9,78 105 ;
H= 7,62(1765 −1393)−3,61(17652 −13932 )10−3 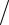 2 −
2 −
−9,78 105(1765 −1393)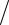 (1393 1765)= 2835 − 2120 −148 =567 Дж/ моль
(1393 1765)= 2835 − 2120 −148 =567 Дж/ моль
S= 7,62(ln1765 − ln1393)−3,6110−3(1765 −1393)−
−9,78 105 (17652 −13932 ) (2 17652 13932 )=
= −1,8 −1,3 − 0,1 =0,4 Дж/(моль град)
Т2 – Т1 = 1865 – 1765; а = 40,56 + 44,20 − 48,35 − 28,45 = 7,96 ;
b = −3,6110−3 ; с = −9,78 105 ;
H= 7,96(1865 −1765)−3,61(18652 −17652 )10−3  2 −
2 −
−9,78 105(1865 −1765) (1765 1865)= 796 − 655 −30 =111 Дж/ моль
(1765 1865)= 796 − 655 −30 =111 Дж/ моль
S= 7,96(ln1865 −ln1765)−3,6110−3(1865 −1765)−
−9,78 105 (18652 −17652 ) (2 18652 17652 )=
= 0,5 − 0,4 −0,2 = 0,1 Дж/(моль град)
Окончательные расчеты выполнены в табл. 4.3 25
Таблица 4.3 Расчет энтальпии, энтропии и изобарных потенциалов реакции
для различных температур
|
Модифи- |
|
HT0 , |
|
S L T , |
|
0 |
|
GT0 , |
|
Темпера- |
кация |
H, L |
|
Дж |
|
|
ST , |
|
||
тура, |
реаген- |
Дж/моль |
Дж/моль |
|
|
|
Дж |
|
Дж/моль |
|
К |
|
моль град |
|
|||||||
тов |
|
|
|
|
моль град |
|
||||
298 |
αСо |
- |
- 44200 |
|
- |
|
- 6,7 |
|
- 42203 |
|
713 |
αСо |
- 4439 |
- 48639 |
|
- 6,0 |
|
- 12,7 |
|
- 39584 |
|
713 |
βСо |
60 |
- 48579 |
|
0,1 |
|
- 12,6 |
|
- 39595 |
|
1393 |
βСо |
1560 |
- 4719 |
|
1,5 |
|
- 11,1 |
|
- 31557 |
|
1393 |
γСо |
70 |
- 46949 |
|
0,1 |
|
- 11,0 |
|
- 31626 |
|
1765 |
γСо |
567 |
- 46382 |
|
0,4 |
|
- 10,6 |
|
- 27673 |
|
1765 |
Сож |
16300 |
- 30082 |
|
9,2 |
|
- 1,4 |
|
- 27611 |
|
1865 |
Сож |
111 |
- 29981 |
|
0,1 |
|
- 1,3 |
|
- 27556 |
|
На основе данных таблицы 4.3 по значениям нижних температур соответствующих интервалов составлена таблица 4.4 уравнений изобарных потенциалов реакций.
|
|
|
Таблица 4.4 |
|
|
|
|
|
|
Температурный интервал |
Уравнения реакции |
Уравнения изобарных |
||
потенциалов, Дж/моль |
|
|||
|
|
|
|
|
298 |
- 713 |
CoO + CO =Co + CO2 |
- 44200 + 6,7 Т |
|
713 - 1393 |
CoO + CO =Co + CO2 |
- 48579 + 12,6 Т |
|
|
1393 |
- 1765 |
CoO + CO =Co + CO2 |
- 46949 + 11 Т |
|
1765 |
- 1865 |
CoO + CO =Coж +CO2 |
- 30082 + 1,4 Т |
|
Из табл. 4.3 и 4.4 видно, что окись углерода может восстанавливать кобальт из окислов, причем восстановительная способность окиси углерода с ростом температуры падает.
G = −RT lg K = −19,14T lg K
4.3.4.Расчет констант равновесия и равновесных составов газовой фазы
Большая величина Кр свидетельствует о большой полноте протекания реакции. Полнота протекания реакции быстро уменьшается с ростом температуры и при 1765 К равновесная газовая фаза уже состоит из 13 % СО и 87 % СО2.
26
Таблица 4.5 Константы равновесия реакции и равновесные составы газовой фазы
Темпера- |
Уравнение, |
lg K p |
K p |
Рсо, атм |
Pco2 , атм |
|
турный ин- |
lg K p |
|||||
тервал |
|
|
0,40 10-7 |
|
||
298 |
- 713 |
2309/Т – 0,35 |
7,40 |
2,51 107 |
1,0 |
|
713 - 1393 |
2538/Т – 0,66 |
2,90 |
7,91 102 |
0,13 10-2 |
1,0 |
|
1393 |
- 1765 |
2453/Т – 0,57 |
1,19 |
1,55 10 |
0,61 10-1 |
0,94 |
1765 |
- 1865 |
1572/Т – 0,07 |
0,82 |
6,61 |
0,13 |
0,87 |
4.3.5.Расчет изобарных потенциалов окисления
ипрямого восстановления кобальта
Расчёт уравнения изобарного потенциала реакции 2Со + О2 = 2СоО выполнен на основе закона Гесса
|
2СО + О2 = 2 СО2 ; |
|
G0 = −565258 +173,64T |
Дж моль; |
||||
|
2СоО + 2СО = 2Со + 2СО2 ; |
G0 = −93898 + 22,00T |
||||||
|
2Со + О2 = 2 СоО |
|
; |
G0 |
= −471360 +151,64T |
Дж моль |
||
|
|
|
|
T |
|
|
|
|
|
Со + 1/2О2 = СоО |
; |
|
G0 |
= −235680 + 75,82T |
Дж моль |
||
|
|
|
|
γ |
|
|
|
|
|
Аналогичным образом выполнен расчет изобарного потенциала ре- |
|||||||
акции прямого восстановления кобальта |
|
|
|
|||||
|
С + 1/2О2 = СО ; |
|
G |
0 = −11713 −87,65T |
Дж моль |
|||
|
|
|
T |
|
|
|
|
|
|
Со + 1/2О2 = СоО |
; |
|
G0 |
= −235680 + 75,82T |
Дж моль |
||
|
|
|
|
γ |
|
|
|
|
|
СоО + С= Со + СО |
; |
|
GT =123967 −163,47T |
Дж моль |
|||
Температура равновесия или начала прямого восстановления найде-
на из условия |
G0 = 0 |
T
123967 – 163,47Т = 0; Т = 758 К
27

4.3.6. Расчет кислородного потенциала
Кислородный потенциал определяется равновесной концентрацией кислорода, π0 = RT ln po2 .в рассчитываемой реакции определенная, одна и
та же концентрация кислорода соответствует определённому отношению pco2  pco и G0 в соответствии с реакциями
pco и G0 в соответствии с реакциями
2СО + О2 = 2СО2 , |
K p = |
(pco2 pco )2 |
|
, |
|
|
|||||||||
|
|
po2 |
|
|
|||||||||||
|
|
|
(pco2 pco )2 |
|
|
|
|
|
|
||||||
po2 |
|
K p , π0 = RT ln po2 = |
2RT ln(pco2 pco )+ |
0 |
, |
||||||||||
= |
|
|
|
|
|
Gco2 |
|||||||||
2Со + О2 = 2 СоО, |
K p = 1 |
po2 |
|
|
|
|
|||||||||
|
|
|
1 |
|
|
|
|
|
|
|
|
+ G0 . |
|
|
|
p |
o2 |
= |
K p |
, π |
0 |
= RT ln p |
o2 |
= −RT ln K |
p |
|
|
||||
|
|
|
|
|
|
|
|
CoO |
|
|
|||||
В таблице 4.6 с помощью закона Гесса рассчитаны изобарные и кислородные потенциалы.
|
Кислородные потенциалы реакций |
|
Таблица 4.6 |
||||
|
|
|
|
||||
Температура |
Реакция |
G0 |
, Дж/ моль |
π |
0 |
, Дж/ моль |
|
|
|
CoO |
|
|
|
|
|
298 |
2αСо+О2=2СоО |
- 476858+160,24 Т |
|
|
- 429106 |
|
|
713 |
2βСо+О2=2СоО |
- 468100+149,44 Т |
|
|
- 361549 |
|
|
1393 |
2γСо+О2=2СоО |
- 471360+151,64 Т |
|
|
- 260125 |
|
|
1765 |
2Сож+О2=2СоО |
- 505094+170,84 Т |
|
|
- 203561 |
|
|
Из таблицы видно, что для реакции восстановления кобальта характерны низкие величины кислородного потенциала, что и способствует протеканию реакции.
4.3.7. График зависимости изобарных потенциалов от температуры
График представлен на рис. 4.1. Он характеризует полноту восстановления кобальта в зависимости от температуры. На графике также представлены изобарные потенциалы реакций окисления кобальта и углерода. Разные углы наклона соответствующих линий обусловливают прямое восстановление кобальта. Температура начала прямого восстановления соответствует на графике точке пересечения линий изобарных потенциалов кобальта и углерода. Линия изобарного потенциала окисления кобальта одновременно характеризует кислородный потенциал.
28
Контрольные вопросы
1.Задачи, решаемые термодинамикой.
2.Уравнение и физический смысл I-го закона термодинамики.
3.Уравнение и физический смысл 2-го закона термодинамики.
4.Объединенная формула первого и второго законов термодинамики.
5.Понятие об изобарно-изотермическом потенциале.
6.Изменение изобарного потенциала в самопроизвольных процессах.
7.Связь между изобарным потенциалом и концентрацией вещества.
8.Связь между изобарным потенциалом и константой равновесия.
9.Анализ процессов и реакций с помощью изобарного потенциала.
10.Способы расчета изобарного потенциала.
11.Расчет энтальпии как функции температуры.
12.Расчет энтропии как функции температуры.
Литература
1.Курс лекций по теории металлургических процессов.
2.Рузинов Л.П., Гуляницкий Б.С. Равновесные превращения металлургических реакций. – М.: Металлургия, 1975, 416 с.
29
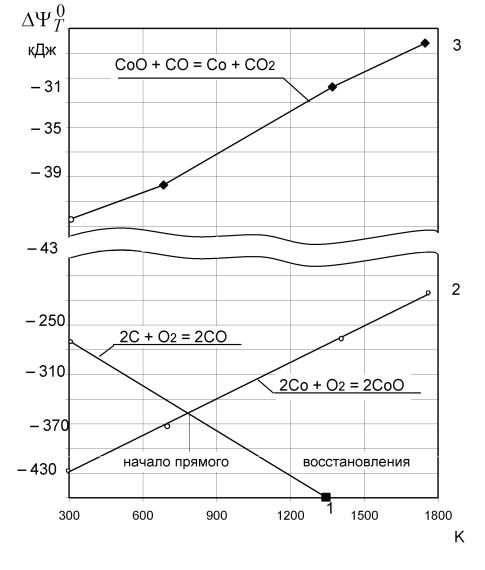
Рис. 4.1. График зависимости изобарных потенциалов реакций от температуры.
30
