
154эл
.pdfгде T1 - температура нагревателя; T2 - температура холодильника.
Термодинамический процесс называется обратимым, если он может происходить как в прямом направлении ( A 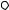 pdV 0 ), так и
pdV 0 ), так и
в обратном направлении ( A 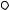 pdV 0 ), без каких-либо изменений в
pdV 0 ), без каких-либо изменений в
окружающей среде и самой системе. Процесс, не удовлетворяющий этим условиям является необратимым.
Энтропия S - функция состояния, которая определяется параметрами состояния системы и не зависит от пути, каким система пришла в это состояние.
Энтропия замкнутой системы может либо возрастать (в случае необратимых процессов), либо оставаться неизменной (в случае обратимых процессов):
S 0. (75)
Изменения энтропии при равновесном переходе системы из состояния 1 в состояние 2:
2 |
|
2 |
|
|
S |
Q |
dU A |
. (76) |
|
1 |
T |
1 |
T |
|
|
|
|
||
2.3. Примеры решения задач
Пример 1. В баллоне объемом V 10 10 3 м3 находился гелий под давлением p1 1 МПа при температуре T1 300 К. После того как из
баллона был израсходован гелий массой m 0,01 кг, давление в баллоне понизилось до p2 0,364 МПа. Определить среднюю
кинетическую энергию 
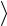 поступательного движения молекулы гелия оставшейся в баллоне.
поступательного движения молекулы гелия оставшейся в баллоне.
Решение. Средняя кинетическая энергия поступательного движения молекулы определяется формулой:
31

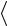
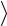 32 kT ,
32 kT ,
где k - постоянная Больцмана.
Для нахождения температуры воспользуемся уравнением состояния идеального газа для начального и конечного состояния газа:
p V m1 |
RT , |
p V |
m2 |
RT , |
||
|
||||||
1 |
|
1 |
2 |
2 |
||
где m1 и m2 |
- масса гелия в начальном и конечном состоянии. |
|||||||||||||||||||||
m p1V , |
|
|
m p2V . |
|
|
|||||||||||||||||
1 |
|
|
RT1 |
|
|
|
|
|
|
2 |
|
|
RT2 |
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
Масса израсходованного гелия: |
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
V |
|
|
p2 |
|
|
|
|
||||||
m m1 m2 |
|
|
|
p1 |
|
|
|
|
|
|
||||||||||||
|
R |
|
|
T |
|
|
||||||||||||||||
T |
. |
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
1 |
2 |
|
|
|
|
||||||
|
|
Из последнего уравнения найдем температуру T2 : |
||||||||||||||||||||
T2 |
|
|
p2VT1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
p V mRT |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
1 |
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
3 |
|
|
p2VT1 |
|
|
|
|
|
|
|
|
||||||||||
|
|
2 k |
|
|
|
. |
|
|
|
|
|
|
|
|
||||||||
p V |
mRT |
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
1 |
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
||
|
|
Подставляя численные значения, получим: |
||||||||||||||||||||
|
3 |
1,38 10 23 106 |
|
|
|
|
|
|||||||||||||||
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6,13 10 |
21 |
Дж. |
|||
|
1 106 |
|
|
1 10 2 |
8,31 |
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
300 |
|
4 10 3 10 10 3 |
|
|
|||||||||||||||||
|
|
|
|
|
|
|||||||||||||||||
32

Пример 2. Барометр в кабинете летящего самолета все время показывает одинаковое давление p 79 кПа, благодаря чему летчик
считает высоту h1 полета неизменной. Однако температура воздуха за бортом самолета изменилась с T 278 К до T 274 К. Какую ошибку h в определении высоты допустил летчик? Давление p0 у поверхности Земли считать нормальным.
Решение. Для решения задачи воспользуемся барометрической
формулой: |
p p0 e |
|
g h |
|
RT . Барометр может показывать неизменное |
давление при различных температурах T1 и T2 за бортом только в том случае, если самолет находился не на высоте h1 (которую летчик считает неизменной), а на некоторой другой высоте h2 .
|
|
e |
g h1 |
|
|
|
|
|
e |
g h2 |
|
|
|
|
p p |
0 |
RT1 , |
p |
2 |
p |
0 |
RT2 , |
p p |
2 |
p . |
||||
1 |
|
|
|
|
|
|
|
|
1 |
|
||||
Найдем отношение pp0 и обе части полученного равенства прологарифмируем:
ln |
p0 |
|
|
g h1 ; |
ln |
p0 |
|
g h2 . |
|||||||||
p |
p |
||||||||||||||||
|
|
|
RT |
|
|
|
|
|
|
|
|
RT |
|||||
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
Из полученных соотношений выразим высоты h1 и h2 , и найдем |
||||||||||||||
их разность: |
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
R |
|
|
p |
0 |
|
|
|
||||
h h |
h |
|
|
|
|
ln |
|
|
|
T |
T . |
||||||
|
|
|
|
|
|
|
|||||||||||
|
|
2 |
1 |
|
g |
|
|
p |
2 |
1 |
|||||||
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
Подставляя численные значения, получим: |
||||||||||||||
|
|
|
|
101 |
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
8,31 ln |
79 |
|
|
|
|
|
|
|
|
|
|
|||
h |
|
|
|
|
1 5 28,5 м. |
||||||||||||
|
29 10 3 |
9,8 |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||
33
Самолет находился ниже на 28,5 м по сравнению с начальной высотой h1 .
Пример 3. Средняя длина свободного пробега молекулы углекислого газа при нормальных условиях  l
l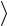 40 нм. Определить среднюю
40 нм. Определить среднюю
арифметическую скорость 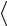 v
v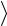 молекул и число соударений
молекул и число соударений  Z
Z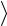 , которое испытывает молекула за 1 с.
, которое испытывает молекула за 1 с.
Решение. Средняя арифметическая скорость молекулы определяется по формуле:
v |
|
|
|
8 R T . |
|
||||
|
|
|
|
|
|
|
|||
|
|
Подставляя численное значение, получим: |
|||||||
v |
|
|
|
|
8 8,3 293 |
362 м. |
|||
|
|
3,14 44 10-3 |
|||||||
|
|
|
|
с |
|||||
|
|
Среднее число соударений в 1 с: |
|||||||
Z |
|
|
v |
|
|
362 |
|
9,05 109 с-1. |
|
|
l |
|
40 10 9 |
||||||
|
|
|
|
|
|
||||
Пример 4. Кислород массой m 2 кг занимает объем V1 1 м3 и находится под давлением p1 0,2 МПа. Был нагрет сначала при постоянном давлении до объема V2 3 м3, а затем при постоянном объеме до давления p2 0,5 МПа. Найти изменение U внутренней энергии газа, совершенную им работу A и теплоту Q , переданную газу.
34

Решение. Построим график процесса (рис. 2.4). На графике точками 1, 2, 3 обозначим состояние газа, характеризуемое параметрами ( p1 , V1, T1 ), ( p1 , V2 , T2 ), ( p2 , V2 , T3 ).
Изменение внутренней энергии газа
U CV m T1 2i R T1 ,
где i - число степеней свободы молекул газа (для кислорода i 5);
T1 T3 |
T1 |
- |
разность |
температур |
газа |
в |
конечном |
(третьем) и начальном состояниях. |
|
|
|
Работа расширения газа при постоянном давлении выражается формулой:
A p V2 V1 .
Из уравнения Менделеева-Клапейрона:
pV m RT , |
pV m RT , |
pV |
m RT , |
||
|
|
1 |
1 |
2 |
2 |
A |
m R T , |
|
|
|
|
12 |
|
2 |
|
|
|
где T2 T2 T1 - разность температур при постоянном давлении.
Воспользовавшись уравнением Менделеева-Клапейрона, определяем температуру:
T pVmR .
Работа газа, нагреваемого при постоянном объеме равна нулю
35
A2 3 0.
Полная работа, совершаемая газом
A A1 2 A2 3 A1 2 ,
тогда согласно первому началу термодинамики:
Q U A.
Подставляя численные значения, получим:
T |
|
2 |
103 1 32 10 3 |
385 К; |
|
1 |
|
|
2 8,31 |
|
|
|
|
|
|
||
T |
|
2 |
103 |
3 32 10 3 |
1155 К; |
2 |
|
|
2 |
8,31 |
|
|
|
|
|
||
T |
|
5 |
103 |
3 32 10 3 |
2887 К; |
3 |
|
|
2 |
8,31 |
|
|
|
|
|
||
A A1 2 8,31 2 1155 385 0,4 106 Дж = 0,40 МДж; 32 10 3
U |
5 |
8,31 2 2887 385 |
|
3,24 106 Дж = 3,24 МДж; |
|
2 |
32 10 3 |
|
|
Q 3,24 0,4 106 3,64 106 |
Дж = 3,64 МДж. |
|||
Пример 5. Вычислить удельные теплоемкости cV и cp смеси неона и
водорода, если масса неона |
m 11 10 3 |
кг и водорода m 21 10 3 |
|
1 |
2 |
кг. |
|
|
Решение. Удельные теплоемкости идеальных газов находятся по формулам:
36

c |
|
i |
R и c |
p |
i 2 R |
, |
|
|
|||||||
V |
|
2 |
2 |
|
|
||
|
|
|
|
||||
где i |
- число степеней свободы молекул газа; |
||||||
|
|
- молярная масса. |
|
||||
Для неона i 3 - одноатомный газ, 20 10 3 молькг .
|
Для водорода i 5 |
- двухатомный газ, 2 10 |
3 |
кг |
. |
|||||||||||||||||||||||||||||
|
|
моль |
||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
cнеона |
3 |
|
|
|
8,31 |
|
6,24 102 |
|
|
|
Дж |
, |
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
V |
|
2 |
|
|
20 10 3 |
|
|
|
|
|
|
|
кг К |
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
неона |
|
3 |
2 |
|
|
|
|
8,31 |
|
|
|
|
|
|
|
3 Дж |
|
|
|
|
|
|
||||||||||||
cp |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1,04 10 |
|
|
|
|
|
|
|
|
, |
|
|
|
|
||||||
|
2 |
20 |
10 3 |
|
|
кг |
|
К |
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
cводорода |
|
5 |
|
|
8,31 |
1,04 104 |
|
|
|
Дж |
, |
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
V |
|
|
|
2 |
|
2 10 3 |
|
|
|
|
|
|
кг К |
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
водорода |
|
|
5 2 |
|
|
|
8,31 |
|
|
|
|
|
|
|
|
4 |
|
Дж |
|
|
|
|
||||||||||||
cр |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1,46 |
10 |
|
|
|
|
|
|
|
|
. |
|
|
|
||||
|
|
2 |
|
|
2 10 3 |
|
|
кг К |
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
Для |
|
|
нахождения |
|
удельной |
|
|
|
теплоемкости cV |
смеси при |
|||||||||||||||||||||||
постоянном объеме теплоту, необходимую для нагревания смеси наT , выразим и с другой стороны
Q cVнеонаm1 cVводородаm2 T .
cV m1 m2 T cVнеонаm1 cVводородаm2 T
cV m1 m2 cVнеонаm1 cVводородаm2
c |
cнеона |
|
m1 |
cводорода |
|
m2 |
V |
V |
m1 |
m2 |
V |
m1 |
m2 |
|
|
|
m1 1 - массовая доля неона, m1 m2
37

|
|
m2 |
2 |
- массовая доля водорода. |
|
|
|
|
|
|
|
|
|||||||||||||||
m1 m2 |
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
c |
|
6,24 102 |
|
11 10 3 |
1,04 104 |
|
21 10 3 |
|
7,025 103 |
Дж |
. |
||||||||||||||||
|
|
11 21 10 3 |
11 21 10 3 |
|
|||||||||||||||||||||||
V |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
кг К |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
Аналогично |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
c |
|
cнеона |
|
m1 |
c |
водорода |
|
m2 |
|
|
|
1,04 |
103 |
|
11 10 3 |
|
|
|
|||||||||
|
m |
m |
|
|
|
m |
m |
|
|
11 21 10 3 |
|
|
|||||||||||||||
|
p |
p |
|
|
|
|
p |
|
2 |
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
1 |
2 |
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|||||||
1,46 10 |
4 |
|
|
21 10 3 |
|
9,94 10 |
3 |
|
|
Дж |
. |
|
|
|
|
|
|
|
|||||||||
|
11 21 10 3 |
|
|
кг К |
|
|
|
|
|
|
|
||||||||||||||||
Пример 6. Тепловая машина работает по обратному циклу Карно. Температура теплоотдатчика T1 500 К. Определить термический
КПД и температуру T2 теплоприемника тепловой машины, если за
счет каждого килоджоуля теплоты, полученной от теплоотдатчика, машина совершает работу A 350 Дж.
Решение. Термический КПД тепловой машины показывает, какая доля теплоты, полученной от теплоотдатчика, превращается в механическую работу
A ,
Q1
где Q1 - теплота полученная от теплоотдатчика;
A- работа совершенная рабочим телом тепловой машины.
1000350 0,35.
КПД цикла Карно
38
T1 T2 . T1
Следовательно
T2 T1 1 .
Произведем вычисление
T2 500 1 0,35 325 К.
Пример 7. Найти изменение S энтропии при нагревании воды от температуры T1 273 К до температуры T2 373 К.
Решение. Изменение энтропии выражается общей формулой
S S2 S1 2 Q .
1 T
При бесконечно малом изменении dT температуры нагреваемого тела количество теплоты
Q mcdT ,
где m - масса тела;
c - его удельная теплоемкость.
T |
|
T |
S 2 mcdT |
mc 2 dT . |
|
T |
T |
T T |
1 |
1 |
|
S mc ln T2 . T1
Подставляя численные значения, получим:
S 100 10 3 2,1 103 ln |
373 |
132 |
Дж . |
|
273 |
|
К |
39
3.Задачи для самостоятельного решения
3.1Кинематика поступательного движения
Радиус-вектор:
3.1.1 Радиус-вектор материальной точки изменяется со временем по |
|||
|
3 |
2 |
|
закону r t |
i 3t |
|
j , где i, j- орты осей x и y. Определите для |
момента времени |
|
t 1 c: 1) модуль скорости; 2) модуль ускорения. |
|
3.1.2 Радиус-вектор материальной точки изменяется со временем по |
|||||||
закону |
|
(2 3t 5t |
3 |
|
(4 4t |
4 |
) j 3tk . Найти зависимость от |
r |
|
)i |
|
||||
времени векторов скорости и ускорения и модулей этих величин для момента времени t = 1 c.
3.1.3 |
Материальная точка движется в плоскости XY со скоростью |
||
|
|
|
|
|
3i |
5tj . В начальный момент времени координаты частицы x0 = 3 |
|
м |
и y0 = 1 м. Найти зависимость от времени радиуса-вектора r точки |
||
и уравнение траектории y(x). Вектор ускорения и модуль вектора для момента времени t = 4 c.
3.1.4 |
|
Ускорение |
материальной точки изменяется по закону |
|||
|
2t |
3 |
|
|
3k . |
Найти, на каком расстоянии от начала координат |
a |
|
i |
4tj |
|||
она будет находиться в момент времени t = 2 с, если 0х = 1 м/с, 0y = 4 м/с, 0z = 5 м/с и r0x = 0, r0y = 1 м, r0z =3 м при t = 0.
3.1.5 |
Движение материальной |
точки |
задано |
|
уравнением |
|
r A(i cos t j sin t), где |
A 1 |
м и ω = |
5 рад/с. |
Начертить |
||
|
|
|
|
|
| |
и модуль |
траекторию точки. Определить модуль скорости | |
||||||
нормального ускорения | an |. |
|
|
|
|
|
|
Связь пути, скорости, ускорения:
3.1.6 Зависимость пройденного телом пути s от времени t дается уравнением s At 2 Bt 2 Ct 3 , где А = 2 м/с, В = 3 м/с2 и С = 4 м/с3.
Найти: 1) зависимость скорости и ускорения a от времени t, 2) расстояние, пройденное телом, скорость и ускорение тела через 2 с после начала движения. Построить график пути, скорости и ускорения для 0 t 3 c через 0,5 с.
40
