
ЛАБОРАТОРНЫЕ РАБОТЫ
.pdf
|
|
|
|
|
) |
(k) |
|
|
|
|
|
мл |
2 |
|
|
|
|
|
О |
|
|
|
|
мл) |
|
, |
2 |
|
|
|
|
τ |
||
№пп/ измерения |
Времяначалаот реакции (τ,мин) |
Объем выделившегося кислорода временико τ |
, |
Полныйобъемкислорода в опытаконце (V,мл) |
Разницамежду полнымобъемом кислородавыдеилившимсявремекони τ (VV– |
Значениеконстанты скоростиреакции разложенияН |
τ |
||||||
(V |
||||||
|
|
|
|
|
|
|
Сохраняется ли значение константы скорости постоянным во времени? Какова размерность константы скорости реакции первого порядка?
Нанесите на график зависимость константы скорости реакции от времени протекания опыта. Рассчитайте период полураспада рассматриваемой реакции, воспользовавшись уравнением (11.10). Постоянно ли это значение?
11.3Вопросы для самоконтроля
1.Какие факторы влияют на скорость химической реакции? Чем измеряется скорость химической реакции?
2.Сформулируйте закон действующих масс. Напишите кинетическое уравнение химической реакции в общем виде.
3.Что называется порядком химической реакции по отдельным компонентам? Чем определяется общий порядок химической реакции?
4.Что такое отдельная стадия химической реакции?
5.Дайте понятие «молекулярность реакции». Связан ли порядок реакции с молекулярностью?
6.Дайте определение константы скорости химической реакции.
7.На основании каких критериев определяется размерность константы скорости реакции? Приведите размерности константы скорости для реакции первого и второго порядков.
8.Что такое катализ? Каким бывает катализ? Назовите особенности гомогенного катализа. Приведите примеры гетерогенного катализа.
9.Как повысить эффективность использования гетерогенного катализатора? Почему ускоряется реакция в присутствии катализатора?
71
ТЕМА 12. ХИМИЧЕСКОЕ РАВНОВЕСИЕ
Цель работы: научиться экспериментальными методами исследовать влияние различных факторов на смещение равновесия химических реакций.
12.1 Теоретическая часть
Все химические реакции можно разделить на два вида – односторонние (необратимые) и двусторонние (обратимые). Двусторонними, или обратимыми, называются такие реакции, которые одновременно протекают в двух противоположных направлениях. Знак равенства между исходными веществами и продуктами реакции в обратимых реакциях заменяется на знак «↔», т. е. на знак, указывающий, что реакция протекает в двух направлениях. Так, уравнение обратимой реакции в общем виде можно записать
aА + bВ ↔ dD + eE.
Согласно закону действующих масс скорость прямой реакции выразится следующим кинетическим уравнением:
Wпр. = k · Ca Cb .
A B
А скорость обратной реакции –
Wобр. = k׳ · Cd Ce .
D E
Скорость прямой реакции с течением времени уменьшается, а скорость обратной – увеличивается. По истечению некоторого промежутка времени, скорости двух противоположно направленных реакций выравниваются. Такое состояние получило название состояния динамического равновесия. При таком состоянии протекание реакций не прекращается, а только уравниваются их скорости. Исходя из этого, запишем
Wпр. = Wобр. или k · Ca Cb = k׳ · Cd |
Ce . |
||||||
|
|
|
|
A B |
D |
E |
|
После перенесения постоянных величин в левую часть уравнения, |
|||||||
а переменных в правую получим |
|
|
|
|
|
|
|
|
|
|
d |
e |
|
|
|
|
k |
|
СD |
CE |
. |
|
(12.1) |
|
k' |
|
|
|
|||
|
|
Ca Cb |
|
|
|||
|
|
|
A |
B |
|
|
|
Отношение двух постоянных величин |
(констант скорости прямой |
||||||
и обратной реакций) k/k׳ равняется третьей постоянной величине, получившей название константы равновесия (К). В уравнении (12.1), которое
72
описывает равновесное состояние реакции, изменяется запись выражения самих концентраций. Значок концентрации (С) заменяется квадратными скобками, внутри которых помещается символ вещества. Претерпевают изменение и значения порядков реакции по каждому из компонентов. Для равновесных процессов показатели степеней при равновесных концентрациях становятся равными значениям стехиометрических коэффициентов из уравнения химической реакции. Так для приведенной выше реакции выражение константы равновесия будет иметь вид
К = |
k |
|
D d E e |
, |
(12.2) |
|
k' |
A a B b |
|||||
|
|
|
|
где [A], [B], [D] и [E] – равновесные концентрации веществ А, В, D и Е. Величины показателей степеней a, b, e и d при равновесных концентрациях равны значениям стехиометрических коэффициентов в уравнении химической реакции. Необходимо обратить внимание на то, что в выражении для константы равновесия К показатели степеней при концентрациях реагентов совпадают со стехиометрическими коэффициентами химического уравнения, а для скоростей прямой и обратной реакций эти показатели обычно определяются порядками реакций по этим компонентам. Различие в величинах показателей степеней объясняется тем, что в выражениях скорости прямой и обратной реакций значения показателей
степеней определяются исходя из элементарного акта самой медленной стадии реакции, т. е. только какой-то частью этих реакций. Когда же реакция достигает состояния равновесия, тогда скорость прямого и обратного процессов измеряется уже не отдельными стадиями, а совокупностью всех стадий. Поэтому и показатели степеней должны совпадать с коэффициентами уравнения химической реакции.
Влияние природы реагирующих веществ на константу равновесия можно видеть исходя из уравнения
lnK = – ΔG/(RT).
Величина энергии Гиббса рассчитывается с использованием термодинамических параметров веществ, участвующих в реакции, и зависит от их природы. Таким образом, если ΔG < 0 (т. е. реакция протекает самопроизвольно) значение К будет больше единицы. Если же ΔG > 0, то значение К будет меньше единицы. Но значение константы равновесия не должно быть отрицательным. Учитывая, что
ΔG = Но – ТΔSо, получим lnK = – Но /(RТ) + ΔSо/R.
Уравнение (12.2) отражает закон действующих масс для равновесных процессов. Величина константы равновесия зависит от природы реагиру-
73
ющих веществ и не зависит от их концентрации. Из приведенного уравнения видно, что величина К отражает зависимость констант прямой и обратной реакций. Поэтому, если К > 1, то скорость прямой реакции больше, а если К < 1, то, наоборот, больше скорость обратной реакции. При К = 1 скорости противоположно направленных реакций становятся равными.
Из приведенного уравнения также видно, что состояние химического равновесия зависит от концентрации реагентов. Если концентрацию хотя бы одного из реагентов изменить, то равновесие будет нарушаться. Концентрации всех реагентов будут изменяться до тех пор, пока отношение произведения концентраций продуктов реакции к произведению концентраций исходных веществ не станет равным величине константы равновесия для данной температуры. Таким образом, в системе наступит новое равновесное состояние, но уже при других равновесных концентрациях.
Переход системы из одного равновесного состояния в другое назы-
вается смещением или сдвигом химического равновесия. Это явление подчиняется принципу Ле Шателье: если на систему, находящуюся в состоянии химического равновесия, воздействовать извне изменением концентрации, температуры или давления (для систем с участием газов), то равновесие сместится в сторону, уменьшающую это воздействие. Например, если в равновесном состоянии изменить концентрацию одного или всех исходных веществ, то равновесие в системе будет смещаться в сторону расходования этих компонентов. При уменьшении концентрации какого-либо компонента равновесной системы равновесие будет смещаться в сторону увеличения концентрации этого вещества.
Из принципа Ле Шателье следует, что повышение температуры смещает равновесие в сторону эндотермической реакции, а понижение – в сторону экзотермической. Кроме того, с изменением температуры изменяется и величина константы равновесия.
Катализаторы не смещают химическое равновесие. Они на одинаковую величину увеличивают скорость прямой и обратной реакции. Поэтому состояние динамического равновесия с участием катализатора достигается за более короткое время.
Для систем с участием газов в выражении константы равновесия можно использовать как концентрации, так и парциальные давления компонентов. Так, например, константа равновесия реакции взаимодействия водорода и азота с образованием аммиака (N2 + 3H2 = 2NH3) может быть записана так
КС = |
k |
|
NH3 2 |
или КР = |
k |
|
PNH2 |
3 |
. |
|
k' |
N2 H2 3 |
k' |
P |
P3 |
||||||
|
|
|
|
|
|
|
N2 |
|
H2 |
|
74
Естественно, что абсолютные значения величин констант равновесия будут разные. Чтобы отличать, какие исходные данные были использованы для расчета констант равновесия, применяют условное обозначение КС (с использованием значений концентраций) и КР (с использованием значений парциальных давлений). Между КС и КР для реакций с участием газов существует взаимосвязь, которая выводится с применением уравнения Клапейрона–Менделеева.
КР = КС(RT)Δν,
где Δν – разность между числом молей газообразных продуктов реакции и исходных веществ.
Необходимо помнить, что в выражение для константы равновесия не входят концентрации (парциальные давления, мольные доли) веществ, находящихся в конденсированном состоянии. Например, константа равновесия реакции разложения СаСО3, которая осуществляется по схеме
СаСО3 (к) ↔ СаО (к) + СО2 (г), равна КР = РСО2.
Исходя из этого, константы равновесия некоторых известных процессов принимают необычный вид. К таким особым случаям констант равновесия можно отнести
1) |
константу диссоциации воды |
|
|
|
|||
|
2Н2О (ж) ↔ Н3О+ + ОН–; КW = [H3O+]·[OH–] = 1·10–14, |
||||||
2) |
произведение растворимости (ПР) |
|
|
||||
|
BaSO4 (к) ↔ Ba2+ + SO42–; ПРBaSO4= [Ba2+] · [SO42–], |
|
|||||
3) |
константа гидролиза (Кг) |
|
|
|
|
|
|
|
2– |
+ Н2О (ж) ↔ НСО3 |
– |
– |
; Кг = |
НСО3 ОН |
. |
|
СО3 |
|
+ ОН |
СО32 |
|||
|
|
|
|
|
|
|
|
Как видно, в выражения констант равновесия не вошли концентрации твердого вещества (BaSO4) и воды в жидком состоянии, т. е. веществ в конденсированном состоянии.
12.2Экспериментальная часть
12.2.1Изучение условий протекания необратимых реакций
Опыт 1. Взаимодействие хлорида аммония (NH4Cl) с гидроксидом натрия (NaOH). В пробирку налейте 2–4 мл раствора хлорида аммония и добавьте столько же концентрированного раствора гидроксида натрия. Ощущается ли запах из пробирки? Содержимое пробирки нагрейте. Какой запах ощущается после нагревания пробирки? Поднесите к ее отверстию
75
влажную лакмусовую бумажку. В какой цвет окрашивается лакмусовая бумажка? Напишите уравнение реакции взаимодействия между NH4Cl и NaOH. За счет какого фактора эту реакцию можно считать необратимой?
Опыт 2. Взаимодействие растворов гидроксида натрия (NaOH)
и хлорида водорода (НCl). К 10 мл 0,1 н. раствора NaOH прилейте 1–2 капли раствора метилового оранжевого, а затем по каплям прилейте раствор соляной (хлоридной) кислоты до полной нейтрализации гидроксида натрия. Напишите уравнение нейтрализации. Как изменяется окрашивание раствора в процессе добавления раствора кислоты к раствору щелочи? Можно ли изменить направление этой реакции?
Опыт 3. Взаимодействие раствора хлорида бария (ВаCl2) и раствора серной (сульфатной) кислоты. В пробирку налейте 10 мл раствора хлорида бария и добавьте раствор серной кислоты. Напишите уравнение реакции между исходными реагентами. Объясните причину образования осадка. Можно ли сместить равновесие наблюдаемой реакции в сторону исходных реагентов?
Опыт 4. Взаимодействие между металлическим цинком и элемен-
тарной серой. Поместите в фарфоровую ступку ~ 1 г цинкового порошка и добавьте ~ 1–1,5 г серы. Смесь измельчите при перемешивании. Перенесите смесь в пробирку и нагрейте ее над пламенем спиртовки. Какие изменения происходят со смесью? Обратима ли эта реакция?
12.2.2Влияние концентрации реагирующих веществ на смещение химического равновесия
Опыт 5. Взаимодействие между хлоридом железа (FeCl3) и тио-
цианатом аммония (NH4SCN). Смешайте в стакане 10 мл 0,002 М раствора хлорида железа (ІІІ) и 10 мл 0,006 М раствора тиоцианата аммония. Полученный раствор разлейте поровну в четыре одинаковые пробирки. В первую пробирку добавьте 1 мл 0,25 М раствора FeCl3, во вторую – 1 мл 0,6 М раствора NH4SCN и в третью – 1 мл 3,0 М раствора NH4Cl. Четвертую оставьте для сравнения. Наблюдайте за изменением окраски растворов. Чем оно вызвано? Напишите уравнения реакций и выражения констант равновесия этих реакций. Объясните, изменение концентраций каких веществ вызывает более значительный сдвиг химического равновесия.
Опыт 6. Обратимость химического равновесия между хромат-
и бихромат-ионами. В зависимости от рН среды в растворах существует равновесие между хромат- и бихромат-ионами.
2CrO42– + 2H+ ↔ Cr2O72– + H2O.
желтая окраска ↔ оранжевая окраска
Как видно из уравнения, состояние равновесия зависит от концентрации ионов H+. При избытке ионов водорода равновесие должно сме-
76
щаться в сторону образования бихромат-ионов. Такое смещение равновесия будет сопровождаться изменением окраски раствора.
В пробирку налейте 5 мл 10 % раствора бихромата калия и по каплям добавляйте 10 % раствор гидроксида натрия. Что при этом происходит? После изменения окраски раствора добавляйте к нему по каплям раствор серной (сульфатной) кислоты (1:3). Как изменяется окраска раствора? Объясните наблюдаемые явления.
12.2.3Влияние температуры на смещение химического равновесия
Опыт 7. Смещение равновесия при образовании гидроксида аммо-
ния. Налейте в пробирку 5 мл воды и добавьте 1–2 капли фенолфталеина и несколько капель концентрированного раствора аммиака (NH3·H2O). Какая окраска раствора в пробирке? Нагрейте содержимое пробирки. Как изменяется окраска раствора? Охладите раствор. Что наблюдается? Превращения в водном растворе аммиака можно записать схемой
NH3 · H2O ↔ NH4ОН ↔ NH4+ + ОН–.
Принимая во внимание приведенную схему, объясните изменение окраски водного раствора аммиака.
Опыт 8. Смещение равновесия между оксидами азота. Для иссле-
дований используйте прибор, состоящий из двух соединенных между собой колб. Прибор перед запайкой был заполнен диоксидом азота (NО2). Между диоксидом азота и его димером (N2О4) существует химическое равновесие, зависящее от температуры смеси этих газов.
2NО2 ↔ N2О4; Н° = – 55 кДж.
бурый газ ↔ бесцветный газ
Поскольку один из газов окрашен, а другой нет, то по изменению окраски можно делать вывод о смещении равновесия наблюдаемой реакции. Для этого одну из колб опустите в стакан с горячей водой, а другую – в сосуд со смесью льда и соли (охладительная смесь). Наблюдайте изменение окраски газов в двух колбах. Какой газ существует при пониженной температуре, а какой при повышенной? Объясните наблюдаемое, исходя из тепловой характеристики реакции.
Опыт 9. Смещение гетерогенного равновесия. Смещение химиче-
ского равновесия в системе «гидроксид магния (Mg(OH)2) – вода». Для проведения опыта налейте в стакан 15 мл раствора хлорида магния (MgCl2) и прилейте такой же объем водного раствора аммиака. Наблюдайте образование осадка.
MgCl2 + 2NH4ОН ↔ 2NH4Cl + Mg(OH)2↓.
77
Осторожно слейте раствор с осадка, а осадок разделите на три части и поместите в три пробирки. В первую пробирку добавьте раствор соляной (хлоридной) кислоты, во вторую – раствор хлорида аммония (NH4Cl), а третью – оставьте для сравнения. Какие изменения наблюдаются в первых двух пробирках? Объясните, почему это происходит?
12.3Вопросы для самоконтроля
1.Объясните физический смысл константы химического равновесия. От каких факторов зависит константа равновесия?
2.Сформулируйте закон действующих масс для равновесных процессов. Сравните с законом действующих масс для односторонних процессов.
3.Выведите концентрационную константу химического равновесия.
4.Дайте термодинамический вывод константы химического равновесия.
5.Найдите связь между величинами констант химического равновесия, выраженных через молярные концентрации реагентов, их парциальные давления или молярные доли.
6.Опишите факт смещения химического равновесия. Какие факторы влияют на смещение равновесия?
7.Дайте определение принципа Ле Шателье.
8.Что наблюдается при установлении равновесия? Почему химическое равновесие называется динамическим?
9.Какие внешние признаки обуславливают обратимость реакции?
10.В каких случаях обратимые реакции можно приравнять к необратимым и наоборот?
ТЕМА 13. ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА РАЗБАВЛЕННЫХ РАСТВОРОВ
Цель работы: ознакомиться со свойствами растворов, зависящими только от концентрации растворенных в них веществ; научиться определять молярную массу неэлектролита и кажущуюся степень диссоциации электролита с использованием коллигативных свойств растворов.
13.1 Теоретическая часть
Некоторые свойства растворов, такие как температура кристаллизации и температура кипения, осмотическое давление, давление насыщенного пара растворителя над раствором, зависят только от концентрации
78
растворенных в них веществ, а не от их природы. Такие свойства растворов получили название коллигативных.
Изучению свойств растворов были посвящены исследования французского физика и химика Ф. М. Рауля (1830–1901). Итогом этих исследований явилось установление двух законов Рауля о зависимости давления насыщенного пара растворителя над раствором от концентрации (первый закон) и о зависимости температуры кристаллизации и кипения раствора от концентрации (второй закон).
Первый закон Рауля утверждает, что относительное понижение давления пара растворителя над раствором равно мольной доле раство-
ренного вещества. В математической форме это можно записать
Рo Р |
|
, |
Ро |
|
в-ва |
где Ро – давление пара над чистым растворителем; Р – давление пара растворителя над раствором; χв-ва – мольная доля растворенного вещества.
Если мольную долю выразить через массы и молярные массы растворенного вещества и растворителя, то уравнение примет вид
|
Рo Р |
|
|
|
νв-ва |
mв-ва /Mв-ва |
|
|||||
|
|
|
|
|
|
|
|
|
|
, |
(13.1) |
|
|
Ро |
|
ν |
в-ва |
νр-ля |
mв-ва /Mв-ва mр-ля /Мр-ля |
||||||
|
|
|
|
|
|
|
|
|
|
|
||
где νв-ва и νр-ля – количество растворенного вещества и растворителя; |
||||||||||||
mв-ва и Мв-ва – |
масса |
и молярная |
масса растворенного вещества; |
mр-ля |
||||||||
и Мр-ля – масса и молярная масса растворителя.
Из приведенного уравнения видно, что с увеличением мольной доли растворенного вещества или, другими словами, с увеличением концентрации растворенного вещества давление пара растворителя над раствором уменьшается. Это уравнение можно использовать для экспериментального определения молярной массы растворяемого вещества. Необходимо помнить, что приведенная форма закона Рауля справедлива только для растворов неэлектролитов. При использовании ее для растворов электролитов необходимо вносить поправку в виде изотонического коэффициента ВантГоффа.
Точнее устанавливать молярные массы растворяемых веществ можно применяя второй закон Рауля, который является продолжением первого. Рассмотрим общий подход к выводу второго закона.
Известно, что жидкость начинает кипеть тогда, когда давление ее насыщенного пара становится равным внешнему давлению. На диаграмме состояния воды можно увидеть, что при внешнем давлении 1 атм вода кипит при температуре 100 ºС. Если рассматривать не чистый растворитель, а раствор, то, согласно первому закону Рауля, давление насыщенного пара растворителя над раствором всегда меньше, чем над чистым растворителем.
79
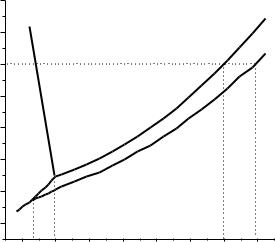
На диаграмме состояния кривая зависимости давления пара растворителя над водным раствором какой-то концентрации будет всегда ниже кривой для чистого растворителя. На рис. 3 это обозначено кривой О1А1.
давление |
|
A |
|
A1 |
|
|
|
|
O |
|
|
O1 |
|
|
t замерз. |
температура |
t кипения |
|
Рис. 3 – Изменение температур кипения и замерзания раствора
Из приведенной зависимости следует, что давление насыщенного пара растворителя над раствором станет равным внешнему уже не при 100 ºС, а при температуре несколько превышающей это значение. С увеличением концентрации раствора давление насыщенного пара над ним будет становиться все меньшим. В результате чего это давление уравнивается с внешним давлением при более высокой температуре раствора. Таким образом, температура кипения раствора будет повышаться с повышением концентрации раствора.
В точке О диаграммы вода сосуществует со льдом и водяным паром (тройная точка). В этой точке вода из жидкого состояния переходит в твердое, т. е. замерзает. На кривой О1А1, отражающей зависимость давления насыщенного пара воды над раствором, тройная точка по значению температуры находится ниже температуры замерзания чистой воды. Причем, такое понижение температуры будет тем больше, чем больше концентрация исследуемого раствора.
Такие закономерности были установлены Раулем и сформулированы во втором законе Рауля: повышение температуры кипения или понижение температуры замерзания растворов по сравнению с чистым растворителем прямо пропорционально моляльной концентрации растворенного вещества (неэлектролита). В математической форме это записывается
t |
|
К |
C |
|
К |
m 1000 |
и Δt |
|
К |
C |
|
К |
|
m 1000 |
, (13.2) |
|
m |
кр. M G |
|
m |
эб. M G |
||||||||||
|
зам. |
|
кр. |
|
|
кип. |
|
эб. |
|
|
|||||
80
