
ЛАБОРАТОРНЫЕ РАБОТЫ
.pdf
часто растворимость определяется массой вещества в граммах в 100 г воды. Растворимость принято обозначать буквой S. В справочниках обычно приводятся данные о растворимости вещества при разных температурах.
Например, о растворимости соли NaCl можно найти такую запись:
S = 35,70; 35,920; 36,440; 37,260; 38,180; 39,4100. Это значит, что при 0 ºС в 100 г
воды растворяется 35,7 г хлорида натрия, при 20 ºС – 35,9 г хлорида натрия и т. д. Верхний индекс указывает на значение температуры, при котором определена растворимость соли. Как видно из приведенного примера,
сповышением температуры растворимость увеличивается (хотя и незначительно). Это свойство увеличивать растворимость с повышением температуры раствора характерно для большинства твердых веществ. Причем многие соли весьма существенно увеличивают растворимость с повышением температуры.
Так, например, для нитрата натрия (NaNO3) растворимость при разных температурах имеет следующие значения: S = 72,70; 87,620; 104,940; 124,760; 14980; 176100. Из приведенных данных видно, что растворимость нитрата натрия значительно выше хлорида натрия и заметнее изменяется
сповышением температуры. Данные о зависимости растворимости часто приводят в виде графиков в координатах: «растворимость – температура». Как правило, такая зависимость определяется кривой, а не прямой линией. На рисунке 1 приведен пример кривой растворимости нитрата натрия.
растворимость, г / 1000г (s)
180
170
160
150
140
130
120
110
100
90
80
70 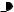
60
0 |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
90 |
100 |
110 |
|
|
|
|
температура (t, C) |
|
|
|
|
|
||
Рис. 1 – Кривая растворимости NaNO3 в воде при различных значениях температуры раствора
Весьма незначительная часть веществ обладает противоположным свойством (т. е. их растворимость при повышении температуры понижается). Уменьшение растворимости с повышением температуры характерно,
41
в основном, для веществ, растворение которых сопровождается выделением теплоты. Такой эффект наблюдается при растворении газов в воде.
Состав насыщенного раствора выражают и другими известными способами (массовой долей, молярной концентрацией и др.). Иногда применяют коэффициент растворимости (kS), показывающий отношение массы растворенного вещества к массе воды в растворе.
Некоторые вещества (например, сульфат и тиосульфат натрия – Na2SO4, Na2S2O3) способны образовывать так называемые пересыщенные растворы. Пересыщенными считаются растворы, которые при некоторой температуре содержат в своем составе больше растворенного вещества, нежели это обусловлено пределом растворимости. Такие растворы, в отличие от насыщенных, являются метастабильными (неустойчивыми). Их можно получать при очень медленном и осторожном охлаждении насыщенных растворов некоторых солей.
Несколько реже в повседневной жизни приходится встречаться с растворами жидкое в жидком и газ в жидком, хотя такие растворы не мене интересны для практики. При смешивании двух (или большего количества) жидкостей могут наблюдаться различные эффекты. Одни жидкости смешиваются между собой, а другие – нет. Склонность к растворению определяется простым правилом – растворяться должно подобное в подобном. Хорошо растворяются полярные жидкости в полярных, а неполярные – в неполярных. Так, например, в воде хорошо растворяются этиловый спирт, ацетон и другие полярные жидкости, так как вода также является полярной жидкостью. А вот бензол или толуол с водой смешиваются плохо (расслаиваются), поскольку относятся к неполярным жидкостям. Но между собой бензол и толуол смешиваются неограниченно.
При растворении жидкого в жидком, иногда наблюдаются так называемые объемные эффекты (образование раствора сопровождается уменьшением объема в сравнении с суммой исходных объемов сливаемых жидкостей). Такой эффект можно объяснить тем, что между разнородными частицами двух жидкостей (например, А и Б) образуется более прочная связь (ЕА-Б), нежели наблюдается между частицами каждой жидкости в отдельности (ЕА-А) и (ЕБ-Б). При усилении связи между молекулами жидкостей А и Б, длина связи уменьшается, что и приводит к уменьшению объема раствора.
7.2 Экспериментальная часть
Опыт 1. Определение растворимости хлорида натрия в воде. Экс-
периментальное определение растворимости твердых веществ в жидкостях можно проводить несколькими способами. Наименее сложным из них является следующий способ.
42

Взвесьте на технохимических весах 20 г NaCl и перенесите в химический стакан с 50 мл дистиллированной воды. При перемешивании раствора стеклянной палочкой добейтесь практически полного растворения поваренной соли. Какой получен раствор? Отфильтруйте раствор от осадка. Взвесьте фарфоровую испарительную чашку (с точностью до 0,01 г). Измерьте температуру отфильтрованного раствора. При помощи пипетки отберите от насыщенного раствора NaCl 10 мл (с точностью 0,2 мл) и перенесите в фарфоровую чашку. Чашку с 10 мл раствора хлорида натрия снова взвесьте. Какие данные можно получить из результатов этих двух взвешиваний? Поставьте фарфоровую чашку на электроплитку, и медленно нагревайте до полного удаления воды. После этого охладите чашку и снова взвесьте. Результаты измерений внесите в таблицу.
1.Масса фарфоровой чашки, г
2.Масса фарфоровой чашки с 10 мл раствора, г
3.Масса раствора, г
4.Удельная плотность раствора NaCl, г/мл
5.Масса фарфоровой чашки с сухим остатком, г
6.Масса воды, г
7.Масса сухой соли, г
8.Растворимость NaCl в воде, (S)
Постройте график растворимости NaCl в воде при различных значениях температуры, используя литературные данные. Сравните данные эксперимента с литературными. Определите ошибку.
Опыт 2. Зависимость растворимости солей от температуры.
В пробирку налейте 3 мл воды и добавьте ~ 2 г бихромата калия (K2Cr2O7) или алюмокалиевых квасцов (KAl(SO4)2 × 12H2O). Взболтайте пробирку. Вся ли соль переходит в раствор? Нагрейте практически до кипения. Растворилась ли в таких условиях соль? Дайте пробирке остыть. Какого цвета кристаллы выпадают в осадок? Сформулируйте вывод о растворимости солей в холодной и горячей воде.
Опыт 3. Приготовление пересыщенных растворов. В пробирку на-
лейте примерно 3 мл воды и добавьте 5 г ацетата натрия (СН3СООNa). Нагрейте пробирку до полного растворения соли. Закройте отверстие пробирки ваткой и поставьте пробирку в стакан с холодной водой. Когда раствор в пробирке остынет, выньте ватку и бросьте в пробирку маленький кристаллик ацетата натрия. Вокруг него очень быстро начнут образовываться кристаллики, которые заполнят всю пробирку. Снова нагрейте пробирку до растворения соли. Закройте ее ваткой и охладите в стакане
43
с холодной водой. После охлаждения выньте пробирку из стакана с водой и резко встряхните. Что наблюдается? Обратите внимание на изменение температуры пробирки после процесса кристаллизации соли из пересыщенного раствора. Выделяется или поглощается теплота при кристаллизации соли? Ответ аргументируйте.
Аналогичные опыты можно провести, используя для этого кристаллогидрат тиосульфата натрия (Na2S2O3∙5H2O). Для этого в пробирку внесите немного кристалликов тиосульфата натрия и нагрейте пробирку. При температуре 48,5 ºС кристаллогидрат плавится в собственной кристаллизационной воде, образуя прозрачный пересыщенный раствор. Дестабилизацию пересыщенного раствора можно проводит теми же методами, что и с ацетатом натрия. Обратите внимание на тепловые эффекты, сопровождающие процесс кристаллизации.
Опыт 4. Изменение объема раствора при растворении. В мерный цилиндр на 10 мл прилейте 5 мл воды. В этот же цилиндр пипеткой прилейте 5 мл этилового спирта. Тщательно смешайте две жидкости. Определите объем образовавшегося раствора. Объясните наблюдаемое явление.
Изменение объема раствора можно наблюдать и в случае приготовления его с участием твердых веществ. Это менее наглядно, но можно проследить на следующем опыте. В мерный цилиндр на 50 мл налейте 40 мл воды. На технохимических весах взвесьте 15 г хлорида натрия (NaCl) и добавьте соль в цилиндр с водой, помешивая палочкой до полного ее растворения. После растворения соли выньте палочку и определите объем образовавшегося раствора. Рассчитайте, каким он должен быть, если удельная масса хлорида натрия при комнатной температуре равна
2,165 г/см3.
Подобный опыт можно провести на примере приготовления водного раствора сахара (удельная масса сахара С12Н22О11 равна 1,588 г/см3).
Опыт 5. Растворение жидкостей в воде. В пробирку налейте 2–3 мл глицерина и осторожно по стенке прилейте такой же объем воды. Образуются два слоя. Перемешайте содержимое пробирки встряхиванием или стеклянной палочкой. Наблюдайте полное смешивание двух жидкостей. Далее в другую пробирку налейте 2–3 мл бензола и столько же воды. Снова наблюдаются два слоя (нижний слой вода, верхний бензол). Тщательно смешайте эти слои двух жидкостей. Поставьте пробирку в штатив на 5 минут. Что наблюдается? Происходит ли полное смешивание жидкостей в этом случае? Наблюдаемые явления объясните.
Опыт 6. Определение растворимости воздуха в воде. К колбе, ем-
костью 200–250 мл подберите пробку с газоотводной трубкой. Измерьте объем колбы по метку, куда входит пробка с газоотводной трубкой. Заполните колбу по пробку водопроводной водой и тщательно закройте подобранной пробкой. К газоотводной трубке подсоедините резиновый шланг. Свободный конец шланга подведите под пробирку, укрепленную в штативе
44
вположении перевернутой отверстием вниз и полностью заполненную водой. В таком положении вода в пробирке будет удерживаться только
втом случае, если отверстие пробирки будет находиться в сосуде с водой. После того как прибор собран, проведите нагревание воды в колбе и кипятите воду до тех пор, пока в пробирку не будут пробулькивать пузырьки воздуха. Затем парафиновым карандашом сделайте метку на пробирке, которая обозначит, какой объем воздуха в ней собрался. Выньте пробирку из сосуда с водой и заполните водой до метки. Перелейте воду в мерный стакан. Это будет объем воздуха, выделившегося из воды вследствие ее кипячения. Пересчитайте объем выделившегося воздуха с учетом того, что он был собран над водой (т. е. в воздухе содержался определенный объем паров воды). Для этого измерьте температуру воды, находящейся в сосуде,
вкоторый была опущена пробирка отверстием вниз. Затем по таблице
определите парциальное давление паров воды при температуре опыта и отнимите эту величину от величины атмосферного давления. Определите, таким образом, осмотическое давление воздуха находящегося в пробирке. Рассчитайте массу воздуха, растворенного в 100 мл воды.
7.3Вопросы для самоконтроля
1.Дайте понятие «раствор». Какие бывают растворы?
2.Что такое предел растворимости солей? Как его определить?
3.Как зависит предел растворимости от значений температуры?
4.Как приготовить пересыщенный раствор?
5.Что такое объемные эффекты при процессах растворения? Как их определяют?
6.Как определить растворимость газов в жидкостях?
ТЕМА 8. ОПРЕДЕЛЕНИЕ ТЕПЛОТЫ РАСТВОРЕНИЯ
Цель работы: научиться определять тепловые эффекты, которые сопровождают процессы растворения.
8.1 Теоретическая часть
Систематические исследования растворов начали проводить еще в средине XVIII века. В самом начале этих исследований не было единого мнения о природе растворов. Так, например, К. Л. Бертолле полагал, что растворы – это соединения неопределенного состава (нестехиометрические), а Й. Я. Берцелиус считал растворы механическими смесями. Разде-
45
ление мнений относительно природы растворов сохраняется и в наше время. Это, вероятно, связано с тем, что при образовании жидких растворов происходят очень сложные и химические, и физические процессы, как с растворяемым веществом, так и с растворителем.
С позиций физических явлений процесс растворения сопровождается разрушением растворяемого вещества и равномерным его распределением по всему объему растворителя (диспергирование). При этом общие свойства растворов зависят только от концентрации растворенного вещества. На этом положении базируется физическая теория растворов, основные положения которой заложены работами таких выдающихся химиков, как Я. Вант-Гофф (1852–1911) и С. Аррениус (1859–1927). Согласно физической теории растворов растворитель рассматривается как индифферентная среда, в которой хаотически распределяются частички растворенного вещества. Единственной движущей силой процесса растворения является увеличение энтропии системы (ΔS). Тепловые и объемные эффекты при этом отсутствуют.
Химическая теория растворов, наоборот, исходит из того, что между компонентами раствора существует химическое взаимодействие. Одним из основоположников химической теории считается Д. И. Менделеев (1834–1907). Многочисленные экспериментальные данные, которые указывали на отличительные черты химической теории от физической, были изложены им в книге «Исследование водных растворов по их удельному весу» (1887). Химическую теорию растворов продолжали развивать И. А. Каблуков (1857–1942), В. А. Кистяковский (1865–1952) и другие ученые. Движущей силой процесса растворения в этой теории рассматриваются уже два фактора – энтропийный (ΔS) и энтальпийный (ΔН).
Основные выводы двух теорий (физической и химической) сосуществуют и в настоящее время, так как одни свойства растворов хорошо описываются физической теорией (например, коллигативные), а другие – химической (например, тепловые эффекты растворения солей).
Рассмотрим основные положения химической теории, согласно кото-
рой при образовании раствора происходит изменение не только растворяемого вещества, но и растворителя. При внесении растворяемого вещества в растворитель происходит взаимодействие между ними. В результате этого, растворяемое вещество распадается на частицы (ионы, молекулы, атомы), которые взаимодействуют с частицами растворителя, образуя новые соединения. Образование таких соединений можно доказать на примере следующего опыта.
Как известно, безводный сульфат меди (CuSO4) не имеет окрашивания, т. е. по внешнему виду это белая соль. При внесении ее в воду раствор окрашивается в голубой цвет. Из опыта следует, что вещества, используемые для приготовления раствора бесцветны, а раствор окрашен. Следовательно, в растворе образуется какое-то соединение, окрашивающее раствор
46
вголубой цвет. Такие соединения получили название сольваты (если растворитель вода, то гидраты), а процесс их образования – сольватации (и, соответственно, гидратации). Прочность таких соединений различна, и зависит от природы как растворяемого вещества, так и растворителя.
Считается, что при образовании раствора образуется динамическое равновесие между растворителем, растворенным веществом и продуктами их взаимодействия (сольватами или гидратами). Существование сольватов (гидратов) в растворе доказывается чаще косвенным методом на примере выделения из раствора кристаллосольватов (кристаллогидратов). Напри-
мер, безводные соли CuSO4, Na2CO3, CoCl2 хорошо растворяются в воде. А из водных растворов выделяются уже в виде кристаллогидратов состава
CuSO4∙5Н2О, Na2CO3∙10Н2О, CoCl2∙6Н2О. А такие соли как, например, CаCl2 и Mg(ClO4)2, образуют кристаллосольваты с метиловым спиртом CаCl2∙6СН3ОН и Mg(ClO4)2∙6СН3ОН.
Внекоторых случаях образование сольватов (гидратов) происходит с изменением некоторых внешних признаков. Как было показано выше, при
образовании гидратов с участием CuSO4 изменяется цвет раствора. Изменение окраски происходит и при образовании гидратов с участием соли CoCl2 (безводная соль имеет синее окрашивание, а водный раствор – розовое). В некоторых случаях при образовании сольватов заметно изменяется объем раствора (при растворении спирта или концентрированной серной кислоты
вводе).
Однако наибольший интерес вызывают тепловые эффекты, наблюдаемые при образовании растворов, в результате чего растворы нагреваются (выделяется теплота) или охлаждаются (поглощается теплота). Теплота, выделяемая или поглощаемая при растворении 1 моля вещества, называется теплотой растворения. В настоящее время термин теплота растворения заменяют более точным термином энтальпия растворения.
Природу тепловых эффектов, наблюдаемых при образовании растворов можно коротко объяснить следующим образом. Растворяемое вещество при переходе в раствор разрушается на составные части. Всякий процесс разрушения связей в молекулярном веществе или распад на ионы в кристаллическом веществе будет происходить при поглощении энергии. Процесс образования сольватов (гидратов), наоборот, протекает с выделением энергии. Следовательно, растворение сопровождается двумя противоположными процессами: разрушением одних связей и образованием других, протекающих, соответственно, с поглощением и выделением энергии.
Таким образом, если при растворении наблюдается выделение теплоты (экзоэффект), то энергия сольватации (образования новых соединений) больше энергии разрушения связей в исходных веществах. И, соответственно, наоборот. Например, при растворении солей KNO3, NH4NO3, NaCl, KCl, KNCS и других происходит поглощение энергии (растворы охлаждаются). Свойство таких солей охлаждать растворы используется на практике
47
для приготовления охладительных смесей. И наоборот, растворение концентрированных кислот Н2SO4, НNO3, НCl, а также кристаллических NaОН и КОН сопровождается выделением энергии.
При изучении величин тепловых эффектов процессов растворения используется специальная терминология, использующая понятия «интегральная» и «дифференциальная энтальпия (теплота)» растворения. Экспериментально можно измерять только интегральную энтальпию растворения, под которой подразумевается изменение энтальпии системы в процессе растворения определенного количества вещества в определенном количестве растворителя.
Таблица 4 – Коэффициенты для расчета теплоемкости растворов солей
Растворенно |
|
–В0 |
Вх |
|
В1 |
|
–В2 ∙ 103 |
|
QP, |
е вещество |
|
|
|
|
|
|
|
|
ккал/моль* |
|
|
|
|
|
|
|
|
|
|
CaCl2 |
6 497,23 |
5 563,05 |
|
6,36 |
|
17,92 |
|
18 |
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
K2CO3 |
5 086,14 |
2 161,24 |
|
6,62 |
|
5,51 |
|
6,6 |
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
KCl |
5 230,02 |
2 939,03 |
|
–0,21 |
|
16,52 |
|
–4,5 |
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
KOH |
5 345,49 |
2 356,87 |
|
10,43 |
|
4,76 |
|
12,8 |
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
MgCl2 |
6 530,30 |
4 804,79 |
|
5,64 |
|
19,79 |
|
36,0 |
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
NH4Cl |
5 0587,59 |
3 829,86 |
|
5,61 |
|
17,89 |
|
–3,9 |
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
(NH4)2SO4 |
4 663,14 |
2 938,54 |
|
5,52 |
|
7,43 |
|
–2,4 |
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
NaCl |
5 479,43 |
7 878,33 |
|
3,14 |
|
23,35 |
|
–1,2 |
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
Na2SO4 |
5 364,78 |
5 043,73 |
|
13,45 |
|
24,10 |
|
0,3 |
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
Na2CO3 |
4 187,41 |
4 760,10 |
|
6,66 |
|
8,25 |
|
5,6 |
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
NaOH |
5 297,21 |
6 942,68 |
|
14,84 |
|
14,15 |
|
10,1 |
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
KNO3 |
4 293,94 |
2 585,00 |
|
–3,69 |
|
5,26 |
|
–8,6 |
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
MgSO4 |
6 277,72 |
9 435,90 |
|
12,00 |
|
7,90 |
|
20,3 |
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
NH4NO3 |
3 287,70 |
1 136,94 |
|
–0,81 |
|
–6,5 |
|
–6,4 |
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
CuSO4 |
5 100,71 |
1 967,28 |
|
15,46 |
|
–16,69 |
|
15,9 |
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
NaNO3 |
3 369,37 |
2 213,59 |
|
–0,30 |
|
91,95 |
|
–5,1 |
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
* Значения |
теплоты |
растворения |
относятся к |
растворению 1 |
моль вещества |
||||
в 400 молях воды при 18 °С и давлении 1 атм (1 ккал – 4,2 Дж)
48
Например, при растворении 1 моля нитрата калия (KNO3) в 20 молях воды поглощается 28,6 кДж теплоты, а при растворении 1 моля того же вещества, но уже в 100 молях воды, поглощается 34,2 кДж теплоты. Как видно величина интегральной теплоты растворения зависит от концентрации раствора. Исходя из этого используют два специфических названия интегральных теплот растворения:
– первая, которая определяется значением энтальпии растворения 1 моля вещества в бесконечном количестве молей растворителя. Например, для Na2CO3 она равна 23,3 кДж;
– полная, которая отвечает тепловому эффекту растворения 1 моля вещества в таком количестве молей растворителя, при котором образуется насыщенный раствор. Для той же соли она равна 33,2 кДж.
Для одних веществ различие в значениях первой и полной интегральных теплот растворения значительное (например, для серной кислоты), для других (преимущественно для малорастворимых солей) пренебрежительно мало.
Теплоемкость растворов солей с(t) в диапазоне температур t = 0 100 ºС может быть вычислена по формуле
c(t) = cводы(t) + (В0 + Вх · х + В1 · t + В2 · t2) · х,
где c(t) – удельная теплоемкость раствора, Дж/(кг·К); х – концентрация растворенного вещества, кг_соли/кг_раствора; t – температура, ºС; В0, Вх, В1, В2 – коэффициенты, приведенные в таблице 4; cводы(t) – удельная теплоемкость воды, Дж/(кг·К). Удельная теплоемкость воды может быть вычислена по формуле
cводы(t) = 4223,6 + 2,476 · t · lg(t/100).
8.2 Экспериментальная часть
Определение энтальпии растворения необходимо проводить в специальных приборах, которые называются калориметрами. Калориметрия, т. е. определение величины теплового эффекта какого-либо химического процесса, является одним из многоплановых и точных физико-химических методов исследования. На первой стадии исследований определяется постоянная калориметра (по растворению точно определенного количества вещества в определенном количестве растворителя, в результате чего выделяется известное из справочных данных количество теплоты). А затем, при растворении известного количества исследуемой соли в определенном количестве растворителя, рассчитывается теплота растворения этой соли.
Со значительно большей ошибкой калориметрические исследования можно провести и в приборе, который будет представлять собой упрощенный калориметр. Чтобы собрать такой прибор необходимо использовать
49

два химических стакана, один объемом около 250 мл, а второй – около 500 мл. Конфигурация стаканов должна быть такой, чтобы меньший стакан помешался в больший без соприкосновения стенками. Для уменьшения теплоотдачи на дно большего стакана помещают корковую прокладку. Для того, чтобы стаканы не прикасались между собой стенками, их разделяют специально вырезанным из картона диском. Меньший стакан должен еще закрываться картонной крышкой, в которой необходимо сделать отверстие для пробирки.
Для проведения исследований необходимо использовать соли, растворение которых сопровождается большими тепловыми эффектами. Из таких солей можно рекомендовать следующие: KCl, KNO3, NaCl, NaNO3, Na2SO4, CuSO4, CаCl2, NH4Cl, NH4NO3 и другие.
На технохимических весах взвесьте меньший по размеру стакан. Налейте в него ~ 150 мл воды и снова взвесьте. Этими двумя последовательными взвешиваниями определяется масса воды, которая используется в качестве растворителя. В пробирку внесите 0,2 моль (рассчитайте и взвесьте на весах) исследуемого вещества, предварительно тщательно измельчив его (для ускорения процесса растворения). Пробирку закройте пробкой и поместите в меньший стакан, заполненный водой так, чтобы часть пробирки, заполненная веществом, была погружена в воду. Перемешайте воду в стакане термометром (с ценой деления 0,1 ºС). После 10 мин перемешиваний, определите значение температуры воды в стакане. Пробирку с веществом выньте из воды и ее содержимое высыпьте в стакан с водой. Отверстие в стакане закройте крышкой и тщательно термометром перемешайте содержимое стакана до полного растворения соли. Одновременно с перемешиванием следите за показаниями термометра. Записывайте показания термометра через 5–10 с. Измерение температуры раствора проводите до тех пор, пока ее значение не перейдет через максимальное изменение и начнет отклоняться в сторону исходного. Отметьте значение максимального изменения температуры. Результаты опыта внесите
втаблицу.
1.Масса меньшего (внутреннего) стакана, mст., г
2.Масса стакана с водой, m, г
3.Масса воды, mводы, г
4.Масса соли для приготовления раствора, mсоли, г
5.Молярная масса соли, Мсоли, г/моль
6.Температура воды в стакане до растворения соли, t1, ºС
7.Температура раствора после окончания опыта, t2, ºС
8.Разность температур до и после растворения, Δt = t2 – t1, ºС
50
