
- •Варианты контрольных заданий
- •Составьте уравнения гидролиза в ионно-молекулярной и молекулярной форме для следующих солей: и . Укажите рН среды.
- •Составьте уравнения гидролиза в ионно-молекулярной и молекулярной форме для следующих солей: и . Укажите рН среды.
- •Составьте уравнения гидролиза в ионно-молекулярной и молекулярной форме для следующих солей: и . Укажите рН среды.
- •Вычислите реакции, протекающей по уравнению, используя значения стандартных теплот образования и абсолютных стандартных энтропий веществ: .
- •Составьте уравнения гидролиза в ионно-молекулярной и молекулярной форме для следующих солей: и . Укажите рН среды.
- •Составьте молекулярные и ионные уравнения реакций, протекающих при смешивании растворов: а) и ; б) и ; в) и .
- •Составьте уравнения электролитической диссоциации следующих электролитов: . Запишите выражения констант равновесия для слабых электролитов.
- •Составьте уравнения гидролиза в ионно-молекулярной и молекулярной форме для следующих солей: и . Укажите рН среды.
- •Составьте молекулярные уравнения по ионно-молекулярным: ;
- •Составьте уравнения гидролиза в ионно-молекулярной и молекулярной форме для следующих солей: и . Укажите рН среды.
- •Вычислите реакции, протекающей по уравнению, используя значения стандартных теплот образования и абсолютных стандартных энтропий веществ: .
- •Составьте уравнения гидролиза в ионно-молекулярной и молекулярной форме для следующих солей: и . Укажите рН среды.
- •Напишите ионно-молекулярные уравнения реакций:
- •Составьте уравнения гидролиза в ионно-молекулярной и молекулярной форме для следующих солей: и . Укажите рН среды.
- •Составьте уравнения гидролиза в ионно-молекулярной и молекулярной форме для следующих солей: и . Укажите рН среды.
- •Составьте молекулярные уравнения по ионно-молекулярным: ;
- •Составьте уравнения электролитической диссоциации следующих электролитов: . Запишите выражения констант равновесия для слабых электролитов.
- •Составьте уравнения гидролиза в ионно-молекулярной и молекулярной форме для следующих солей: и . Укажите рН среды.
- •Составьте уравнения электролитической диссоциации электролитов . Объясните, какой из них легче распадается на ионы и почему. Запишите выражение для константы равновесия слабых электролитов.
- •Составьте уравнения гидролиза в ионно-молекулярной и молекулярной форме для следующих солей: и . Укажите рН среды.
- •Составьте уравнения гидролиза в ионно-молекулярной и молекулярной форме для следующих солей: и . Укажите рН среды.
- •Составьте уравнения гидролиза в ионно-молекулярной и молекулярной форме для следующих солей: и . Укажите рН среды.
- •Составьте уравнения электролитической диссоциации следующих электролитов: . Запишите выражения констант равновесия для слабых электролитов.
- •Напишите ионно-молекулярные уравнения реакций:
- •Напишите ионно-молекулярные уравнения реакций:
- •Составьте уравнения электролитической диссоциации следующих электролитов: . Запишите выражения констант равновесия для слабых электролитов.
- •Термодинамические свойства некоторых соединений
-
При сгорании 1 л ацетилена выделяется 58,2 кДж. Вычислите
 ацетилена.
ацетилена. -
Исходя из значений стандартных теплот образования и абсолютных стандартных энтропий соответствующих веществ, вычислите
 ,
протекающей по уравнению
,
протекающей по уравнению
 .
Возможен ли этот процесс при стандартных
условиях?
.
Возможен ли этот процесс при стандартных
условиях? -
Как изменится скорость прямой и обратной реакции, если объем газовой смеси 4HCl(г) + O2(г)↔ 2 H2O(г) + 2Cl2(г) увеличить в 2 раза?
-
Константа равновесия системы
 равна 0,35. Определите равновесные
концентрации
равна 0,35. Определите равновесные
концентрации
 и
и
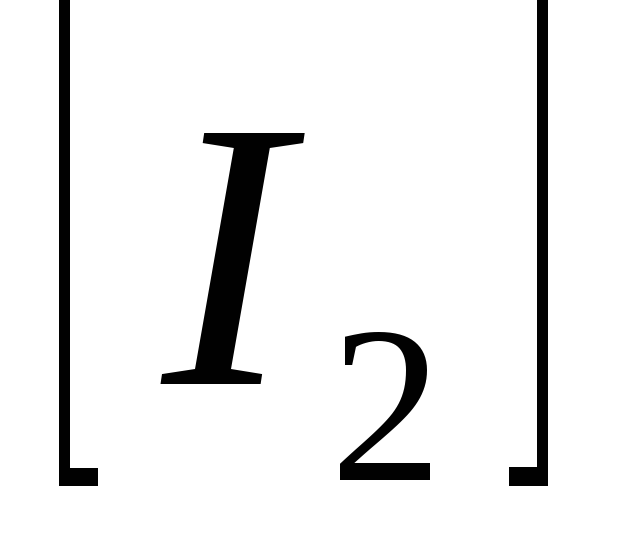 ,
если исходная концентрация йодоводорода
равна 2
моль/л.
,
если исходная концентрация йодоводорода
равна 2
моль/л. -
Сколько фосфата натрия нужно взять, чтобы приготовить 2л 0.5 н. раствора? Какова молярность раствора?
-
Напишите ионно-молекулярные уравнения реакций:
![]() ;
;
![]() ;
;
![]() .
.
-
Вычислите температуру кристаллизации 10%-ного раствора глицерина
 в воде. Криоскопическая константа воды
равна 1,860
.
в воде. Криоскопическая константа воды
равна 1,860
. -
Как влияет разбавление раствора на процесс диссоциации слабых и сильных электролитов. Объяснить на примерах.
-
Какие из солей
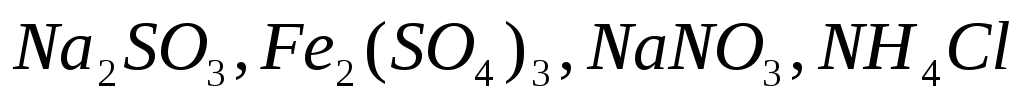 подвергаются гидролизу? Составьте
ионно-молекулярные и молекулярные
уравнения гидролиза, укажите значение
рН растворов этих солей.
подвергаются гидролизу? Составьте
ионно-молекулярные и молекулярные
уравнения гидролиза, укажите значение
рН растворов этих солей.
Вариант 20.
-
Вычислите тепловой эффект реакции гидрирования этилена
 ,
если теплоты сгорания этана и этилена
соответственно равны –1560 и –1411
кДж/моль.
,
если теплоты сгорания этана и этилена
соответственно равны –1560 и –1411
кДж/моль. -
Запишите в общем виде формулу для определения энтропии следующей реакции
 и, используя справочные данные,
рассчитайте ее величину.
и, используя справочные данные,
рассчитайте ее величину.
-
Во сколько раз следует увеличить давление в газообразной системе
 ,
чтобы
скорость образования HI
возросла
в 100 раз?
,
чтобы
скорость образования HI
возросла
в 100 раз? -
Вычислите равновесные концентрации веществ в реакции
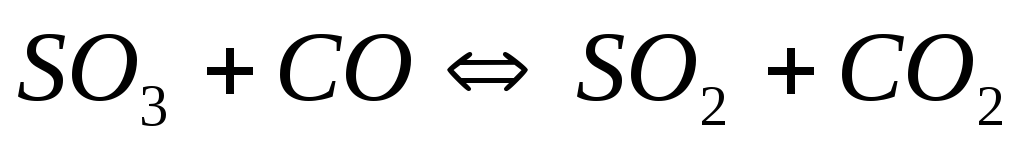 ,
если константа равновесия реакции
равна 1,89, а исходная концентрация
,
если константа равновесия реакции
равна 1,89, а исходная концентрация

-
До какого объема нужно довести раствор при растворении 20 г хлорида магния, чтобы концентрация полученного раствора была 0.25М?
-
Выразите ионными и молекулярными уравнениями следующие процессы: а) взаимодействие дигидрофосфата кальция с гидроксидом кальция; б) взаимодействие гидросульфида калия с гидроксидом калия.
-
Вычислите процентную концентрацию водного раствора глицерина
 ,
зная, что этот раствор кипит при 100,45ºС.
Эбуллиоскопическая константа воды
равна 0,52º.
,
зная, что этот раствор кипит при 100,45ºС.
Эбуллиоскопическая константа воды
равна 0,52º. -
Вычислите концентрацию катионов водорода (моль/л) в 0,025 м растворе сернистой кислоты, константа диссоциации которой составляет 1,7·10-2.
-
Какое значение рН (>7< ) имеют растворы следующих солей:
 ?
Составьте ионно-молекулярные уравнения
гидролиза.
?
Составьте ионно-молекулярные уравнения
гидролиза.
Вариант 21.
-
Теплоты сгорания бензола и ацетилена соответственно составляют
–3268 и –1301
кДж/моль. Вычислите энтальпию реакции
![]() .
.
-
Вычислите
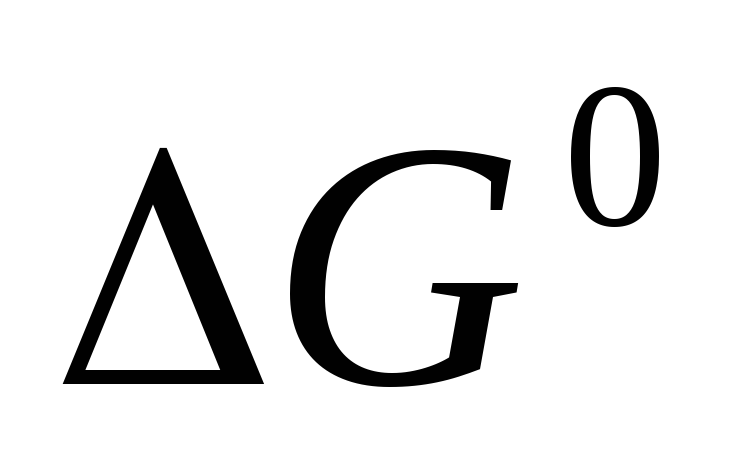 образования
пропана, хлороводорода и диоксида
углерода, исходя из значений
образования
пропана, хлороводорода и диоксида
углерода, исходя из значений
 и изменения энтропии
и изменения энтропии
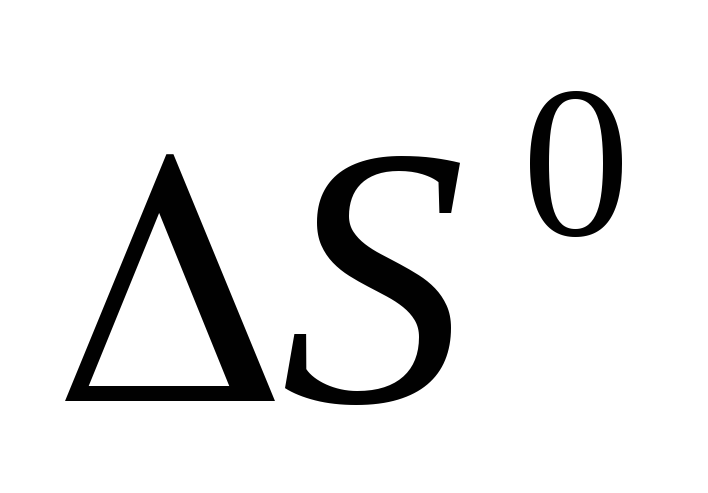 .
Полученные величины сравните со
справочными данными.
.
Полученные величины сравните со
справочными данными. -
Напишите скорости выражения реакций, протекающих по схеме А+В=АВ, если а) А и В – газообразные вещества; б) А и В – жидкости, смешивающиеся в любых пропорциях.
-
При синтезе аммиака равновесие установилось при следующих равновесных концентрациях веществ: [N2]=1,5, [H2]=0,8, [NH3]=2,7 моль/л. Рассчитайте значение константы равновесия и исходные концентрации реагирующих веществ.
-
Плотность 15%-ного (по массе) раствора серной кислоты равна 1.105 г/см3. Вычислить нормальность и молярность раствора.
-
Закончите молекулярные и составьте ионно-молекулярные уравнения процессов, проходящих по схемам:
 …;
…;
 ….
…. -
Раствор, содержащий 2,24 г некоторого вещества в 250 г воды, кристаллизуется при – 0,281ºС. Вычислите мольную массу растворенного вещества, зная, что криоскопическая константа воды равна 1,86º.
-
Приведите по три примера электролитической диссоциации средних, кислых и основных солей.
-
Почему при смешивании растворов сульфата алюминия и сульфида натрия образуется осадок гидроксида алюминия? Объясните это явление, составив ионно-молекулярные и молекулярные уравнения гидролиза.
Вариант 22.
-
Теплота образования этилового спирта составляет –1409 кДж/моль. Вычислите
 реакции
реакции
 .
. -
Вычислите температуру, при которой система находится в равновесии, считая, что
 и
и
 не зависят от температуры:
не зависят от температуры:
![]() .
.
-
По какому веществу и во сколько раз скорость реакции 2А+3В=С будет меньше, если концентрация вещества А уменьшилась на 0,05 моль/л? Как при этом изменилась концентрация вещества В?
-
Определите, в какую сторону произойдет смещение равновесия в гомогенных системах:
 и
и
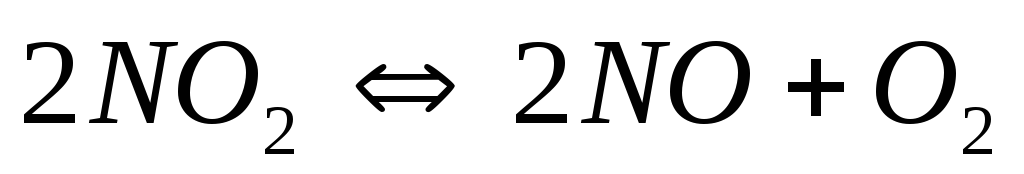
а) при охлаждении системы; б) при уменьшении давления?
-
Какой объем 30%-ного раствора гидроксида калия, плотность которого 1,29 г/см3, нужно взять, чтобы приготовить 3л 0,5М раствора
-
Составьте по три молекулярных уравнения реакций, которые выражаются ионно-молекулярными уравнениями:
 ,
,
 .
. -
В каком количестве воды следует растворить 0,35 кг глицерина
 ,
чтобы получить раствор с температурой
кристаллизации – 2,5ºС? Криоскопическая
константа воды равна 1,86 0.
,
чтобы получить раствор с температурой
кристаллизации – 2,5ºС? Криоскопическая
константа воды равна 1,86 0. -
Определите константу диссоциации угольной кислоты по первой ступени, если в 0,2 м растворе степень ее диссоциации равна 0,173 %.
-
Какая из двух солей при равных условиях в большей степени подвергается гидролизу:
 или
или
 ? Почему? Составьте ионно-молекулярные
и молекулярные уравнения гидролиза
этих солей.
? Почему? Составьте ионно-молекулярные
и молекулярные уравнения гидролиза
этих солей.
Вариант 23.
-
Вычислите количество теплоты, выделившееся при восстановлении
 алюминием, если было получено 150 г
железа.
алюминием, если было получено 150 г
железа. -
Вычислите
 образования
оксида азота, сульфида магния и хлорида
натрия, исходя из значений
образования
оксида азота, сульфида магния и хлорида
натрия, исходя из значений
 и изменения энтропии
и изменения энтропии
 .
Полученные величины сравните со
справочными данными.
.
Полученные величины сравните со
справочными данными. -
Как изменится скорость прямой и обратной реакции, если давление в гомогенной системе
 увеличить в 5 раз?
увеличить в 5 раз? -
Константа равновесия для реакции
 равна 25, а начальные концентрации
исходных веществ составляют по 1,2
моль/л. Вычислите равновесные концентрации
водорода, иода и иодоводорода.
равна 25, а начальные концентрации
исходных веществ составляют по 1,2
моль/л. Вычислите равновесные концентрации
водорода, иода и иодоводорода.
-
Сколько воды нужно прибавить к 25 мл 40%-ного раствора гидрокcида калия, плотность которого составляет 1,41 г/см3, чтобы получить 2%-ный раствор?
-
Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия между растворами веществ: а)
 и
и
 ;
б)
;
б)
 и
и
 ;
в)
;
в)
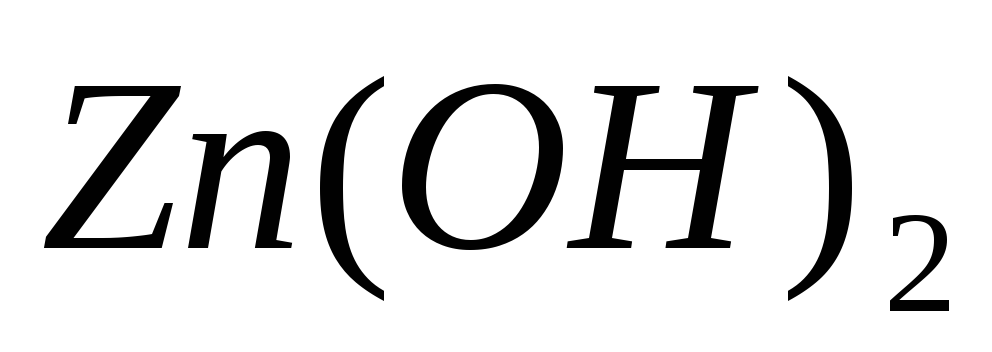 и
и
 .
. -
Вычислите температуру кипения 17%-ного водного раствора метилового спирта, температура кристаллизации которого равна – 2,81ºС. Криоскопическая константа воды составляет 1,86º.
-
При какой концентрации раствора степень диссоциации азотистой кислоты будет равна 35,5 %? Константа диссоциации кислоты равна 5,1·10-4.
-
Почему при смешивании растворов хлорида цинка и карбоната натрия гидролиз обеих солей идет до конца? Объясните это явление, составив ионно-молекулярные и молекулярные уравнения совместного гидролиза.
Вариант 24.
-
При взаимодействии газообразных оксида углерода (
 )
и сероводорода образуются сероуглерод
и пары воды. Вычислите тепловой эффект
и запишите термохимическое уравнение
этого процесса.
)
и сероводорода образуются сероуглерод
и пары воды. Вычислите тепловой эффект
и запишите термохимическое уравнение
этого процесса. -
По термохимическому уравнению рассчитайте стандартную энтальпию образования диоксида кремния:
 ;
;
 .
. -
Какие реакции называются обратимыми, какие необратимыми? Дать полный ответ, привести примеры.
-
Константа равновесия газообразной системы
 при некоторой температуре равна 0,8.
Равновесные концентрации водорода и
аммиака соответственно равны 0,6 и 0,2
при некоторой температуре равна 0,8.
Равновесные концентрации водорода и
аммиака соответственно равны 0,6 и 0,2
 Вычислите исходную и равновесную
концентрации азота.
Вычислите исходную и равновесную
концентрации азота. -
Сколько миллилитров 10%-ного раствора карбоната натрия, плотность которого равна 1,105 г/см3, нужно прибавить к 1л 2%-ного раствора, плотность которого 1,02 г/см3, чтобы получить 3%-ный раствор?
-
Составьте молекулярные и ионно-молекулярные уравнения реакция взаимодействия между: а)
 и
и
 ;
б)
;
б)
 и
и
 ; в)
; в)
 и
и
 .
. -
Вычислите осмотическое давление 5%-ного раствора сахара в воде при 25 ºС, принимая плотность раствора за единицу.
-
Степень диссоциации муравьиной кислоты в 0,02 М растворе равна 3,2 %. Определите константу диссоциации этой кислоты.
-
Почему при смешивании растворов хлорида хрома и сульфида натрия образуется осадок гидроксида хрома? Объясните это явление, составив ионно-молекулярные и молекулярные уравнения гидролиза.
Вариант 25.
-
Вычислите , сколько теплоты выделится при сгорании 100 л ацетилена, если продуктами сгорания являются диоксид углерода и пары воды?
-
Вычислите изменение энергии Гиббса при 727ºС для реакции:
 по стандартным значениям энтальпий
образования и абсолютных энтропий,
воспользовавшись таблицами
термодинамических характеристик
веществ.
по стандартным значениям энтальпий
образования и абсолютных энтропий,
воспользовавшись таблицами
термодинамических характеристик
веществ. -
При температуре 30 ºС химическая реакция заканчивается за 30 мин. Определите время протекания этой реакции при температуре 20, 40, 50ºС. Температурный коэффициент реакции равен 2,4.
-
Константа равновесия системы при постоянной температуре
 равна
3. Вычислите равновесные концентрации
всех реагентов, если исходные концентрации
составляют:
равна
3. Вычислите равновесные концентрации
всех реагентов, если исходные концентрации
составляют:

-
Плотность 95%-ного раствора сахарозы
 равна 1,035 г/см3.
Вычислите молярную концентрацию
эквивалента этого раствора.
равна 1,035 г/см3.
Вычислите молярную концентрацию
эквивалента этого раствора. -
Какое из веществ:
 - взаимодействует с раствором серной
кислоты? Составьте молекулярные и
ионно-молекулярные уравнения реакций.
- взаимодействует с раствором серной
кислоты? Составьте молекулярные и
ионно-молекулярные уравнения реакций. -
Сколько граммов карбамида
 необходимо растворить в 90 г воды, чтобы
температура кристаллизации понизилась
на 0,395ºС? Криоскопическая константа
воды равна 1,86 º.
необходимо растворить в 90 г воды, чтобы
температура кристаллизации понизилась
на 0,395ºС? Криоскопическая константа
воды равна 1,86 º. -
Составьте уравнения электролитической диссоциации для электролитов: хлорида железа (III), серной кислоты, нитрата магния, гидросульфида калия, угольной кислоты, гидроксида цинка.
-
Какие из солей
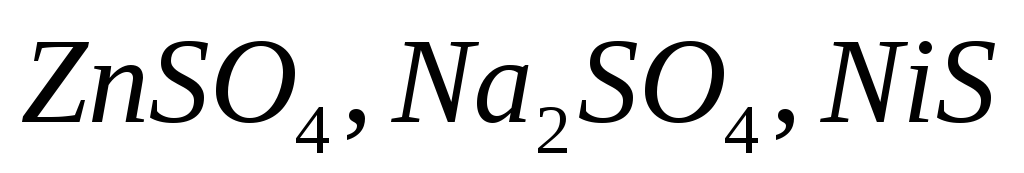 подвергаются гидролизу? Составьте
ионно-молекулярные и молекулярные
уравнения этих солей, укажите значения
рН среды.
подвергаются гидролизу? Составьте
ионно-молекулярные и молекулярные
уравнения этих солей, укажите значения
рН среды.
Вариант 26.
-
Вычислите теплоту образования сульфида железа, если при взаимодействии 6,3г железа с серой выделилось 11,3 кДж теплоты.
-
Рассчитайте температуру, при которой равновероятны оба направления реакции:
 .
. -
Как изменится скорость прямой и обратной реакции
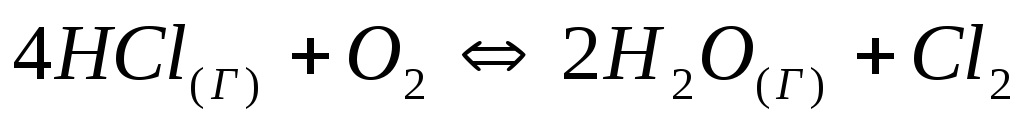 ,
если давление уменьшить в 3 раза?
,
если давление уменьшить в 3 раза? -
Запишите выражение для константы равновесия гетерогенной системы
 Как изменится скорость прямой реакции,
если концентрацию диоксида углерода
увеличить в 3 раза? Предложите несколько
вариантов ускорения прямой реакции.
Как изменится скорость прямой реакции,
если концентрацию диоксида углерода
увеличить в 3 раза? Предложите несколько
вариантов ускорения прямой реакции. -
До какого объема надо разбавить 38%-ный раствор объемом 50 мл (плотность равна 1,285 г/см3), чтобы получить 0,5 молярный раствор серной кислоты?
-
Составьте молекулярные уравнения реакций, которые выражаются следующими ионно-молекулярными уравнениями:
 ;
;
 ;
;
 .
. -
Вычислите температуру кипения 10%-ного раствора нафталина
 в бензоле, зная, что эбуллиоскопическая
константа бензола равна 2,57º, а температура
его кипения 80,2ºС.
в бензоле, зная, что эбуллиоскопическая
константа бензола равна 2,57º, а температура
его кипения 80,2ºС. -
Вычислите степень диссоциации сероводородной кислоты по первой ступени, если константа диссоциации ее в 0,1 М растворе составляет 6·10-8.
-
Почему при смешивании растворов нитрата хрома и сульфида калия гидролиз идет практически до конца? Объясните это явление, составив ионно-молекулярные и молекулярные уравнения совместного гидролиза.
Вариант 27.
-
Запишите термохимическое уравнение реакции между оксидом углерода (II) и водородом, в результате которой образуются метан и пары воды. Сколько теплоты выделится, если в ходе процесса было получено 67 л метана ( при нормальных условиях).
-
Вычислите энергию Гиббса при 473К, если
 13873
Дж/моль,
13873
Дж/моль,
![]() =
42,2 Дж/моль·К.
=
42,2 Дж/моль·К.
-
Напишите скорости выражения реакций, протекающих по схеме А+В=АВ, если а) А и В – вещества, находящиеся в растворе; б) А – твердое вещество, а В – газ или вещество, находящееся в растворе.
-
Запишите выражения для констант равновесия следующих процессов:

![]()
Как сместить равновесие реакций в прямом направлении?
