
- •Варианты контрольных заданий
- •Составьте уравнения гидролиза в ионно-молекулярной и молекулярной форме для следующих солей: и . Укажите рН среды.
- •Составьте уравнения гидролиза в ионно-молекулярной и молекулярной форме для следующих солей: и . Укажите рН среды.
- •Составьте уравнения гидролиза в ионно-молекулярной и молекулярной форме для следующих солей: и . Укажите рН среды.
- •Вычислите реакции, протекающей по уравнению, используя значения стандартных теплот образования и абсолютных стандартных энтропий веществ: .
- •Составьте уравнения гидролиза в ионно-молекулярной и молекулярной форме для следующих солей: и . Укажите рН среды.
- •Составьте молекулярные и ионные уравнения реакций, протекающих при смешивании растворов: а) и ; б) и ; в) и .
- •Составьте уравнения электролитической диссоциации следующих электролитов: . Запишите выражения констант равновесия для слабых электролитов.
- •Составьте уравнения гидролиза в ионно-молекулярной и молекулярной форме для следующих солей: и . Укажите рН среды.
- •Составьте молекулярные уравнения по ионно-молекулярным: ;
- •Составьте уравнения гидролиза в ионно-молекулярной и молекулярной форме для следующих солей: и . Укажите рН среды.
- •Вычислите реакции, протекающей по уравнению, используя значения стандартных теплот образования и абсолютных стандартных энтропий веществ: .
- •Составьте уравнения гидролиза в ионно-молекулярной и молекулярной форме для следующих солей: и . Укажите рН среды.
- •Напишите ионно-молекулярные уравнения реакций:
- •Составьте уравнения гидролиза в ионно-молекулярной и молекулярной форме для следующих солей: и . Укажите рН среды.
- •Составьте уравнения гидролиза в ионно-молекулярной и молекулярной форме для следующих солей: и . Укажите рН среды.
- •Составьте молекулярные уравнения по ионно-молекулярным: ;
- •Составьте уравнения электролитической диссоциации следующих электролитов: . Запишите выражения констант равновесия для слабых электролитов.
- •Составьте уравнения гидролиза в ионно-молекулярной и молекулярной форме для следующих солей: и . Укажите рН среды.
- •Составьте уравнения электролитической диссоциации электролитов . Объясните, какой из них легче распадается на ионы и почему. Запишите выражение для константы равновесия слабых электролитов.
- •Составьте уравнения гидролиза в ионно-молекулярной и молекулярной форме для следующих солей: и . Укажите рН среды.
- •Составьте уравнения гидролиза в ионно-молекулярной и молекулярной форме для следующих солей: и . Укажите рН среды.
- •Составьте уравнения гидролиза в ионно-молекулярной и молекулярной форме для следующих солей: и . Укажите рН среды.
- •Составьте уравнения электролитической диссоциации следующих электролитов: . Запишите выражения констант равновесия для слабых электролитов.
- •Напишите ионно-молекулярные уравнения реакций:
- •Напишите ионно-молекулярные уравнения реакций:
- •Составьте уравнения электролитической диссоциации следующих электролитов: . Запишите выражения констант равновесия для слабых электролитов.
- •Термодинамические свойства некоторых соединений
-
Определите тепловой эффект процессов, протекающих по уравнениям:
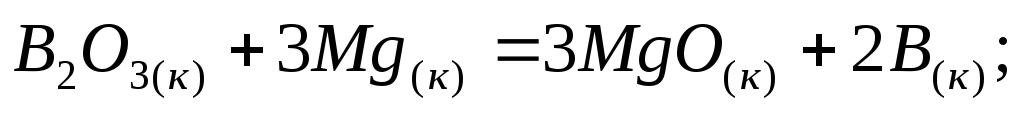
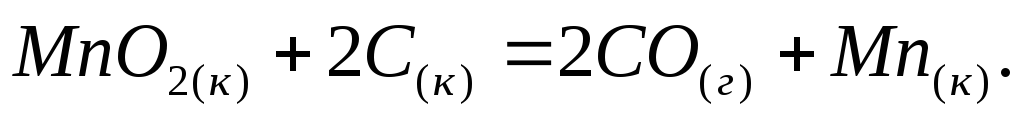
-
Исходя из значений стандартных теплот образования и абсолютных стандартных энтропий соответствующих веществ, вычислите
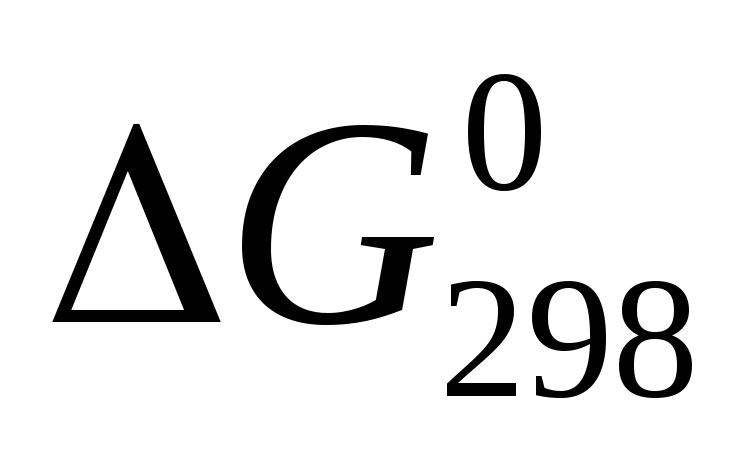 реакции, протекающей по уравнению
реакции, протекающей по уравнению
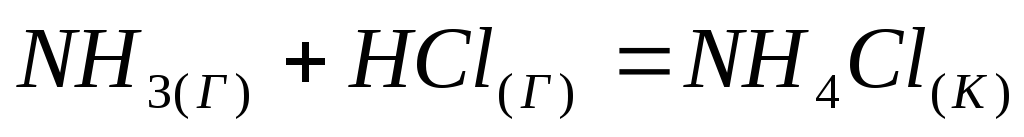 .
Возможен ли этот процесс при стандартных
условиях?
.
Возможен ли этот процесс при стандартных
условиях? -
Во сколько раз увеличится константа скорости химической реакции при повышении температуры на 40°, если γ=3,2?
-
Исходные концентрации
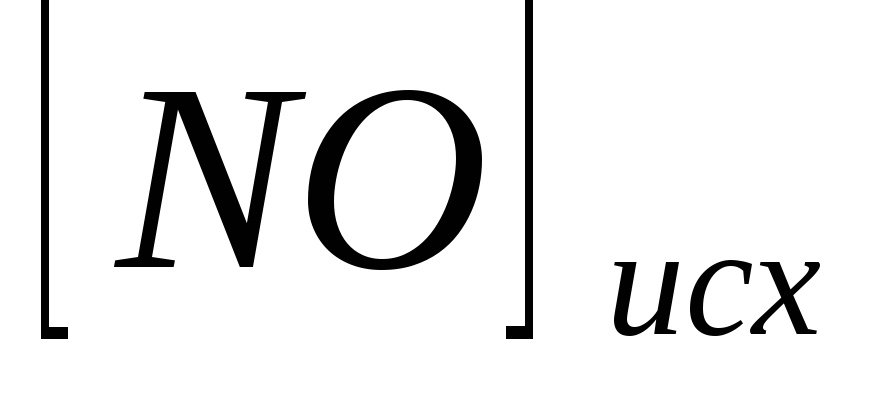 и
и
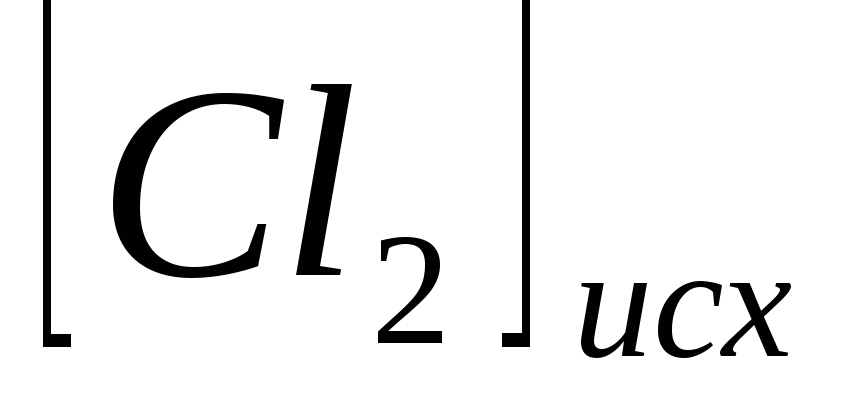 в гомогенной системе
в гомогенной системе
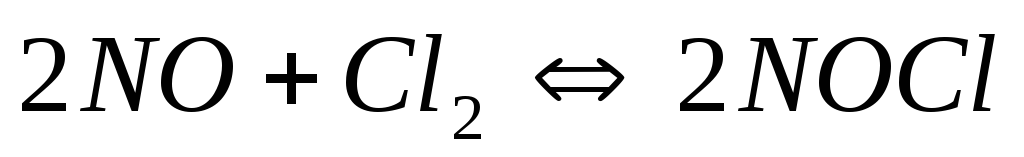 составляют соответственно 0,5 и 0,2 моль/л.
Вычислите константу равновесия, если
к моменту наступления равновесия
прореагировало 15 % NO.
составляют соответственно 0,5 и 0,2 моль/л.
Вычислите константу равновесия, если
к моменту наступления равновесия
прореагировало 15 % NO. -
Вычислите молярную концентрацию иодида калия, 1 л которого содержит 0,0025 г KI.
-
Составьте молекулярные и ионные уравнения реакций, протекающих при смешивании растворов: а) и ; б) и ; в) и .
-
Давление пара воды при 25ºС составляет 3167 Па. Вычислите для той же температуры давление пара раствора, в 375 г которого содержится 85 г глюкозы.
-
Составьте уравнения электролитической диссоциации следующих электролитов: . Запишите выражения констант равновесия для слабых электролитов.
-
Составьте уравнения гидролиза в ионно-молекулярной и молекулярной форме для следующих солей: и . Укажите рН среды.
Вариант 7.
-
Теплоты растворения
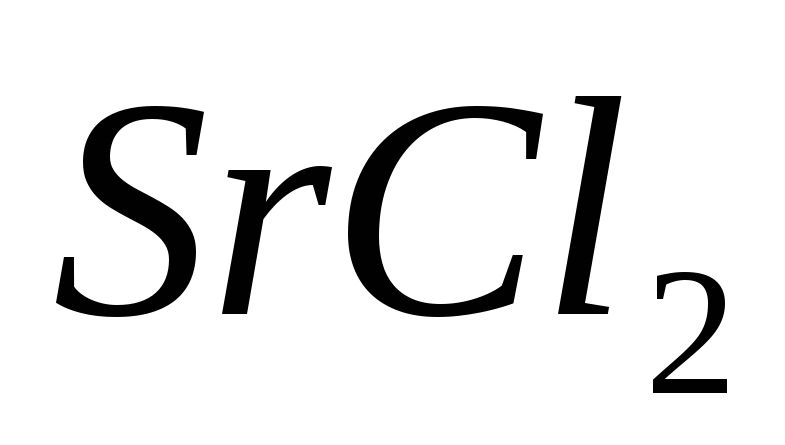 и
и
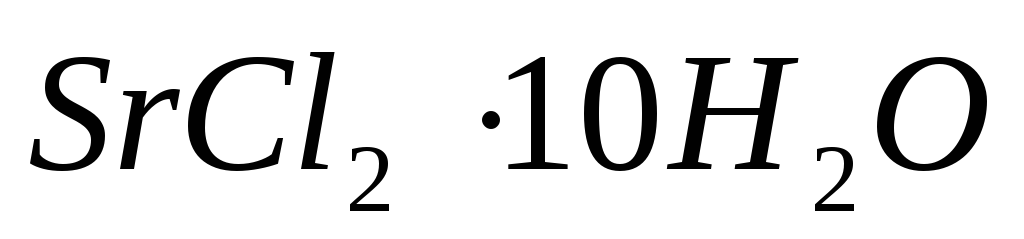 составляют соответственно – 47,7 и 31,0
кДж/моль. Вычислите изменение энтальпии
реакции:
составляют соответственно – 47,7 и 31,0
кДж/моль. Вычислите изменение энтальпии
реакции: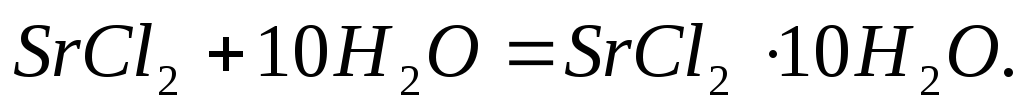
-
Не прибегая к расчетам, установите знак энтропии следующих реакций:
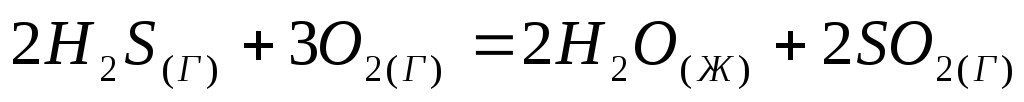 ;
;
![]() ;
;![]() ;
;
![]()
-
На сколько градусов следует повысить температуру системы, чтобы скорость протекающей в ней реакции возросла в 30 раз (γ=2,5)?
-
Почему при изменении давления смещается равновесие системы
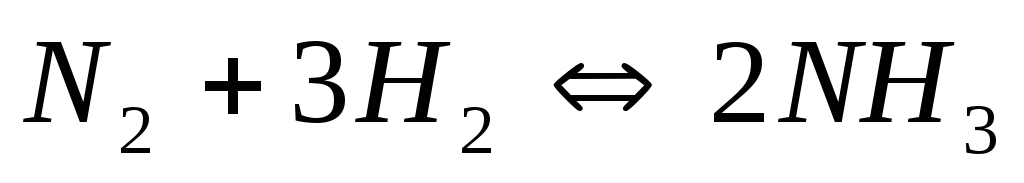 и не смещается равновесие системы
и не смещается равновесие системы
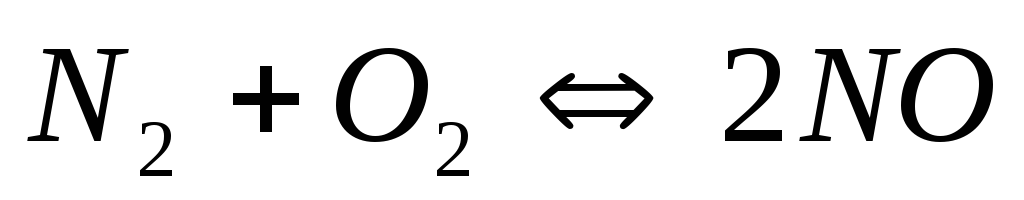 ?
Мотивируйте ответ, используя расчет
скоростей прямой и обратной реакций
до и после изменения давления. Составьте
уравнения для констант равновесия
обеих систем.
?
Мотивируйте ответ, используя расчет
скоростей прямой и обратной реакций
до и после изменения давления. Составьте
уравнения для констант равновесия
обеих систем. -
0.6 л раствора гидроксида калия содержит 16.8 г KOH . Чему равна молярная концентрация этого раствора?
-
Напишите ионно-молекулярные уравнения реакций:
![]() ;
;
![]() ;
;
![]() .
.
-
Сколько граммов глюкозы
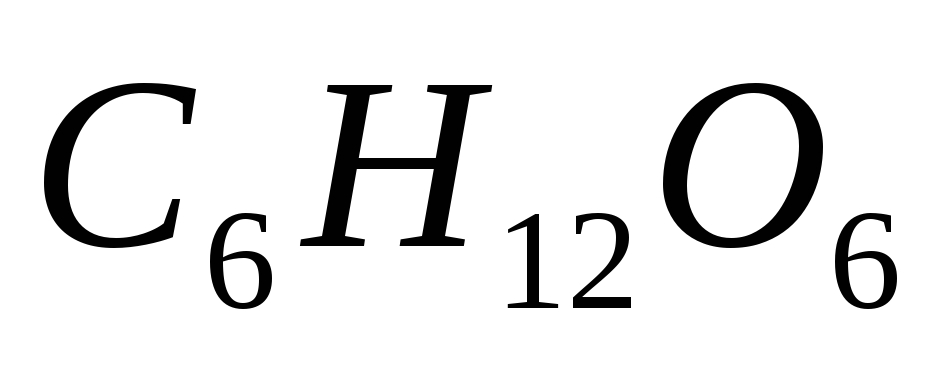 следует растворить в 300 г воды для
получения раствора, температура кипения
которого превышает температуру кипения
чистого растворителя на 0,06ºС?
Эбуллиоскопическая константа воды
равна 0,52 0.
следует растворить в 300 г воды для
получения раствора, температура кипения
которого превышает температуру кипения
чистого растворителя на 0,06ºС?
Эбуллиоскопическая константа воды
равна 0,52 0. -
Составьте уравнения электролитической диссоциации электролитов
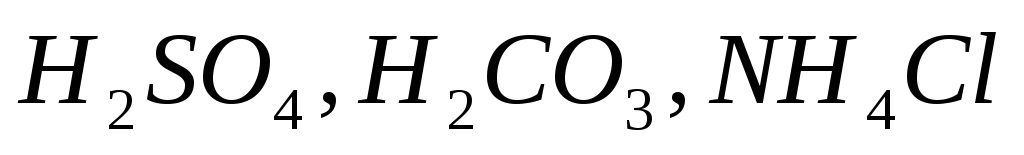 .
Объясните, какой из них легче распадается
на ионы и почему. Запишите выражение
для константы равновесия слабых
электролитов.
.
Объясните, какой из них легче распадается
на ионы и почему. Запишите выражение
для константы равновесия слабых
электролитов. -
Составьте уравнения гидролиза в ионно-молекулярной и молекулярной форме для следующих солей:
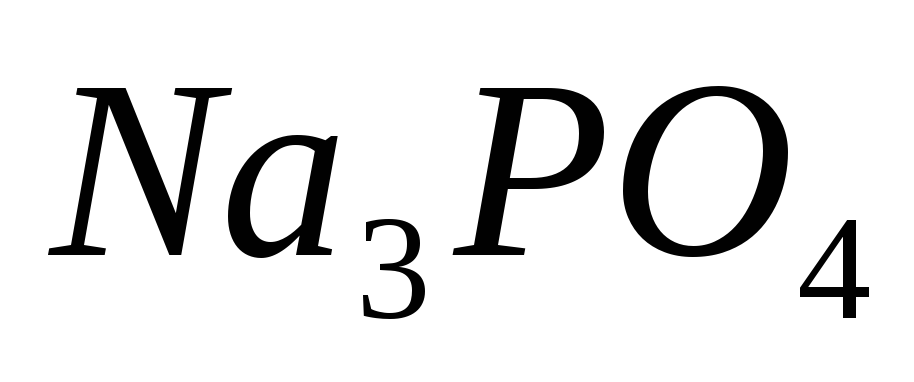 и
и
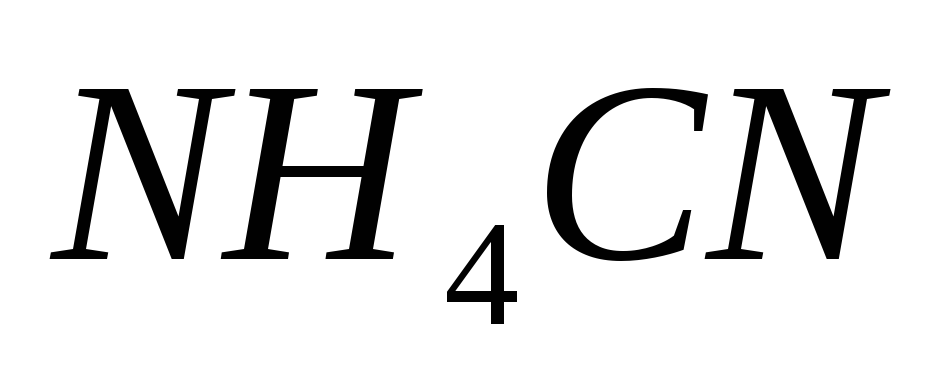 .
Укажите рН среды.
.
Укажите рН среды.
Вариант 8.
-
Вычислите изменение энтальпии следующих процессов:
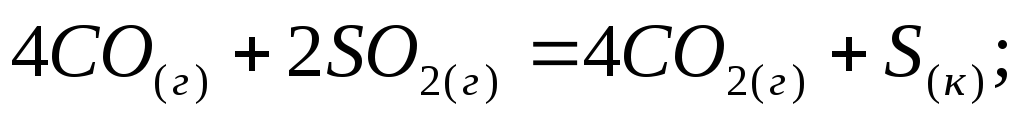

-
Как изменяется энтропия при фазовых переходах: а) алмаза в графит; б) воды в пар; в) воды в лед? Почему? Вычислите энтропию каждого превращения.
-
При повышении температуры на 50° скорость реакции возросла в 1200 раз. Вычислите γ.
-
Равновесие в гомогенной системе
 установилось при следующих концентрациях
реагирующих веществ
установилось при следующих концентрациях
реагирующих веществ
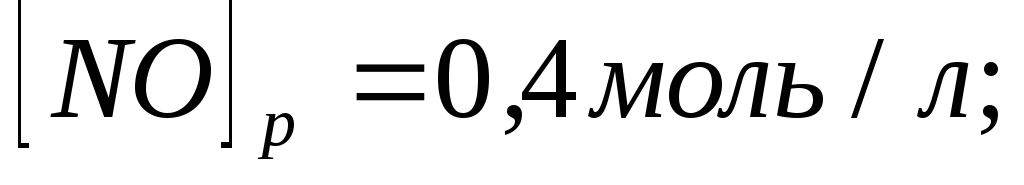
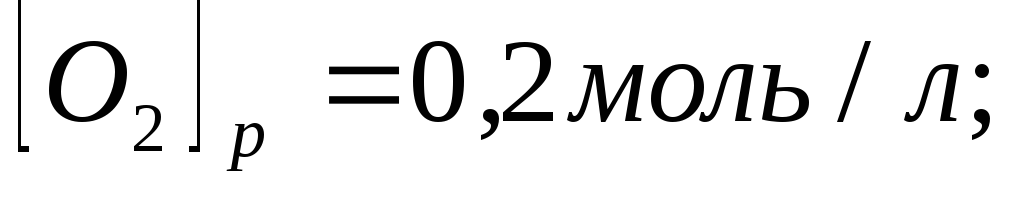
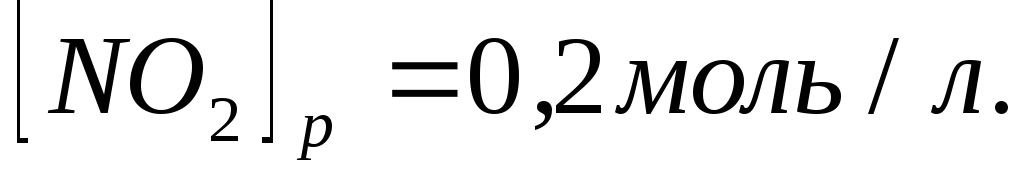 .
Вычислите константу равновесия и
исходную концентрацию оксида азота и
кислорода.
.
Вычислите константу равновесия и
исходную концентрацию оксида азота и
кислорода. -
Вычислите молярную концентрацию K2SO4, в 0.02 л которого содержится 2,74 г растворенного вещества.
-
Составьте молекулярные уравнения по ионно-молекулярным: ;
-
Вычислите осмотическое давление при 29ºС раствора сахара
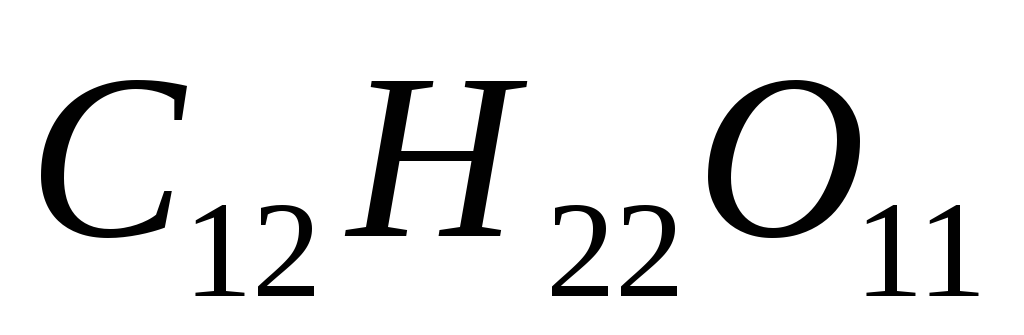 ,
1 л которого содержит 85 мг растворенного
вещества.
,
1 л которого содержит 85 мг растворенного
вещества. -
Составьте уравнения электролитической диссоциации следующих электролитов:
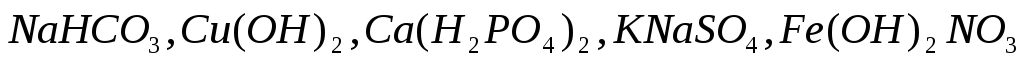 .
. -
Составьте уравнения гидролиза в ионно-молекулярной и молекулярной форме для следующих солей: и . Укажите рН среды.
Вариант 9.
