
- •Варианты контрольных заданий
- •Составьте уравнения гидролиза в ионно-молекулярной и молекулярной форме для следующих солей: и . Укажите рН среды.
- •Составьте уравнения гидролиза в ионно-молекулярной и молекулярной форме для следующих солей: и . Укажите рН среды.
- •Составьте уравнения гидролиза в ионно-молекулярной и молекулярной форме для следующих солей: и . Укажите рН среды.
- •Вычислите реакции, протекающей по уравнению, используя значения стандартных теплот образования и абсолютных стандартных энтропий веществ: .
- •Составьте уравнения гидролиза в ионно-молекулярной и молекулярной форме для следующих солей: и . Укажите рН среды.
- •Составьте молекулярные и ионные уравнения реакций, протекающих при смешивании растворов: а) и ; б) и ; в) и .
- •Составьте уравнения электролитической диссоциации следующих электролитов: . Запишите выражения констант равновесия для слабых электролитов.
- •Составьте уравнения гидролиза в ионно-молекулярной и молекулярной форме для следующих солей: и . Укажите рН среды.
- •Составьте молекулярные уравнения по ионно-молекулярным: ;
- •Составьте уравнения гидролиза в ионно-молекулярной и молекулярной форме для следующих солей: и . Укажите рН среды.
- •Вычислите реакции, протекающей по уравнению, используя значения стандартных теплот образования и абсолютных стандартных энтропий веществ: .
- •Составьте уравнения гидролиза в ионно-молекулярной и молекулярной форме для следующих солей: и . Укажите рН среды.
- •Напишите ионно-молекулярные уравнения реакций:
- •Составьте уравнения гидролиза в ионно-молекулярной и молекулярной форме для следующих солей: и . Укажите рН среды.
- •Составьте уравнения гидролиза в ионно-молекулярной и молекулярной форме для следующих солей: и . Укажите рН среды.
- •Составьте молекулярные уравнения по ионно-молекулярным: ;
- •Составьте уравнения электролитической диссоциации следующих электролитов: . Запишите выражения констант равновесия для слабых электролитов.
- •Составьте уравнения гидролиза в ионно-молекулярной и молекулярной форме для следующих солей: и . Укажите рН среды.
- •Составьте уравнения электролитической диссоциации электролитов . Объясните, какой из них легче распадается на ионы и почему. Запишите выражение для константы равновесия слабых электролитов.
- •Составьте уравнения гидролиза в ионно-молекулярной и молекулярной форме для следующих солей: и . Укажите рН среды.
- •Составьте уравнения гидролиза в ионно-молекулярной и молекулярной форме для следующих солей: и . Укажите рН среды.
- •Составьте уравнения гидролиза в ионно-молекулярной и молекулярной форме для следующих солей: и . Укажите рН среды.
- •Составьте уравнения электролитической диссоциации следующих электролитов: . Запишите выражения констант равновесия для слабых электролитов.
- •Напишите ионно-молекулярные уравнения реакций:
- •Напишите ионно-молекулярные уравнения реакций:
- •Составьте уравнения электролитической диссоциации следующих электролитов: . Запишите выражения констант равновесия для слабых электролитов.
- •Термодинамические свойства некоторых соединений
Варианты контрольных заданий
Вариант 1
-
Рассчитайте тепловой эффект реакции окисления оксида мышьяка озоном, протекающей по уравнению:

-
Дайте мотивированный ответ на вопрос, в каком состоянии при одной и той же температуре энтропия вещества больше: в газообразном или кристаллическом?
-
Напишите выражение для скорости химической реакции, протекающей в гомогенной системе по уравнению
 и определите, во сколько раз увеличится
скорость этой реакции, если: а) концентрация
вещества А увеличится в 2 раза; б)
концентрация вещества В увеличится в
2 раза; в) концентрация обоих веществ
увеличится в 2 раза.
и определите, во сколько раз увеличится
скорость этой реакции, если: а) концентрация
вещества А увеличится в 2 раза; б)
концентрация вещества В увеличится в
2 раза; в) концентрация обоих веществ
увеличится в 2 раза. -
Напишите выражение для константы равновесия следующих обратимых процессов: а)
 б)
б)
 .
. -
Какой объем 8%-ного раствора соли плотностью 1,15 г/см3 надо прибавить к ее 3%-ному раствору плотностью 1,08 г/см3 объемом 1 л, чтобы получить 5%-ный раствор карбоната натрия?
-
Составьте молекулярные и ионные уравнения реакций, протекающих при смешивании растворов: а) и
 ; б)
; б)
 и
и
 ;
в)
;
в)
 и
и
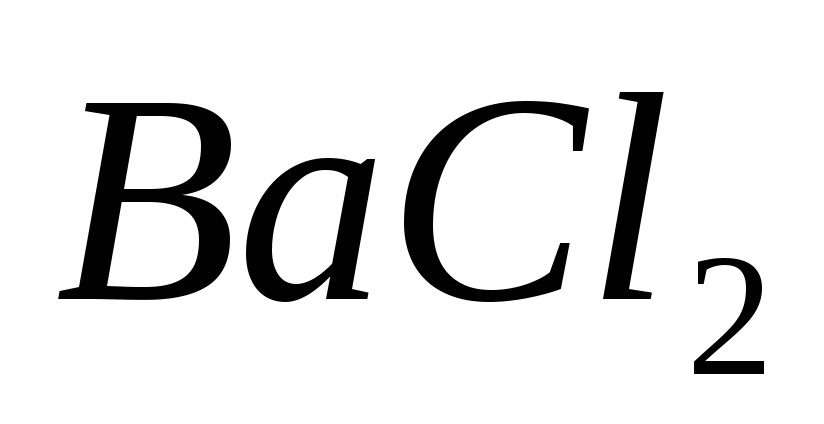 .
. -
Вычислите осмотическое давление раствора при 25ºС, в 1,5 л которого содержится 22,5 мг сахара
 (М=342).
(М=342). -
Составьте уравнения электролитической диссоциации следующих электролитов:
 .
Запишите выражения констант равновесия
для слабых электролитов.
.
Запишите выражения констант равновесия
для слабых электролитов. -
Составьте уравнения гидролиза в ионно-молекулярной и молекулярной форме для следующих солей:
 и
и
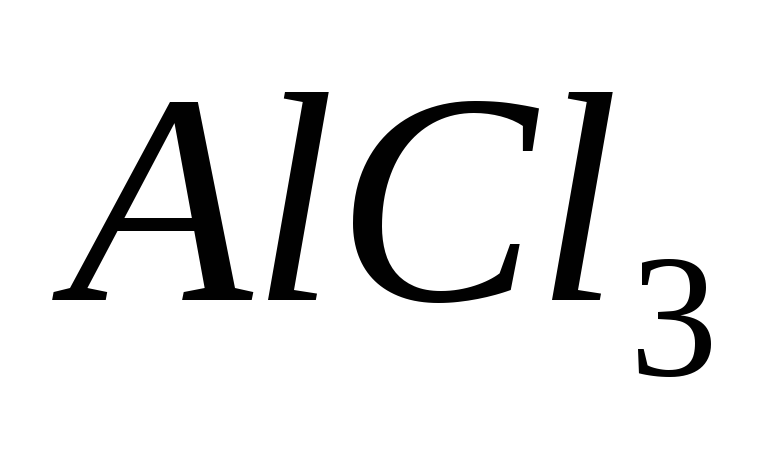 .
Укажите рН среды.
.
Укажите рН среды.
Вариант 2
-
Вычислите тепловой эффект реакции взаимодействия металлического натрия с водой.
-
Вычислите
 реакции,
протекающей по уравнению, используя
значения стандартных теплот образования
и абсолютных стандартных энтропий
веществ:
реакции,
протекающей по уравнению, используя
значения стандартных теплот образования
и абсолютных стандартных энтропий
веществ:
 .
. -
Во сколько раз следует увеличить концентрацию оксида углерода (׀׀) в системе 2СО = СО2 + С, чтобы скорость реакции увеличилась в 4 раза?
-
При синтезе аммиака равновесие установилось при следующих равновесных концентрациях веществ: [N2]=2.5, [H2]=1.8, [NH3]=3.6 моль/л. Рассчитайте значение константы равновесия и исходные концентрации.
-
Какой объем 0,6 н. раствора нужно прибавить к 750 мл 0,2н. раствора, чтобы получить 0,3н. раствор?
-
Напишите ионно-молекулярные уравнения реакций:
![]() ;
;
![]() ;
;
![]() .
.
-
Вычислите давление пара воды над 10%-ным раствором сахара
 при 100ºС.
при 100ºС. -
Вычислите концентрацию анионов
 ,
если концентрация катионов водорода
(моль/л) составляет: а) 2·10-9;
б) 1·10-5;
в) 0,5·10-6;
г) 3,5·10-3.
,
если концентрация катионов водорода
(моль/л) составляет: а) 2·10-9;
б) 1·10-5;
в) 0,5·10-6;
г) 3,5·10-3. -
Составьте уравнения гидролиза в ионно-молекулярной и молекулярной форме для следующих солей: и . Укажите рН среды.
Вариант 3.
-
Определите стандартное изменение энтальпии реакции горения этана
![]() ,
,
используя значения энтальпий образования исходных веществ и про- дуктов реакций.
-
Вычислите
 реакции восстановления
реакции восстановления
 углеродом:
углеродом:
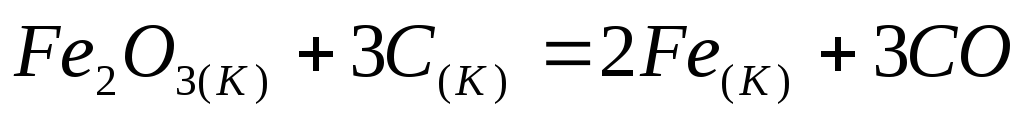 при стандартных условиях. Возможна ли
эта реакция при 800 К?
при стандартных условиях. Возможна ли
эта реакция при 800 К? -
Во сколько раз следует увеличить давление, чтобы скорость образования NO2 по реакции 2NO +O2 ↔ 2NO2, возросла в 1000 раз?
-
Как повлияет повышение давления и температуры на равновесие следующих обратимых реакций:
а)
![]() ;
б)
;
б)
![]()
в)
![]()
