
- •Бийский технологический институт (филиал)
- •Химическая кинетика и равновесие
- •Содержание
- •Введение
- •Теоретическая часть
- •Скорость химических реакций
- •Влияние природы реагирующих веществ на скорость химических реакций
- •Зависимость скорости химической реакции от концентрации
- •Зависимость скорости реакции от температуры
- •Кинетика гетерогенных реакций
- •Гомогенный и гетерогенный катализ
- •1.7 Механизмы химических реакций
- •1.8 Химическое равновесие
- •2 Экспериментальная часть
- •Контрольные вопросы
- •4 Примеры решения задач
- •Решение
- •Решение Первый случай:
- •5 Задачи для самостоятельного решения
- •Согласно заданному варианту выберете номера задач по таблице 2.10 и решите их.
- •6 Тесты
- •7 Техника безопасности
- •Литература
- •Химическая кинетика и равновесие
Решение
Количество (моль) газов после реакции:
PV/RT = 435∙20/(8,31∙873) = 1,20 моль
Если разложилось х моль аммиака, то схема разложения:
Осталось NH3 (1-х); получилось N2 (х/2) + H2 (3х/2)
Из уравнения: 1,20 моль = (1-x) + x/2 + 3x/2 = 1+x
получим x = 0,2 моль.
Ответ: Степень разложения аммиака 20 %.
Задача 11. Смешали по три моля веществ А, В, С. После установления равновесия А + В = 2С в системе обнаружили 5 моль вещества С. Рассчитайте константу равновесия. Определите равновесный состав смеси (в мольных %), полученной смешением веществ А, В, С в мольном соотношении 3:2:1 при той же температуре.
Решение Первый случай:
|
1 |
1 |
2 |
|
A + |
B = |
2C. |
Соотношение количества веществ (моль) соответствует соотношению их коэффициентов в уравнении. Если С стало на 2 моль больше (5 из 3), то количество А и В уменьшились на 1 моль каждое. В результате при установлении равновесия стало 5 моль С, по 2 моль А и В.
Константа равновесия:
К = [С] 2/([А][В]) = 25/2∙2 = 6,25
Второй случай:
Мольное соотношение то же, примем за х число молей прореагировавших А и В (они одинаковы):
|
x |
x 2 x |
|
|
A + |
B = 2C |
|
К = (1+2х) 2 /{(3-х)(2-х)} = 6,25.
х = 1,115.
Ответ: Мольные доли веществ в равновесной смеси:
(А) = (3-1,115)/6 = 0,314;
(В) = (2-1,115)/6 = 0,148;
(С) = 0,538.
Задача 12. Константа равновесия реакции N2 + 3H2 ↔ 2NH3 равна 0,1 (при 400 oС). Равновесные концентрации [Н2] = 0,2 моль/л и [NН3] = 0,08 моль/л. Вычислить начальную и равновесную концентрации азота.
Решение
Записываем выражение для константы равновесия К:
K = ([NH3]2/ ([N2]∙[H2]3)
Подставляем в выражение для К данные задачи:
0,1 = (0,082/ ([N2]∙0,23)
Отсюда рассчитываем равновесную концентрацию
[N2] = 8 моль/л
Далее находим начальную концентрацию азота, учитывая, что из одного моль азота согласно уравнению реакции образуется 2 моль аммиака, т.е. для получения 0,08 моль аммиака требуется 0,04 моль азота. Таким образом, начальная концентрация азота
[N2] = 8 + 0,04 =8,04 моль/л.
Ответ: Равновесная концентрация азота 8 моль/л, начальная – 8,04 моль/л.
Задача 13. Некоторая реакция при 0 oС протекает практически до конца за 4,5 часа (∼16384 с = 214 с). При какой температуре реакция пройдет практически до конца в 1 с (температурный коэффициент скорости равен 2).
Решение
Подставляем данные задачи в формулу (1.5):

находим t2/10 = 14. Отсюда: t2 = 140 oС.
Ответ: t2 = 140 oС.
Задача 14. Во сколько раз увеличится скорость реакции, протекающей при 300 К, если энергию активации уменьшить на 7 кДж/моль.
Решение
Воспользуемся уравнением (1.6). Запишем его для двух скоростей реакций при двух разных энергиях активации, отличающихся на 7 кДж, и поделим одно на другое:

Ответ: В 16,6 раза.
Задача 15. При 37 oС реакция заканчивается за 150 с, а при 47 oC – за 75 с. Вычислить энергию активации.
Решение
Найдем энергию активации по формуле (1.7).
 =
57,1 кДж/моль.
=
57,1 кДж/моль.
Ответ: 57,1 кДж/моль.
5 Задачи для самостоятельного решения
1. Окисление серы и ее диоксида протекает по уравнениям:
а) S(к) + O2 = SO2(г);
б) 2SO2(г) + О2 = 2SO3(г).
Как изменятся скорости этих реакций, если объемы каждой из систем уменьшить в четыре раза?
2. Напишите выражение для константы равновесия гомогенной системы: N2+3H2↔2NH3. Как изменится скорость прямой реакции – образования аммиака, если увеличить концентрацию водорода в три раза?
3.
Реакция идет по уравнению N2
+ O2
= 2NO. Концентрации исходных веществ до
начала реакции были:
 = 0,049 моль/л;
= 0,049 моль/л; =0,01
моль/л. Вычислите концентрацию этих
веществ в момент, когда [NO] = 0,005 моль/л.
=0,01
моль/л. Вычислите концентрацию этих
веществ в момент, когда [NO] = 0,005 моль/л.
Ответ: [N2] = 0,0465 моль/л; [O2]= 0,0075 моль/л.
4.
Реакция идет по уравнению N2+3H2=2NH3.
Концентрации участвующих в ней веществ
были:
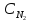 =
0,80 моль/л;
=
0,80 моль/л; = 1,5 моль/л;
= 1,5 моль/л; =
0,10 моль/л. Вычислите концентрацию
водорода и аммиака, когда [N2]
= 0,5 моль/л.
=
0,10 моль/л. Вычислите концентрацию
водорода и аммиака, когда [N2]
= 0,5 моль/л.
Ответ: [NH3] = 0,70 моль/л; [H2] = 0,60 моль/л.
5.
Реакция идет по уравнению H2
+ I2
= 2HI. Константа скорости этой реакции
при некоторой температуре равна 0,16.
Исходные концентрации реагирующих
веществ:
 =0,04
моль/л;
=0,04
моль/л; =0,05
моль/л. Вычислите начальную скорость
реакции и ее скорость, когда [H2]
= 0,03 моль/л.
=0,05
моль/л. Вычислите начальную скорость
реакции и ее скорость, когда [H2]
= 0,03 моль/л.
Ответ: 3,2 · 10-4; 1,92 · 10-4.
6. Вычислите, во сколько раз уменьшится скорость реакции, протекающей в газовой фазе, если понизить температуру от 120 до 80 оС. Температурный коэффициент скорости реакции 3.
7. Как изменится скорость реакции, протекающей в газовой фазе, при повышении температуры на 60 оС, если температурный коэффициент скорости данной реакции 2?
8. Во сколько раз изменится скорость реакции, протекающей в газовой фазе, при понижении температуры на 300 oС, если температурный коэффициент скорости данной реакции 2?
9. В гомогенной системе СО + Cl2 ↔ COCl2 равновесные концентрации реагирующих веществ: [CO] = 0,2 моль/л; [Cl2] = 0,3 моль/л; [COCl2] = 1,2 моль/л. Вычислите константу равновесия системы и исходные концентрации хлора и СО.
Ответ:
К
= 20;
 =
1,5 моль/л;
=
1,5 моль/л; =
1,4 моль/л.
=
1,4 моль/л.
10. В гомогенной системе А + 2В = С равновесные концентрации реагирующих газов: [A] = 0,06 моль/л; [B] = 0,12 моль/л; [C] = =0,216 моль/л. Вычислите константу равновесия системы и исходные концентрации веществ А и В.
Ответ:
К
= 250;
 =
0,276 моль/л;
=
0,276 моль/л; =
0,552 моль/л.
=
0,552 моль/л.
11. В гомогенной газовой системе А + B ↔ C + D равновесие установилось при концентрациях: [B] = 0,05 моль/л и [C] = 0,02 моль/л. Константа равновесия системы равна 0,04. Вычислите исходные концентрации веществ А и В.
Ответ:
 =
0,22 моль/л;
=
0,22 моль/л; =0,07 моль/л.
=0,07 моль/л.
12. Константа скорости реакции разложения N2O, протекающей по уравнению 2N2O = 2N2 + O2, равна 5 · 10-4. Начальная концентрация N2O = 6,0 моль/л. Вычислите начальную скорость реакции и ее скорость, когда разложится 50 % N2O.
Ответ: 1,8 ·10-2; 4,5 · 10-3.
13. Напишите выражение для константы равновесия гетерогенной системы СО2 + С ↔ 2СО. Как изменится скорость прямой реакции – образования СО, если концентрацию СО2 уменьшить в четыре раза? Как следует изменить давление, чтобы повысить выход СО?
14. Напишите выражение для константы равновесия гетерогенной системы С + Н2О(г) ↔ СО + Н2. Как следует изменить концентрацию и давление, чтобы сместить равновесие в сторону обратной реакции – образования водяных паров?
15. Равновесие гомогенной системы 4НСl(г) + О2 ↔ 2Н2О(г) + + 2Cl2(г) установилось при следующих концентрациях реагирующих веществ: [H2O] = 0,14 моль/л; [Cl2] = 0,14 моль/л; [HCl] = 0,20 моль/л; [O2] = 0,32 моль/л. Вычислите исходные концентрации хлороводорода и кислорода.
Ответ: [HCl]исх = 0,48 моль/л; [O2]исх = 0,39 моль/л.
16. Вычислите константу равновесия для гомогенной системы CO(г) + H2O(г) ↔ CO2(г)+H2(г), если равновесные концентрации реагирующих веществ: [CO] = 0,004 моль/л; [H2O] = 0,064 моль/л; [CO2] = =0,016 моль/л; [H2] = 0,016 моль/л. Чему равны исходные концентрации воды и СО? Ответ: К = 1; = 0,08 моль/л; =0,02 моль/л.
17.
Константа равновесия гомогенной системы
СО(г) + Н2О(г)
↔ ↔ СО2
+ Н2(г)
при некоторой температуре равна 1.
Вычислите равновесные концентрации
всех реагирующих веществ, если исходные
концентрации:
 CO=
0,10 моль/л;
CO=
0,10 моль/л;
 =
0,40 моль/л.
=
0,40 моль/л.
Ответ: [CO2] = [H2] = 0,08 моль/л; [CO] = 0,02 моль/л; [H2O] = =0,32 моль/л.
18. Константа равновесия гомогенной системы N2 + 3H2 ↔ 2NH3 при некоторой температуре равна 1. Равновесные концентрации водорода и аммиака соответственно равны 0,2 и 0,08 моль/л. Вычислите равновесную и исходную концентрацию азота.
Ответ:
[N2]
= 8 моль/л;
 =
8,04 моль/л.
=
8,04 моль/л.
19. При некоторой температуре равновесие гомогенной системы: 2NO + O2 ↔ 2NO2 установилось при следующих концентрациях реагирующих веществ: [NO] = 0,2 моль/л; [O2] = 0,1 моль/л; [NO2] = =0,1 моль/л. Вычислите константу равновесия и исходную концентрацию NO и О2.
Ответ:
К
= 2,5;
 =
0,3 моль/л;
=
0,3 моль/л; =
0,15 моль/л.
=
0,15 моль/л.
20. Почему при изменении давления смещается равновесие системы N2 + 3H2 ↔ 2NH3 и не смещается равновесие системы N2 + O2 ↔ ↔2NO? Ответ мотивируйте на основании расчета скорости прямой и обратной реакции в этих системах до, и после изменения давления. Напишите выражения для констант равновесия каждой из данных систем.
21. Исходные концентрации в гомогенной системе
2NO + Cl2 ↔ 2NOCl составляют соответственно 0,5 и 0,2 моль/л. Вычислите константу равновесия, если к моменту наступления равновесия прореагировало 20 % NO.
Ответ: 0,416.
22. Во сколько раз изменится скорость реакции 2А + В ↔ А2В, если концентрацию вещества А увеличить в 2 раза, а концентрацию вещества В уменьшить в два раза?
Ответ: возрастает в 2 раза.
23. Через некоторое время после начала реакции 3A + B ↔ 2C + D концентрации веществ составляли: [А] = 0,03 моль/л; [В] = 0,01 моль/л; [С] = 0,008 моль/л. Каковы исходные концентрации веществ А и В?
Ответ:
 А
= 0,042 моль/л;
А
= 0,042 моль/л;
 В
= 0,014 моль/л.
В
= 0,014 моль/л.
24. В системе СО + Cl2 ↔ СОCl2 концентрацию СО увеличили от 0,03 до 0,12 моль/л, а концентрацию хлора – от 0,02 до 0,06 моль/л. Во сколько раз возросла скорость прямой реакции?
Ответ: в 12 раз.
25. Как изменится скорость реакции 2NO(г) + О2(г) ↔ 2NO2(г), если:
а) увеличить давление в системе в 3 раза;
б) уменьшить объём системы в 3 раза;
в) повысить концентрацию NO в 3 раза?
Ответ мотивируйте на основании расчета скорости прямой реакции до и после изменения условий.
26. Чему равен температурный коэффициент скорости реакции, если при увеличении температуры на 30 градусов скорость реакции возрастает в 15,6 раза?
Ответ: 2,5.
27. Температурный коэффициент скорости некоторой реакции равен 2,3. Во сколько раз увеличится скорость этой реакции, если повысить температуру на 25 градусов?
Ответ: в 8 раз.
28. Равновесие в системе Н2(г) + I2(г) ↔ 2НI(г) установилось при следующих концентрациях: [H2] = 0,025 моль/л; [I2] = 0,005 моль/л; [HI] = 0,09 моль/л. Определить исходные концентрации йода и водорода.
Ответ:
 =
0,07 моль/л;
=
0,07 моль/л; =
0,05 моль/л.
=
0,05 моль/л.
29. В каком направлении сместятся равновесия:
2СО(г) + О2(г) ↔ 2СО2(г); ∆fН = - 566 кДж;
N2(г) + О2(г) ↔ 2NО(г); ∆fН = 180 кДж
а) при понижении температуры; б) при повышении давления?
30. Как повлияет на равновесие следующих реакций:
2Н2(г) + О2(г)↔2Н2О(г); ∆fН = – 483,6 кДж;
СаСО3(к) ↔ СаО(к) + СО2(г); ∆fН =179 кДж
а) повышение давления; б) повышение температуры?
31. Указать, какими изменениями концентраций реагирующих веществ и давления можно сместить вправо равновесие реакции СО2(г) + С(графит) ↔2СО(г).
32. В загрязненном воздухе содержится примесь CO, которая образуется при неполном сгорании твердого топлива и при работе двигателей внутреннего сгорания. Монооксид углерода медленно окисляется кислородом воздуха до диоксида углерода. При определенных условиях скорость такой реакции составляет 0,05 моль/(л.с), а концентрация CO2 становится равной 0,2 моль/л. Рассчитайте концентрацию CO2 через 10 с после указанного момента.
Ответ: 0,7 моль/л.
33. Один из важных видов сырья для органического синтеза – «водяной газ», смесь водорода и монооксида углерода, которая получается при пропускании водяного пара через башни, наполненные раскаленным углем. Водяной газ служит для получения метанола, формальдегида и других химических продуктов. Рассчитайте значение константы скорости реакции получения водяного газа, если при концентрации H2O, равной 0,03 моль/л, скорость реакции составляет 6,1 . 10--5 моль/(л.с).
Ответ: 2,0 . 10-3 с-1.
34. Атмосферные загрязнения постепенно уничтожают защитный озоновый слой Земли. В реакциях разложения озона участвуют многие газы, но прежде всего оксиды азота. Взаимодействие монооксида азота с озоном приводит к образованию дикислорода и диоксида азота. Рассчитайте скорость этой реакции, если через 25 с после начала реакции молярная концентрация озона была 0,8 моль/л, а через 55 с (от начала реакции) стала равна 0,02 моль/л.
Ответ: 0,026 моль/(л с).
35. На больших высотах солнечное излучение вызывает диссоциацию молекул кислорода на атомы. Столкновение атомов кислорода и молекул дикислорода приводит к образованию озона, слой которого защищает Землю от коротковолнового излучения Солнца, смертельно опасного для живых организмов. Определите скорость этой реакции, если через 1 мин после ее начала концентрация озона была равна
0,024 моль/л, а через 2 мин после этого момента − 0,064 моль/л.
Ответ: 6,7 . 10-4 моль/(л с).
36. Причиной образования опасного для здоровья тумана – «смога» −считают большое количество выхлопных газов автомобилей при высокой влажности воздуха. Помимо озона, в смоге присутствует ядовитый диоксид азота, который получается по реакции монооксида азота с атомарным кислородом. Рассчитайте скорость этой реакции, если через 5 минут после ее начала концентрация диоксида азота стала равна 0,05 моль/л, а через 20 минут − 0,08 моль/л.
Ответ: 3,3 . 10-5 моль/(л с).
37. В гетерогенных химических системах при постоянных термодинамических параметрах установилось состояние равновесия:
а) TiO2(т) + 2C(т) + 2Cl2(г) ↔TiCl4(г) + 2CO(г)
б) Mg3N2(т) + 6H2O(г) ↔ 3Mg(OH)2(т) + 2NH3(г)
в) Si(т) + 2H2O(г) ↔SiO2(т) + 2H2(г)
г) CS2(г) + 2Cl2(г) ↔CCl4(г) + 2S(т)
д) 2NO2(г) + 2S(т) ↔N2(г) + 2SO2(г)
e) 10NO(г) +P4(г) ↔ 5N2(г) +P4O10(г)
На основании закона действующих масс составьте выражение для константы равновесия.
38. На основании принципа Ле Шателье определите, в каком направлении сместится равновесие в следующих системах при повышении температуры:
a) 2NO(г) + O2(г) ↔ 2NO2(г); ∆Н° < 0;
б) 2SO3(г) ↔ 2SO2(г) +O2(г); ∆Н° > 0;
в) C(т) +CO2(г) ↔ 2CO(г); ∆Н° > 0;
г) 2NH3(г) ↔N2(г) + 3H2(г); ∆Н° > 0;
д) C(т) + 2Cl2(г) ↔CCl4(г); ∆Н° < 0;
е) C(т) + 2N2O(г) ↔CO2(г) + 2N2(г); ∆Н° < 0.
39. На основании принципа Ле Шателье определите, в каком направлении сместится равновесие в следующих системах при повышении давления (Т = const):
a) 2Fe(т) + 3H2O(г) ↔ Fe2O3(т) + 3H2(г)
б) C3H8(г) + 5O2(г) ↔ 3CO2(г) + 4H2O(г)
в) CO2(г) + 2N2(г) ↔C(т) + 2N2O(г)
г) CO(г) + Cl2(г) ↔CCl2O(г)
д) CH4(г) + 4S(т) ↔CS2(г) + 2Н2S(г)
е) N2H4(г) +O2(г) ↔N2(г) + 2H2O(г)
40. На основании принципа Ле Шателье определите, увеличится ли выход продуктов при одновременном понижении температуры и давления в системах:
a) С(т) +O2(г) ↔ СO2(г); ∆Н° < 0;
б) Н2(г) +I2(т) ↔ 2HI(г); ∆Н° > 0;
в) 6HF(г) +N2(г) ↔ 2NF3(г) + 3H2(г); ∆Н° > 0;
г) 2O3(г) ↔ 3O2(г); ∆Н° < 0;
д) 2CO(г) ↔ 2C(т) +O2(г); ∆Н° > 0;
е) I2(т) + 5CO2(г) ↔ I2O5(т) + 5CO(г); ∆Н° > 0.
41. На основании принципа Ле Шателье определите, увеличится ли выход продуктов при повышении температуры и понижении давления одновременно:
a) С(т) +H2O(г) ↔ СO(г) +H2(г); ∆Н° > 0;
б) 2NO(Cl)(г) +Br2(г) ↔ 2NO(Br)(г) +Cl2(г); ∆Н° > 0;
в) CO(г) + 2H2(г) ↔ CH3OH(г); ∆Н° < 0;
г) N2O4(г) ↔ 2NO2(г); ∆Н° > 0;
д) 8H2S(г) + 8I2(т) ↔S8(т) + 16HI(г); ∆Н° > 0;
е) 2CO(г) +O2(г) ↔ 2CO2(г); ∆Н° < 0.
