
- •Лабораторная работа №1
- •1. Окси-, оксокислоты
- •1.1.Гидроксикарбоновые кислоты Опыт1. Свойства молочной кислоты
- •Опыт 2. Свойства винной кислоты.
- •Опыт 3. Получение цитрата кальция
- •2.1. Кетокислоты. Ацетоуксусный эфир Опыт 4. Получение пировиноградной кислоты окислением молочной кислоты
- •Опыт 5. Свойства ацетоуксусного эфира
- •1.3. Ароматические оксикислоты Опыт 6. Взаимодействие бензойной, коричной и салициловой кислот с бромной водой
- •Опыт 7. Отношение бензойной и коричной кислот к перманганату калия
- •Опыт 8. Реакции бензойной и салициловой кислот с хлоридом железа (III)
- •Опыт 9. Взаимодействие эфиров салициловой кислоты с хлоридом железа (III)
- •Опыт 10. Образование фталевого ангидрида
- •2.2. Аминокислоты Опыт 12. Свойства аминокислот
- •2.3. Мочевина Опыт 13. Свойства мочевины
- •Ароматические амины Опыт14. Растворимость анилина и его солей в воде. Основные свойства анилина
- •Опыт 15. Взаимодействие анилина с бромной водой
- •Опыт 16. Ацилирование анилина
- •Опыт 17. Окисление анилина
- •2.5. Диазо- и азосоединения Опыт 18. Реакция диазотирования анилина (получение соли диазония)
- •Опыт 19. Разложение соли диазония (реакция с выделением азота)
- •Опыт 20. Реакции солей диазония без выделения азота (реакции азосочетания)
- •Опыт 21. Крашение шерсти и шелка кислотными азокрасителями
- •Опыт 22. Крашение хлопчатобумажной ткани (ледяное крашение)
- •Лабораторная работа №3
- •3. Углеводы
- •3.1. Моносахариды Опыт 23. Качественная реакция на углеводы с α -нафтолом (реакция Молиша)
- •Опыт 24. Реакции моносахаридов по карбонильной группе
- •Опыт 25. Реакции на гидроксильные группы в моносахаридах
- •Опыт 26. Цветные реакции на моносахариды
- •3.2. Дисахариды Опыт 27. Реакции на гидроксильные группы дисахаридов
- •Опыт 28. Реакции дисахаридов по карбонильной группе. Сравнение свойств восстанавливающих и невосстанавливающих дисахаридов
- •Опыт 29. Гидролиз (инверсия) сахарозы
- •Опыт 30. Реакция сахарозы с сульфатами кобальта и никеля
- •3.3. Высшие полисахариды Опыт 31. Отношение полисахаридов к реактиву Фелинга
- •Опыт 32. Взаимодействие крахмала и гликогена с иодом
- •Опыт 33. Гидролиз крахмала
- •Опыт 34. Кислотный гидролиз клетчатки
- •Лабораторная работа №4
- •Гетероциклические соединения Опыт 35. Получение фурфурола и его свойства
- •Опыт 36. Получение «белого» индиго и кубовое крашение
- •Опыт 37. Пиридин и его свойства
- •Опыт 38. Мочевая кислота
Опыт 10. Образование фталевого ангидрида
Реактивы и оборудование:фталевая кислота; пробирки.
В сухую пробирку помещают 0,5 г фталевой кислоты и нагревают на небольшом пламени. При этом образуется фталевый ангидрид, который возгоняется и оседает на холодных стенках пробирки в виде белых кристаллов:

Лабораторная работа №2
2. АЗОТСОДЕРЖАЩИЕ СОЕДИНЕНИЯ
2.1. АМИНЫ АЛИФАТИЧЕСКОГО РЯДА
Опыт 11. Свойства аминов
Реактивы и оборудование:0,2М растворы (в капельницах): аммиака, первичного, вторичного и третичного аминов, универсальная индикаторная бумага со шкалой рН, хлорид метиламмония, натронная известь, концентрированная соляная кислота, 3%-ный раствор хлорида железа (III), 3%-ный раствор сульфата меди (II), 10%-ный раствор нитрита натрия, ледяная уксусная кислота; изогнутые газоотводные трубки, пробирки.
11.1. Сравнение основных свойств первичных, вторичных, третичных аминов и аммиака.На полоски универсальной индикаторной бумаги наносят по капле растворов первичного, вторичного, третичного аминов и аммиака. Сравнивают окраску пятен на индикаторных бумажках со шкалой рН и определяют значение рН исследуемых аминов и аммиака.
11.2. Образование солей аминов.В сухую пробирку помещают 0,5—1 г хлорида метиламмония и 1—2 г натронной извести. Смесь тщательно перемешивают стеклянной палочкой. Пробирку закрывают пробкой с газоотводной трубкой и закрепляют в лапке штатива. Реакционную смесь нагревают на газовой горелке.
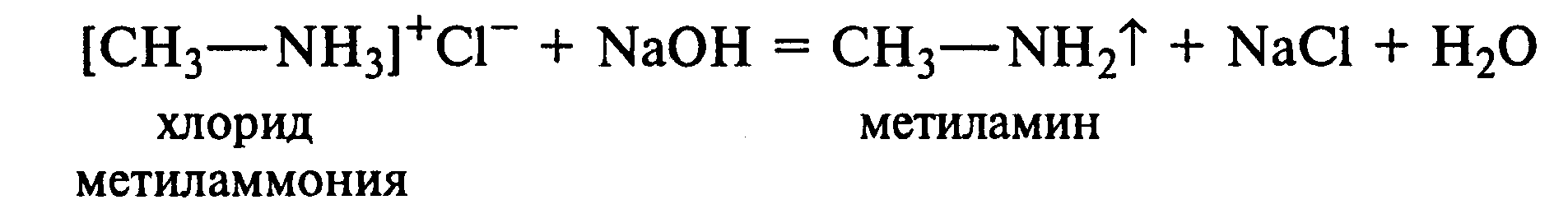
К отверстию пробирки, из которой выделяется газообразный метиламин, подносят стеклянную палочку, смоченную концентрированной соляной кислотой. Палочка окутывается туманом:
CH3 - NH2 + HCl = [CH3 - NH3]+Cl-
Метиламин (основание) взаимодействует с соляной кислотой с образованием твердой соли — хлорида метиламмония, частички которой воспринимаются как туман.
В две пробирки наливают по 2 мл 3%-ного раствора хлорида железа (III) и 3%-ного раствора сульфата меди (II). Через оба раствора пропускают газообразный метиламин. В пробирке с хлоридом железа (III) выпадает бурый осадок, в пробирке с сульфатом меди (II) — осадок голубого цвета, который растворяется в избытке метиламина с образованием комплексной соли ярко-синего цвета.
Метиламин, пропускаемый через водные растворы солей, прекрасно растворяется в воде с образованием гидроксида метиламмония:
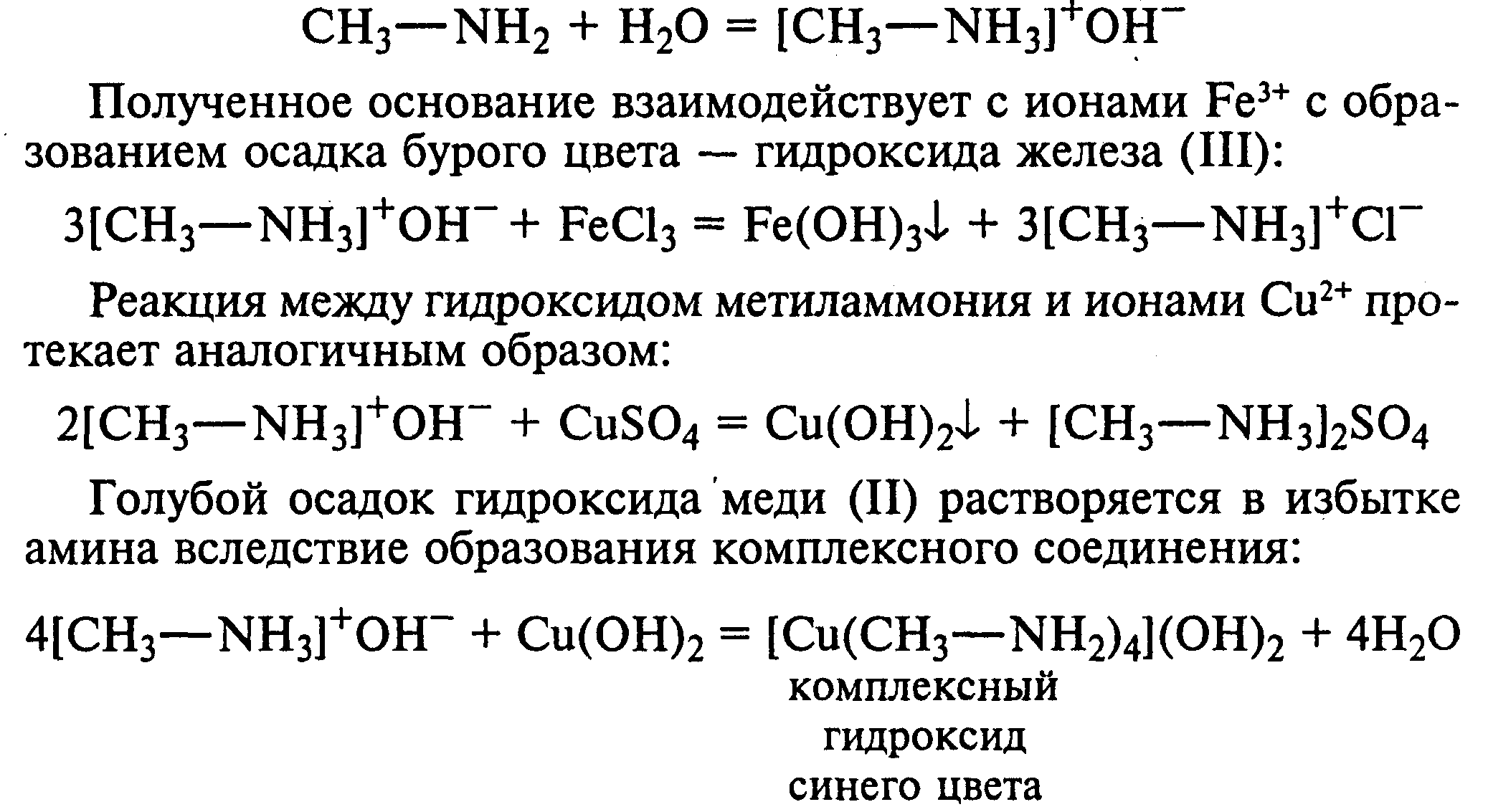
11.3. Взаимодействие первичных аминов с азотистой кислотой. Эту реакцию используют как качественную реакцию на первичные амины алифатического ряда.
В пробирку с 0,2 г хлорида метиламмония приливают 1 мл воды, а затем, после растворения соли, вносят 1 мл 10%-ного раствора нитрита натрия. Смесь тщательно перемешивают. При добавлении к реакционной смеси нескольких капель ледяной уксусной кислоты выделяется азот в виде мелких пузырьков.

![]()
2.2. Аминокислоты Опыт 12. Свойства аминокислот
Реактивы и оборудование:2%-ный раствор аминоуксусной кислоты (глицина), 10%-ный раствор аминоуксусной кислоты, 1%-ный раствор аминоуксусной кислоты, растворы индикаторов (метиловый оранжевый, метиловый красный, лакмус), карбонат меди (II), 10%-ный раствор гидроксида натрия, 10%-ный раствор нитрита натрия, ледяная уксусная кислота, 0,1%-ный раствор нингидрина в ацетоне; химические стаканы
на 100 мл, лед, водяные бани, пробирки.
12.1. Отношение аминокислот к индикаторам.В три пробирки наливают по 1 мл 2%-ного раствора глицина и добавляют по 12 капли растворов индикаторов: в первую пробирку — метиловый оранжевый, во вторую — метиловый красный, в третью -лакмус. Окраска индикаторов не изменяется. Это объясняется тем, что моноаминомонокарбоновые кислоты (в частности глицин) в водных растворах существуют в виде биполярных ионов, при- чем кислотность карбоксильной группы уравновешивается основностью аминогруппы, поэтому водные растворы этих аминокислот имеют нейтральную реакцию среды:
![]()
12.2. Образование медной соли аминоуксусной кислоты.В сухую пробирку вносят 0,5 г карбоната меди (II) и 1,5—2 мл 2%-ного раствора аминоуксусной кислоты. Реакционную смесь нагревают на пламени горелки. После нагревания хорошо видна синяя окраска раствора. Часть раствора переливают в другую пробирку и добавляют к нему 2 капли 10%-ного раствора гидроксида натрия. Выпадает ли осадок гидроксида меди (II)? Приведите объяснение.
Оставшуюся часть жидкости охлаждают в стакане с ледяной водой. Постепенно выпадают кристаллы труднорастворимой медной соли аминоуксусной кислоты. Обычно для ускорения процесса кристаллизации стенку пробирки потирают стеклянной палочкой.

Образование комплексных окрашенных в синий цвет медных солей характерно для α -аминокислот.
12.3. Взаимодействие аминокислот с азотистой кислотой.Аминокислоты, как и первичные амины, взаимодействуют с азотистой кислотой с выделением азота. Эту реакцию используют для количественного определения аминокислот.
К 1 мл 10%-ного раствора глицина приливают 1 мл 10%-ного раствора нитрита натрия и 1—2 капли ледяной уксусной кислоты. При встряхивании пробирки наблюдается выделение азота в виде мелких пузырьков.
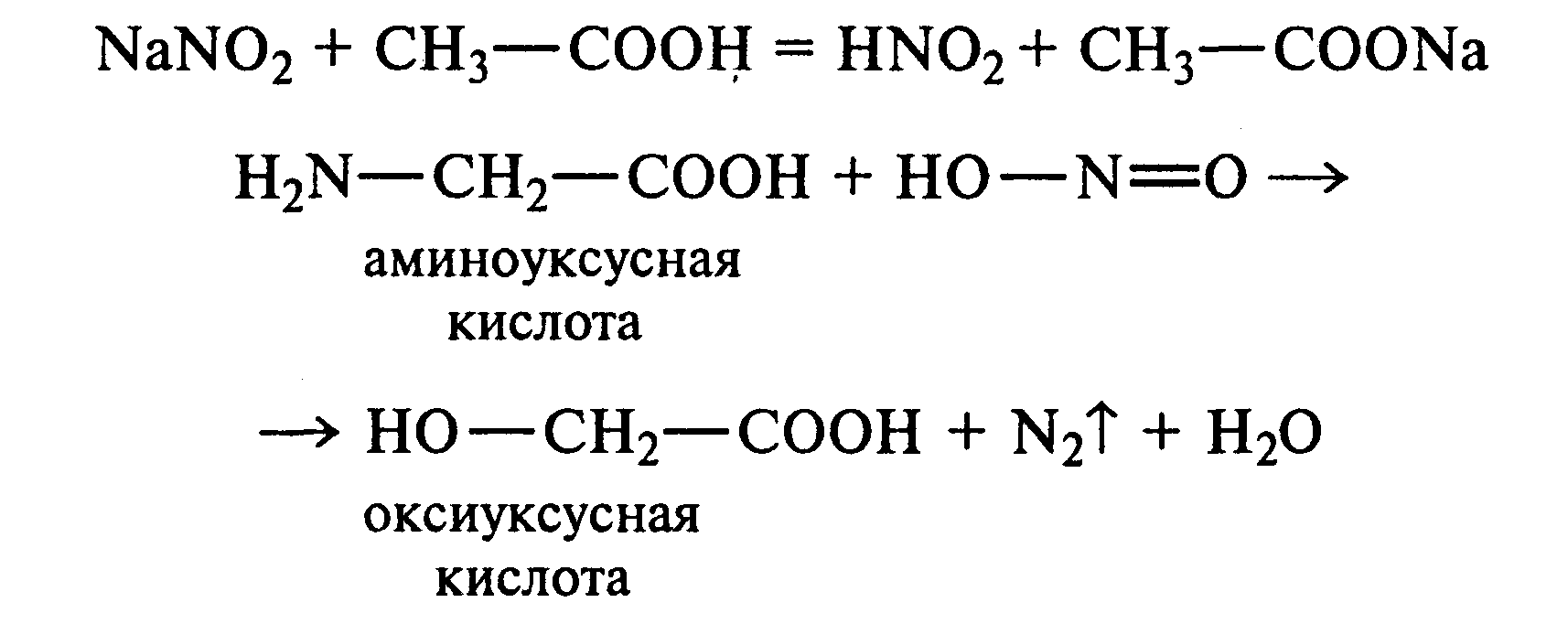
12.4. Цветная реакция аминокислот с нингидрином.Реакция с нингидрином очень чувствительна, поэтому ее часто применяют для качественного и количественного анализа α -аминокислот.
К 2—3 мл 1%-ного раствора аминоуксусной кислоты добавляют 2—3 капли 0,1%-ного раствора нингидрина в ацетоне. Содержимое пробирки встряхивают и нагревают на горячей водяной бане. Через некоторое время появляется фиолетовая окраска с синим оттенком.
Различные α -аминокислоты с нингидрином образуют окрашенные соединения, отличающиеся оттенком. Механизм реакции α -аминокислот с нингидрином подробно рассматривается в курсе биохимии.
