
- •Лабораторная работа №1
- •1. Окси-, оксокислоты
- •1.1.Гидроксикарбоновые кислоты Опыт1. Свойства молочной кислоты
- •Опыт 2. Свойства винной кислоты.
- •Опыт 3. Получение цитрата кальция
- •2.1. Кетокислоты. Ацетоуксусный эфир Опыт 4. Получение пировиноградной кислоты окислением молочной кислоты
- •Опыт 5. Свойства ацетоуксусного эфира
- •1.3. Ароматические оксикислоты Опыт 6. Взаимодействие бензойной, коричной и салициловой кислот с бромной водой
- •Опыт 7. Отношение бензойной и коричной кислот к перманганату калия
- •Опыт 8. Реакции бензойной и салициловой кислот с хлоридом железа (III)
- •Опыт 9. Взаимодействие эфиров салициловой кислоты с хлоридом железа (III)
- •Опыт 10. Образование фталевого ангидрида
- •2.2. Аминокислоты Опыт 12. Свойства аминокислот
- •2.3. Мочевина Опыт 13. Свойства мочевины
- •Ароматические амины Опыт14. Растворимость анилина и его солей в воде. Основные свойства анилина
- •Опыт 15. Взаимодействие анилина с бромной водой
- •Опыт 16. Ацилирование анилина
- •Опыт 17. Окисление анилина
- •2.5. Диазо- и азосоединения Опыт 18. Реакция диазотирования анилина (получение соли диазония)
- •Опыт 19. Разложение соли диазония (реакция с выделением азота)
- •Опыт 20. Реакции солей диазония без выделения азота (реакции азосочетания)
- •Опыт 21. Крашение шерсти и шелка кислотными азокрасителями
- •Опыт 22. Крашение хлопчатобумажной ткани (ледяное крашение)
- •Лабораторная работа №3
- •3. Углеводы
- •3.1. Моносахариды Опыт 23. Качественная реакция на углеводы с α -нафтолом (реакция Молиша)
- •Опыт 24. Реакции моносахаридов по карбонильной группе
- •Опыт 25. Реакции на гидроксильные группы в моносахаридах
- •Опыт 26. Цветные реакции на моносахариды
- •3.2. Дисахариды Опыт 27. Реакции на гидроксильные группы дисахаридов
- •Опыт 28. Реакции дисахаридов по карбонильной группе. Сравнение свойств восстанавливающих и невосстанавливающих дисахаридов
- •Опыт 29. Гидролиз (инверсия) сахарозы
- •Опыт 30. Реакция сахарозы с сульфатами кобальта и никеля
- •3.3. Высшие полисахариды Опыт 31. Отношение полисахаридов к реактиву Фелинга
- •Опыт 32. Взаимодействие крахмала и гликогена с иодом
- •Опыт 33. Гидролиз крахмала
- •Опыт 34. Кислотный гидролиз клетчатки
- •Лабораторная работа №4
- •Гетероциклические соединения Опыт 35. Получение фурфурола и его свойства
- •Опыт 36. Получение «белого» индиго и кубовое крашение
- •Опыт 37. Пиридин и его свойства
- •Опыт 38. Мочевая кислота
Опыт 37. Пиридин и его свойства
Реактивы и оборудование:пиридин, 2%-ный раствор хлорида железа (III), 2%-ный раствор сульфата меди, насыщенный раствор пикриновой кислоты (свежеприготовленный), красная лакмусовая бумага; пробирки.
371. Растворимость пиридина в воде и его основные свойства. Пиридин быстро и в любых соотношениях растворяется в воде. К 1 мл пиридина приливают 5 мл воды. Каплю полученного раствора наносят на красную лакмусовую бумагу. Водный раствор пиридина проявляет слабые основные свойства:
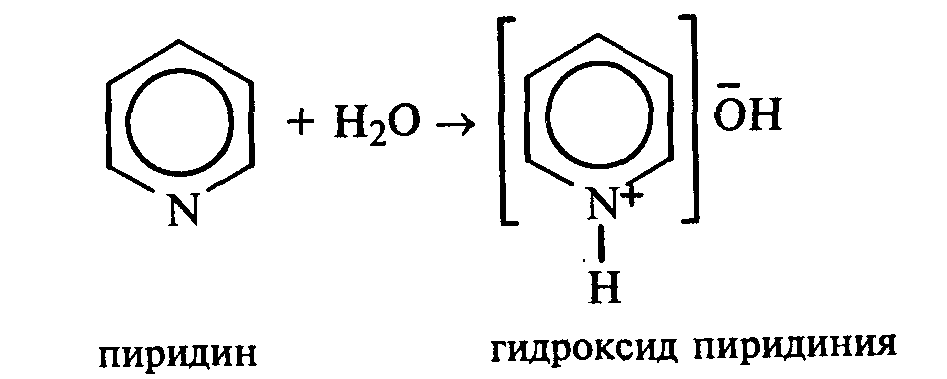
К капле пиридина осторожно прибавляют концентрированную соляную кислоту. Реакционная смесь сильно разогревается, и выпадает белый осадок. К полученному осадку приливают воду. Наблюдают его растворение.
Напишите уравнение реакции пиридина с соляной кислотой.
37.2.Образование солей пиридина.В две пробирки наливают по 1мл 2%-ных растворов хлорида железа (III) и сульфата меди и добавляют по 1—2 капли раствора пиридина, полученного в предыдущем опыте. В пробирке с хлоридом железа (III) выпадает осадок бурого цвета:

В пробирке с сульфатом меди сначала выпадает голубой осадок гидроксида меди (II):

В избытке пиридина осадок гидроксида меди (II) быстро ра- створяется с образованием комплексной соли ярко-синего цвета.
Опыт 38. Мочевая кислота
Реактивы и оборудование: мочевая кислота, 10%-ный раствор гидро- ксида натрия, разбавленная соляная кислота, реактив Фелинга; про- бирки.

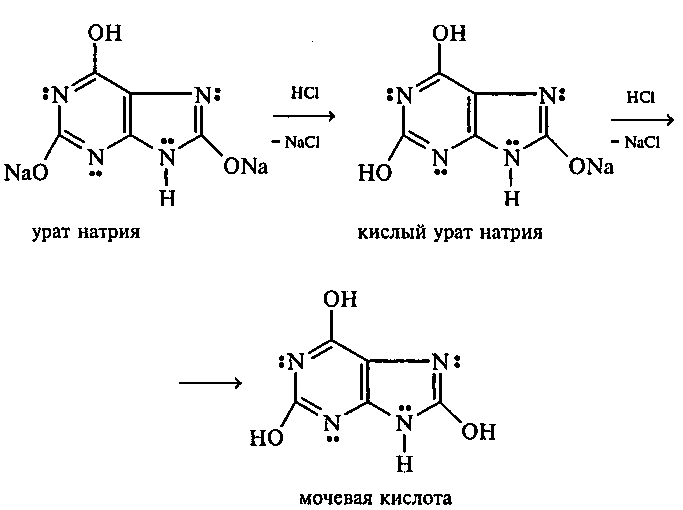
Несколько кристаллов мочевой кислоты растворяют в 1—2 мл воды. Смесь нагревают и отмечают, что даже при нагревании мо- чевая кислота плохо растворима в воде. После охлаждения про- бирки в нее приливают 10%-ный раствор гидроксида натрия до полного растворения мочевой кислоты. Образуется двузамещен- ная соль урат натрия. Необходимо отметить, что мочевая кислота реагирует только как двухосновная кислота:
Полученный щелочной раствор урата натрия разливают на две пробирки. В первую пробирку по каплям добавляют разбавленную
соляную кислоту. Сначала выпадают кристаллы малорастворимой соли — кислого урата натрия, а при дальнейшем подкислении раствора — малорастворимой в воде мочевой кислоты:
Кристаллы мочевой кислоты имеют форму удлиненных призм.
Во вторую пробирку добавляют равный объем фелинговой жидкости. Смесь нагревают на газовой горелке. Выпадает красный осадок оксида меди (I). Таким образом, мочевая кислота легко окисляется даже слабыми окислителями:

