
- •Щелочность
- •8.1. Определение карбонатной и свободной щелочности
- •8.2. Потенциометрическое определение гидрокарбонатов
- •13. Жесткость
- •13.1. Определение общей жесткости воды комплексонометрическим методом
- •13.2. Определение массовой концентрации ионов кальция и магния комплексонометрическим методом. Расчет жесткости воды в градусах жесткости (ºЖ)
- •14. Кислород
- •14.1. Йодометрическое определение растворенного кислорода
- •17. Остаточный активный хлор
- •17.1. Определение суммарного остаточного хлора йодометрическим методом
- •17.2. Определение свободного остаточного хлора титрованием метиловым оранжевым
- •9. Хлориды
- •9.1. Аргентометрическое определение
17. Остаточный активный хлор
Под термином остаточный активный хлор понимают суммарное содержание в воде свободного хлора Cl2, хлорноватистой кислоты HClO, гипохлорит-ионов ClO– (относительные количества этих веществ определяются рН воды) и хлораминов NH2Cl, NHCl2.
17.1. Определение суммарного остаточного хлора йодометрическим методом
Принцип метода. При подкислении анализируемой воды буферным раствором с рН 4,5 и прибавления к ней йодистого калия все перечисленные вещества выделяют йод:
Cl2 + 2I– = I2 + 2Cl–;
HClO + 2I– + H+ = I2 + Cl– + H2O;
ClO– + 2I– + 2H+ = I2 + Cl– + H2O;
NH2Cl + 2I– + 2H+ = I2 + Cl– + NH4+;
NHCl2 + 2I– + 3H+ = I2 + 2Cl– + NH4+.
Выделившийся йод оттитровывают тиосульфатом натрия в присутствии крахмала. Содержание суммарного остаточного хлора выражают в мг/дм3 в пересчете на хлор.
Йодометрический метод предназначен для анализа воды с содержанием активного хлора более 0,3 мг/дм3 при объеме пробы 250 см3. Метод может быть рекомендован также для окрашенных и мутных вод, он позволяет определить суммарный остаточный хлор (свободный и связанный).
Мешающие вещества. При подкислении пробы воды буферным раствором с рН 4,5 такие окислители как озон, нитриты, соли железа (III), соли меди (II), хлораты и др. не выделяют йод из йодистого калия.
Приготовление растворов. 1. Приготовление раствора серноватистокислого натрия с с(Na2S2O3) = 0,1 моль/дм3. 25 г тиосульфата натрия Na2S2O3·5H2O растворяют в свежепрокипяченной и охлажденной дистиллированной воде, добавляют 0,2 г углекислого натрия и доводят объем до 1 дм3.
2. Приготовление раствора серноватистокислого натрия с с(Na2S2O3) = 0,01 моль/дм3. 100 см3 0,1 моль/дм3раствора тиосульфата натрия разбавляют свежепрокипяченной и охлажденной дистиллированной водой, добавляют 0,2 г углекислого натрия и доводят объем до 1 дм3. Раствор применяют при содержании активного хлора в пробе более 1 мг/дм3.
3. Приготовление раствора серноватистокислого натрия с с(Na2S2O3) = 0,005 моль/дм3. 50 см3 0,1 моль/дм3раствора тиосульфата натрия разбавляют свежепрокипяченной и охлажденной дистиллированной водой, добавляют 0,2 г углекислого натрия и доводят объем до 1 дм3. Раствор применяют при содержании активного хлора в пробе менее 1 мг/дм3.
4. Раствор дихромата калия с с(1/6K2Cr2O7) = 0,01 моль/дм3. 0,4904 г дихромата калия, взвешенного с точностью до ±0,0002 г, перекристаллизованного и высушенного при 180°С до постоянной массы, растворяют в дистиллированной воде и доводят объем до 1 дм3.
5. Раствор крахмала с массовой долей 0,005 (0,5 %). 0,5 г крахмала взбалтывают с 15 – 20 см3 дистиллированной воды. Суспензию постепенно приливают к 100 см3 кипящей дистиллированной воды и кипятят еще 2 – 3 минуты. После охлаждения консервируют добавлением 2 – 3 капель хлороформа или 0,1 г салициловой кислоты.
6. Приготовление буферного раствора с рН 4,5. 102 см3 раствора уксусной кислоты с с(СН3СООН) = 1,0 моль/дм3 (60 г ледяной уксусной кислоты в 1 дм3 воды) и 98 см3 раствора уксуснокислого натрия с с(СН3СООNа) = 1,0 моль/дм3 (136,1 г уксуснокислого натрия СН3СООNа·3Н2О в 1 дм3 воды) наливают в мерную колбу вместимостью 1 дм3 и доводят до метки дистиллированной водой (предварительно прокипяченной и охлажденной до 20°С, свободной от двуокиси углерода).
7. Установление точной концентрации 0,01 моль/дм3 раствора серноватистокислого натрия по раствору дихромата калия с с(1/6K2Cr2O7) = 0,01 моль/дм3. В коническую колбу с притертой пробкой помещают 0,5 г KI, проверенного на отсутствие йода, растворяют в 2 см3 дистиллированной воды, прибавляют 5 см3 H2SO4 (1:4), затем 10 см3 раствора дихромата калия, добавляют 80 см3 дистиллированной воды, закрывают колбу пробкой, перемешивают и ставят в темное место на 5 минут. Выделившийся йод титруют тиосульфатом натрия в присутствии 1 см3 раствора крахмала с массовой долей 0,005, прибавленного в конце титрования. Точную концентрацию серноватистокислого натрия (моль/дм3) вычисляют по формуле
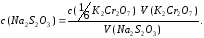
Ход определения. В коническую колбу насыпают 0,5 г KI, растворяют его в 1 – 2 см3 дистиллированной воды, затем добавляют буферный раствор в количестве, приблизительно равном полуторному значению щелочности анализируемой воды, после чего добавляют 250 – 500 см3 анализируемой воды. Выделившийся йод оттитровывают 0,005 моль/дм3 раствором тиосульфата натрия из микробюретки до появления светло-желтой окраски, после чего прибавляют 1 см3 раствора крахмала с массовой долей 0,005 и раствор титруют до исчезновения синей окраски. При определении щелочности воду предварительно дехлорируют с помощью тиосульфата натрия в отдельной пробе.
При концентрации активного хлора менее 0,3 мг, отбирают для титрования большие объемы воды.
Расчет. Содержание суммарного остаточного хлора Х, мг/дм3, вычисляют по формуле

где V – объем пробы воды, взятый для анализа, см3.
