
- •Щелочность
- •8.1. Определение карбонатной и свободной щелочности
- •8.2. Потенциометрическое определение гидрокарбонатов
- •13. Жесткость
- •13.1. Определение общей жесткости воды комплексонометрическим методом
- •13.2. Определение массовой концентрации ионов кальция и магния комплексонометрическим методом. Расчет жесткости воды в градусах жесткости (ºЖ)
- •14. Кислород
- •14.1. Йодометрическое определение растворенного кислорода
- •17. Остаточный активный хлор
- •17.1. Определение суммарного остаточного хлора йодометрическим методом
- •17.2. Определение свободного остаточного хлора титрованием метиловым оранжевым
- •9. Хлориды
- •9.1. Аргентометрическое определение
Щелочность
Щелочностью называется содержание в воде веществ, вступающих в реакцию с сильными кислотами. К этим веществам относятся:
– сильные основания;
– слабые основания: аммиак, анилин, пиридин и т.п.;
– анионы
слабых кислот:
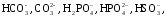
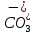
 ,
анионы гуминовых кислот.
,
анионы гуминовых кислот.
Различают три формы щелочности: свободную, карбонатную и общую.
Свободная щелочность обусловлена гидроксильными и карбонатными ионами. Ее определяют количеством кислоты, идущей на титрование воды до pH 8,3.
Карбонатная щелочность зависит от наличия в воде только ионов угольной кислоты, т.е. карбонатных и гидрокарбонатных ионов, и определяется количеством кислоты, идущей на титрование воды до pH ≈ 4.
Общая щелочность обусловлена присутствием в воде анионов слабых кислот органического и неорганического происхождения, а также гидроксильных ионов.
В пресных незагрязненных водах карбонатная щелочность настолько велика по сравнению со щелочностью, вносимой другими анионами, что ее можно принимать равной общей щелочности.
Основным источником карбонатных и гидрокарбонатных ионов в поверхностных водах являются процессы химического выветривания и растворения карбонатных пород типа известняков, доломитов. Например,
СаСО3
+ Н2О
+ СО2
↔ Са2+
+ 2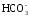 ;
;
МgCO3
+ Н2О
+ СО2
↔ Mg2+
+ 2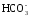 .
.
Некоторая часть гидрокарбонатных ионов появляется в результате метаморфизации продуктов химического выветривания изверженных пород:
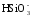 +
CO2
→
+
CO2
→
 +
SiO2;
+
SiO2;
OH–
+ CO2
→
 .
.
Значительные количества гидрокарбонатных ионов поступают с атмосферными осадками и грунтовыми водами.
Гидрокарбонатные и карбонатные ионы выносятся в водоемы со сточными водами предприятий химической, силикатной, содовой промышленности и т.д.
По мере накопления гидрокарбонатных и особенно карбонатных ионов последние, образуя малорастворимые соединения с ионами кальция, могут выпадать в осадок:
Са(НСО3)2 → СаСО3↓ + Н2О + СО2;
Са2+
+
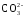 = СаСО3↓.
= СаСО3↓.
Этот процесс имеет очень важное значение в природе, поскольку от него зависит образование толщ карбонатных пород.
В поверхностных водах гидрокарбонатные и карбонатные ионы присутствуют главным образом в растворенном состоянии. Некоторая часть карбонатных ионов может находиться во взвешенном состоянии и близком к коллоидному состоянию в виде высокодисперсных частиц карбоната кальция.
В растворе между гидрокарбонатными и карбонатными ионами существует подвижное равновесие, определяемое константами диссоциации, характеризующими первую и вторую ступень диссоциации угольной кислоты
Н2СО3
↔
Н+
+
 ↔
Н+
+
↔
Н+
+
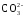 .
.
В речных водах содержание гидрокарбонатных ионов колеблется от 30 до 400 мг/дм3, в озерах – от 1 до 500 мг/дм3. Концентрация их в морских водах колеблется в более узких пределах от 100 до 200 мг/дм3, в атмосферных осадках она составляет 30 – 100 мг/дм3, в грунтовых водах − от 150 до 300 мг/дм3. В подземных водах их содержание заметно возрастает от 150 до 900 мг/дм3.
Щелочность является важной характеристикой поверхностных вод, по которой можно судить о важнейших гидрохимических и геохимических процессах, таких как формирование химического состава вод, эрозия земной поверхности, образование карбонатных пород и т.д.
В технике величина щелочности весьма существенна, поскольку от нее зависит коррозия бетона и выпадение карбонатной накипи в котлах, питающих различные паросиловые установки.
Для определения щелочности вод используют следующие методы: прямого титрования, обратного титрования и потенциометрические.
Методы прямого титрования основаны на титровании пробы воды сильной кислотой (НСl, H2SO4) в присутствии различных индикаторов, имеющих переход окраски в точке эквивалентности в области рН от 3 до 4. К ним относятся метиловый оранжевый, бромфеноловый синий, метиловый желтый. Недостатком этого наиболее простого и быстрого метода являются неопределенность значения рН в конечной точке титрования. Для определения свободной щелочности обычно используют фенолфталеин, имеющий интервал перехода рН и окраски индикатора 8,2 – 10,0.
Более
точны методы обратного титрования,
которые основаны на прибавлении к пробе
воды избытка сильной кислоты и его
титриметрическом определении в
присутствии индикатора. Эти методы
находят наибольшее распространение,
однако при анализе вод с низкой величиной
щелочности (менее 10 мг/дм3
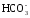 ),
а также окрашенных и мутных вод, возможны
значительные погрешности, составляющие
до 20 %.
),
а также окрашенных и мутных вод, возможны
значительные погрешности, составляющие
до 20 %.
В этих случаях предпочтительны различные варианты потенциометрических методов, в которых пробу исследуемой воды титруют сильной кислотой до определенного значения рН, определяемого с помощью рН-метра. На результаты не оказывают влияние следы активного хлора, мутность и окраска воды.
