
- •Исходные положения для расчета реакторов
- •Реакторы идеального вытеснения
- •Реакторы идеального смешения непрерывного действия
- •Реакторы для проведения реакций между газом и твердым веществом (г-т) или жидкостью и твердым веществом (ж-т)
- •Реакторы для проведения реакций в системе газ–жидкость (г-ж) и жидкость–жидкость (ж-ж)
- •63 Технология производства аммиака. Фиксация атмосферного азота. Синтез, транспортировка и хранение аммиака.
63 Технология производства аммиака. Фиксация атмосферного азота. Синтез, транспортировка и хранение аммиака.
Синтез соединений азота из свободного атмосферного азота был осуществлен в начале XX в. тремя методами: дуговым, цианамидным и аммиачным.
Дуговой метод заключается в том, что при высокой температуре азот соединяется с кислородом воздуха по уравнению реакции N2 + 02 = 2NО. Окись азота окисляется до двуокиси, которая поглощается водой с образованием НNO3. Способ был оставлен ввиду малого выхода окиси азота и громадной затраты электроэнергии на образование электрической дуги. Однако в настоящее время подобный метод высокотемпературного окисления азота кислородом воздуха возрождается на основе применения плазменных процессов.
Цианамидный метод заключается в том, что тонкоизмельченный карбид кальция при температуре около 1000° С взаимодействует с азотом по уравнениюСаС2+N2= СаСN2 +С настоящее время роль этого метода в промышленности связанного азота незначительна.
Аммиачный метод связывания атмосферного азота имеет экономические преимущества перед другими методами. Расход энергии на 1 т связанного азота по этому методу меньше, чем в дуговом и циан амидном методах.
Первый завод для синтеза аммиака был построен в Германии в 1913 г. Синтез аммиака протекает по уравнению
N2 + ЗН2=2NН3+Q
Для синтеза аммиака необходимо иметь азот и водород (азото-водородную смесь) в соотношении N2 : Н2 = 1 : 3. В производстве аммиака азот, необходимый для азотоводородной смеси, получают из воздуха двумя принципиально различными способами: 1) физическим разделением воздуха на азот и кислород и 2) совместно с получением водорода путем связывания всего кислорода воздуха в виде С02 и последующего отделения С02 от азотоводородной смеси. Источником водорода являются метан и его гомологи, водяной и полуводяной газы, коксовый газ, вода.
ПОЛУЧЕНИЕ АЗОТА И КИСЛОРОДА РАЗДЕЛЕНИЕМ ВОЗДУХА
Основные газы, входящие в состав воздуха (об. %): азот 78,03, кислород 20,95, аргон 0,94. В незначительном количестве в воздухе содержатся С02, Н2, Ne, Не, Кг, Хе. Отдельные газы, входящие в состав воздуха, широко применяются в ряде отраслей народного хозяйства. Разделение воздуха на составные части производится методом ректификации жидкого воздуха и основано на различии температур кипения отдельных газов, входящих в состав воздуха. Сложной частью этого процесса является превращение воздуха в жидкое состояние
ПРОИЗВОДСТВО ВОДОРОДА И АЗОТОВОДОРОДНОЙ СМЕСИ ДЛЯ СИНТЕЗА АММИАКА
Водород, необходимый для синтеза аммиака, в промышленности получают одним из следующих способов; 1) конверсией метана природного газа или его гомологов с последующей конверсией СО; 2) конверсией окиси углерода водяного или полуводяного газа, полученного газификацией твердого или жидкого топлива; 3) разделением коксового газа путем последовательного сжижения всех компонентов газовой смеси, кроме водорода; 4) электролизом воды или раствора хлорида натрия.
До недавнего времени большую часть водорода для синтеза аммиака получали из кокса газификацией с последующей конверсией СО. В настоящее время твердое топливо практически полностью заменено газовым сырьем: природным газом, попутными газами нефтедобычи, газами нефтепереработки и остаточными газами получения ацетилена из природного газа.
СИНТЕЗ АММИАКА. Теоретические основы синтеза аммиака. Синтез аммиака идет без образования побочных продуктов по уравнению N2+3H2=2NH3+Q
Тепловой эффект реакции синтеза аммиака зависит от температуры и давления
Как, для смещения равновесия в сторону образования аммиака необходимы высокие давления и низкие температуры. Синтез аммиака без применения катализатора даже при высокой температуре протекает медленно. В производственных условиях для получения требуемой скорости реакции синтез аммиака ведут при температурах не ниже 400—500°С и при участии твердых катализаторов. В качестве катализаторов для этой реакции были испытаны многие элементы и их многочисленные соединения. Для синтеза аммиака катализаторами могут быть железо, платина, осмий, марганец, вольфрам, уран, родий и другие металлы, имеющие в атоме второй снаружи незаполненный электронной слой. Наиболее высокую активность проявляют железо, осмий, рений и уран. В промышленности получил распространение железный катализатор, содержащий три промотора: А1203, К20, СаО. Он показал большую активность и стойкость к перегревам и вредным примесям в азотоводородной смеси. Сероводород и другие содержащие серу соединения отравляют железный катализатор необратимо. Так, при содержании в катализаторе 0,1% серы его активность уменьшается на 50%, а для почти полного его отравления Достаточно около 1% серы. Кислород и кислородные соединения (H2О, СО, С02) отравляют железный катализатор очень сильно обратимо.
Синтез аммиака —это типичный гетерогенно-каталитический процесс, протекающий через ряд стадий:
Диффузия азота и водорода из газового объема к поверхности зерен катализатора и внутри пор зерна.
Активированная (химическая) адсорбция газов на катализаторе.
Взаимодействие азота с водородом на поверхности катализатора. При этом азот принимает электроны от катализатора, а водород отдает электроны катализатору, пополняя их убыль.
Десорбция аммиака и диффузия его в объем газовой фазы. Определяющей стадией процесса является активированная адсорбция азота. Выход аммиака зависит от многих параметров технологического режима: температуры, давления, времени соприкосновения газа с катализатором (или обратной величины, называемой объемной скоростью газа), состава газовой смеси, активности катализатора, конструкции аппарата.
с,
Промышленные способы синтеза аммиака. В. производстве синтетического аммиака применяется давление от 1-107 до 1-108 Н/м2. В зависимости от применяемого давления различают системы низкого давления, среднего давления и высокого давления. Наиболее распространены системы, работающие при среднем давлении, так как при этих условиях удачно решаются вопросы выделения аммиака при достаточной скорости процесса в контактном аппарате. Азотоводородная смесь при прохождении через слой катализатора неполностью превращается в аммиак. В газе на выходе из контактного аппарата содержание аммиака составляет 14—20%. Газовая смесь, выходящая из контактного аппарата, охлаждается, аммиак конденсируется и отделяется от газа, а непро-реагировавшая азотоводородная смесь при помощи циркуляционного компрессора возвращается вновь в контактный аппарат. Свежая азотоводородная смесь в количестве, отвечающем количеству образовавшегося в контактном аппарате аммиака, добавляется к оборотной смеси.
Производство азотной кислоты хранение и транспортировка.
Азотная кислота является одной из важнейших минеральных кислот и по объему производства занимает второе место после серной кислоты. Она образует растворимые в воде соли (нитраты), обладает нитрующим и окисляющим действием по отношению к органическим соединениям в концентрированном виде, пассивирует черные металлы. Все это обусловило широкое использование азотной кислоты в народном хозяйстве и оборонной технике. Безводная азотная кислота (моногидрат НNО3) представляет бесцветную жидкость с температурой кристаллизации – 41-60С, температурой кипения – 82-60С и плотностью – 1.513 г/м3. Смешивается с водой во всех отношениях, образуя при этом индивидуальные соединения гидраты состава НNО3*Н2О и НNО3*3Н2О, которые дают три эвтектики.
Температура кипения водных растворов азотной кислоты зависит от их концентрации. С увеличением концентрации температура кипения возрастает. Безводная азотная кислота малоустойчива термически и разлагается уже при хранении 4НNО3↔4NО2 +2Н2О +О2 +ΔH Скорость разложения возрастает с повышением концентрации, для 99% кислоты температурный градиент составляет всего 50С. При нагревании процесс ускоряется и протекает по уравнению 2НNО3 ↔ N2О3 +Н2О +О2 +ΔН Выделяющийся оксид азота (4) растворяется в кислоте и окрашивает ее желто-оранжевый цвет. Для удаления оксида азота из кислоты в технологическом процессе ее производства предусмотрена операция «отбелки» кислоты. При растворении оксида азота (4) в кислоте образуется соединение состава НNО3*NО2 (нитроолеум), являющийся промежуточным продуктом в прямом синтезе азотной кислоты. Азотная кислота корродирует и растворяет все металлы кроме золота, платины, титана, тантала, родия, ирридия, однако в концентрированном виде пассивирует железо и его сплавы. Области применения азотной кислоты весьма разнообразны. Большая ее часть расходуется на производство азотных и комплексных минеральных удобрений и разнообразных нитратов, на производство взрывчатых веществ и ракетного топлив,. производство красителей, органическом синтезе и цветной металлургии. В н.в. в промышленных масштабах азотная кислота производится исключительно из аммиака. Поэтому структура сырья азотнокислотного производства совпадает со структурой сырья для производства аммиака.

Существует два способа производства азотной кислоты: – получение разбавленной кислоты последующим концентрированием ее в случае необходимости; – непосредственное получение концентрированной азотной кислоты. Наиболее распространен первый способ, что связано с использованием в народном хозяйстве как концентрированной, так и разбавленной кислоты. Методы различаются физико-химическими закономерностями протекающих процессов и технологическими схемами. Однако независимо от схемы, синтез азотной кислоты из аммиака описывается общей химической схемой: NН3 NО NО2 (N2О4) НNО3 [Окисление ] [ доокисление абсорбция ] Конверсия аммиака переработка нитрозных газов Первая стадия процесса одинакова как для получения разбавленной, так и для получения концентрированной кислоты. Вторая стадия отличается рядом особенностей. Решающее значение при выборе параметров той или иной технологической схемы имеет выбор оптимального давления на каждой из стадий производства, позволяет использовать более совершенные массообменные устройства и, в конечном итоге, позволяет снизить капитальные затраты. В то же время повышение давления оказывает и негативное воздействие на экономические показатели работы агрегата: ускоряются побочные реакции на стадии окисления аммиака, снижается степень конверсии.

Механизм гетерогенного каталитического окисления аммиака состоит из следующих последовательных стадий:
– диффузия молекул аммиака и кислорода из газовой фазы к поверхности катализатора;
– активированная адсорбция молекул кислорода на поверхности катализатора с образованием промежуточного соединения
– хемосорбция молекул аммиака и образование комплекса;
– разложение комплекса с регенерацией катализатора и образованием молекул оксида азота(2) и воды;
– диффузия продуктов реакции с поверхности катализатора в газовую фазу.

1-очистка аммиака и воздуха и их смешение; 2- окисление аммиака на катализаторе; 3, 4 – охлаждение нитрозных газов с использованием теплоты процесса окисления; 5- окисление оксида азота (2) и образование азотной кислоты; 6- очистка (нейтрализация) отходящих газов; АмВС - аммиачно-воздушная смесь; НГ – нитрозные газы; ОГ – отходящие газы.
Поскольку определяющим параметром является давление, все существующие технологические схемы производства разбавленной азотной кислоты делятся на три типа: -при атмосферном давлении (тип 1);
-при высоком давлении (тип 2);
-с двумя ступенями давления (комбинированные схемы)
Технологическая схема производства разбавленной азотной кислоты под высоким давлением имеет следующие основные показатели:
– давление на стадии окисления аммиака 0.73МПа;
– давление на стадии абсорбции оксида азота(4) 0.65МПа;
– катализатор – платиновые сетки;
– концентрация азотной кислоты- 0.55 –0.58 мас.дол.;
– число агрегатов –3
В схеме предусматриваются:
– каталитическая очистка отходящих газов от оксида азота (4), позволяющая снизить его концентрацию с 0.3 до 0.002% об.;
– отбелка получаемой азотной кислоты, снижающая содержание в ней оксида азота (4) с 1.0 до 0.2% об.;
– утилизация теплоты и потенциальной энергии сжатых газов и, как следствие, энергетическая автономность установки.
Производство минеральных удобрений и ядохимикатов. Классификация удобрений. Комплексные удобрения.
Минеральные удобрения классифицируют по трем главным признакам: агрохимическому назначению, составу и свойствам. По агрохимическому назначению удобрения делят на прямые , являющиеся источником питательных элементов для растений, и косвенные , служащие для мобилизации питательных веществ почвы путем улучшения ее физических, химических и биологических свойств. К косвенным удобрениям принадлежат, например, известковые удобрения, применяемые для нейтрализации кислых почв, структурообразующие удобрения, способствующие агрегированию почвенных частиц тяжелых и суглинистых почв и др.
Прямые минеральные удобрения могут содержать один или несколько разных питательных элементов. По количеству питательных элементов удобрения подразделяют на простые (односторонние, одинарные) и комплексные.В простые удобрения входит только один из трех главных питательных элементов: азот, фосфор или калий. Соответственно простые удобрения делят на азотные, фосфорные и калийные.
Комплексные удобрения содержат два или три главных питательных элемента. По числу главных питательных элементов комплексные удобрения называют двойными (например, типа NP или РК) и тройными (NPK); последние называют также полными. Удобрения, содержащие значительные количества питательных элементов и мало балластных веществ, называют к о н ц е н т р и р о в а н н ы м и. Комплексные удобрения, кроме того, разделяют на смешанные и сложные. Смешанными называют механические смеси удобрений, состоящие из разнородных частиц, получаемые простым тукосмешением. Если же удобрение, содержащее несколько питательных элементов, получается в результате химической реакции в заводской аппаратуре, оно
называется сложным.
Удобрения, предназначенные для питания растений элементами, стимулирующими рост растений и требующимися в весьма малых количествах, называются м и к р о у д о б р е н и я м и , а содержащиеся в них питательные элементы — м и к р о э л е м е н т а м и . Такие удобрения вносят в почву в очень небольших количествах. К ним относятся соли, содержащие бор, марганец, медь, цинк и другие элементы По агрегатному состоянию удобрения подразделяют на тверд ы е и ж и д к и е

(например, аммиак, водные растворы и суспензии). Классификация МУ по природе питательного элемента, их числу, содержанию.
Большое значение имеют физические свойства удобрений. Водорастворимые удобрительные соли должны быть сыпучими, легко рассеиваться, не быть сильно гигроскопичными, не слеживаться при хранении; должны обладать такими свойствами, чтобы сохраняться на почве в течение некоторого времени, не слишком быстро вымываться дождевой водой и не сдуваться ветром. Этим требованиям в наибольшей мере отвечают крупнокристаллические и г р а н у л и р о в а н н ы е удобрения, производство и применение которых непрерывно возрастают. Гранулированные удобрения можно вносить на поля механизированными методами с помощью туковых машин и сеялок в количествах, строго соответствующих агрохимическим требованиям. Эффективным средством для уменьшения слеживания является обработка поверхности гранул поверхностно-активными веществами. В последние годы стали распространенными способы создания вокруг гранул различных оболочек, которые, с одной стороны, предохраняют удобрение от слеживания, а с другой — позволяют регулировать во времени процесс растворения питательных веществ в почвенных водах, т. е. создавать д о л г о в р е м е н н о д е й с т в у ю щ и е у д о б р е н и я
Технология производство кальционированной соды.
Получение едкого натра, хлора и соляной кислоты.
Органический синтез на основе окиси углерода.
Органический синтез на основе окиси углерода широко применяется в промышленности. Из окиси углерода получают алифатические углеводороды, спирты, альдегиды, карбоновые кислоты и их производные и др.
Метиловый спирт (метанол) СНзОН — токсичная жидкость плотностью 796 кг/м3, которая смешивается с водой в любых отношениях, температура кипения 64,7 °С, температура плавления — 95 °С.
До 1934 г. в СССР метанол получали сухой перегонкой древесины (древесный спирт). В настоящее время основным методом получения метанола является синтез его из окиси углерода и водорода, протекающий в присутствии катализатора при температуре 230—420°С и давлении 20—32 МПа
СО + 2Н3↔СН3ОН +
На практике применяют цинкхромовый катализатор, который получают совместным осаждением окислов цинка и хрома на носителе при соотношении ZnO : Сг203 = 2 : 1 и выпускают в виде таблеток.
Образование метанола идет с выделением тепла и уменьшением объема, поэтому для увеличения выхода метанола процесс следует вести при высоком давлении и низкой температуре. Кроме того, на равновесный выход метанола сильно влияет состав газа, т. е. соотношение Н2: СО.
При повышении температуры равновесная концентрация метанола снижается и для ее увеличения необходимо повысить давление. Однако с ростом отношения Н2:СО и с повышением давления резко снижается равновесная концентрация СН3ОН, поэтому для достижения максимально возможного выхода метанола поддерживают оптимальные условия процесса.
Чаще всего процесс получения метанола ведут при давлении от 20 до 35 МПа, температуре 370—420 °С и объемной скорости 10000—35000 ч-1. Выход метанола в этих условиях составляет 10—20% при времени контакта газа с катализатором 10—40 с.
Смесь Н2 и СО в соотношении 4: 1 (применяют и другие соотношения) сжимается в компрессоре до 25 МПа, смешивается в смесителе с непрореагировавшим циркуляционным газом, нагнетаемым компрессором, и поступает в фильтр, где очищается от масла; затем в теплообменнике смесь нагревается до 200 °С и направляется в колонну синтеза метанола. По выходе из нее смесь поступает в межтрубное пространство теплообменника охлаждается, нагревая газовую смесь, поступающую на синтез. Такая организация процесса позволяет вести процесс автотермично.
Из теплолообменника газовая смесь, содержащая пары метанола, поступает в водяной холодильник, а затем в сепаратор, где жидкий метанол отделяется от непрореагировавшего газа; последний возвращается циркуляционным компрессором в смеситель. Метиловый спирт-сырец из сепаратора сливается в сборник и направляется на ректификацию для очистки от различных органических веществ.
На 1 т метанола расходуется около 700 м3 окиси углерода и 1400—2000 м3 водорода.
Чистый метанол используется для получения формальдегида (около 50%), метилгалогенидов, метиловых эфиров, диметилтерефталата, метилметакрилата и других продуктов, а также в качестве жидкого топлива, растворителя и экстрагента (около 10%).
Формальдегид — альдегид муравьиной кислоты — бесцветный газ с резким раздражающим запахом, имеет температуру конденсации— 19°С при атмосферном давлении. Он хорошо растворим б воде, 33—40%-ный водный раствор формальдегида называется формалином. Водный раствор формальдегида при хранении может полимеризоваться, во избежание этого в его состав вводят в качестве стабилизатора 7—12% (масс.) метилового спирта.
Формальдегид широко используется для получения фенолокарбамидо и меламино-формальдегидных смол, полиформальдегида, уротропина, изопрена; он образуется в качестве промежуточного продукта в промышленности органического синтеза при получении бутандиола-1,4, пирролидонов, аллилового, и пропилового спиртов.
Наиболее распространенным способом получения формальдегида является окислительное дегидрирование метанола в течение 0,01—0,03 с в присутствии катализатора при 500—600 °С
СНзОН + 0,502 → НСНО + Н20
Наряду с основной реакцией протекают побочные процессы окисления, дегидрирования и гидрирования до образования окиси и двуокиси углерода и других продуктов.
В качестве катализатора применяются медь и серебро в виде сеток либо осажденные на пористом носителе, например, на пемзе.
Метанол, содержащий 10—12% воды, из сборника непрерывно поступает в испаритель-подогреватель. Сюда же воздуходувкой подают очищенный в фильтре воздух, который барботирует через слой метанола и насыщается его парами. Для нормальной работы в испарительной системе поддерживается постоянные уровень жидкости и температура (48—50 °С). Образовавшаяся паро - воздушная смесь нагревается до 110 °С в верхней части аппарат и поступает в контактный аппарат с катализатором. Проходя через катализатор, метиловый спирт окисляется с образованием формальдегида, выход формальдегида 80—85% при степени конверсии метанола 85%.
Выходящие из контактного аппарата газы содержат 20—22% НСНО, 36—38% N2, СН3ОН, Н2, СО, С02, СН4 и др. В холодильниках они охлаждаются и поступают в поглотительную башню, орошаемую водой и снабженную трубчатым холодильником. Из поглотительной башни б выводится водный 33—40%- ный раствор формальдегида, содержащий 10—12% СН3ОН; газы, состоящие в основном из азота и водорода, выбрасываются в атмосферу.
Формальдегид получают также частичным окислением метана. Этот процесс проводят в присутствии катализатора (смесь фосфата алюминия и окиси меди) при температуре 460 °С. При окислении метана образуются помимо формальдегида и другие продукты реакции, например, НСООН, С02, СО, Н2, поэтому нз реакционной смеси формальдегид выделяют конденсацией или поглощением водой с последующим его выделением.
Из окиси углерода и водорода под давлением 2—15 МПа и при температуре 160—450 °С получают также углеводроды парафинового ряда. В зависимости от условий процесса (температуры, давления), состава смеси, катализатора, образуются твердые, жидкие и газообразные углеводороды:
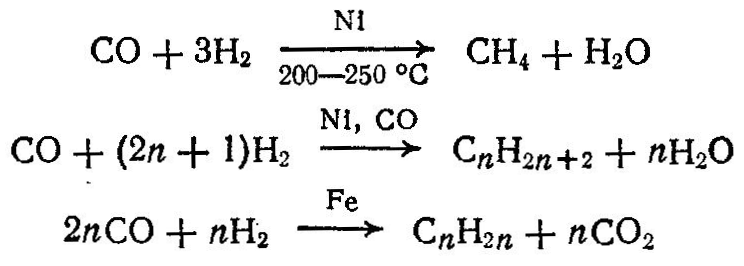
Органический синтез на основе предельных углеводородов.
Сырьем для синтеза многих органических продуктов служат предельные углеводороды. Широкое применение из методов переработки предельных углеводородов находит окисление, хлорирование, сульфирование, сульфохлорирование и др.
В зависимости от условий процесса при окислении углеводородов получают спирты, альдегиды, кислоты, СО, Н2 и др. Окислением низших парафинов в газовой фазе получают формальдегид, метиловый спирт, ацетальдегид:

При окислении парафиновых углеводородов С15—-С30 кислородом воздуха получают жирные кислоты, высшие спирты, моющие и поверхностно-активные вещества:

Окислением нафтеновых углеводородов, например циклогексана, получают циклогексанол C6H12О, циклогексанон С6Н10О, адипиновую кислоту НООС—(СН2)4—СООН. Хлорированием предельных углеводородов получают различные хлорзамещенные продукты, используемые далее для производства высокомолекулярных соединений (хлористый винил, хлоропрен, тетрафторэтилен и др.), полупродуктов органического синтеза (хлористые метил, этил, аллил и бензил, хлорбензол и др.), а также применяемые в качестве растворителей (хлористый метилен, ССЦ и др.), хладоагентов (хлороформ, хлористый этил и др.), для борьбы с вредителями сельского хозяйства, в качестве смазочных масел и т. д.
Хлорированию подвергают жидкие (парафиновые, нафтеновые и ароматические) и газообразные (метан, этан, пропан и др.) углеводороды. Для получения хлорированных углеводородов применяют термическое, фотохимическое, каталитическое хлорирование и хлорирование, инициируемое радикалами.
Термическое хлорирование проводят при нагревании смеси углеводородов и хлора до температуры диссоциации хлора на атомы (250°С). Чем устойчивее углеводород, тем должна быть выше температура хлорирования, так, например, для хлорирования бутана требуется нагревание до 250 °С, а метана — до 400 °С.
При фотохимическом хлорировании молекулы хлора диссоциируют под влияием фотонов или кванта энергии, например:
![]()
Каталитическое хлорирование ведут в присутствии хлоридов металлов переменной валентности (Cu2Cl2, FeCl3, SbCl5).
При жидкофазном хлорировании атомы хлора образуются при действии на молекулу С12 продуктов разложения перекиси или азосоединений, вводимых в жидкие углеводороды, например:

При хлорировании метана образуются хлорсодержащие углеводороды; при этом протекают следующие реакции:

Процесс осуществляют при 400—480 °С в цилиндрических реакторах, футерованных диабазовыми плитками. При хлорировании образуется смесь, содержащая хлористый метил СН3С1, хлористый метилен СН2С12 хлороформ СНС13 и четыреххлористый углерод СС14. Выход этих продуктов [в %(мол.)] зависит от мольного соотношения С12: СН4.
Выход товарных продуктов составляет 85—99% от израсходованного метана. При тщательном разделении можно получить продукты 99—99,5%-ной чистоты.
Хлорирование этана и пропана проводят при 300—400°С и в избытке углеводорода. При хлорировании этана в основном образуются хлористый этил и небольшое количество дихлорэтана:

При хлорировании пропана образуются монохлориды (2-хлорпропан и 1-хлорпропан) и полихлориды.
Органический синтез на основе непредельных углеводородов.
Олефины — непредельные углеводороды СnН2n, легко взаимодействующие с хлором, кислородом и водородом, склонны к гидратации и полимеризации.
При хлорировании этилена получают дихлорэтан
![]()
который широко используется как растворитель жиров, каучуков, для получения хлористого винила и др. Хлористый винил образуется по реакции:
![]()
При хлорировании пропилена получают хлористый аллил и хлориды.
Окислением непредельных углеводородов получают окиси углеводородов. Наибольшее применение в органическом синтезе находит окись этилена, которую получают окислением этилена в присутствии серебряных катализаторов:

Окись этилена служит сырьем для получения этиленгликоля, этаноламина, эпихлоргидрина, диоксана, ацетальдегида и др.
Олефины способны подвергаться гидратации. На этом свойстве основаны процессы получения спиртов (например, этилового спирта С2Н5ОН из этилена), Этиловый спирт—(этанол) кипит при 78,3°С; смесь С2Н5ОН [30% (об.)] с воздухом взрывоопасна; с водой спирт образует азеотропную смесь, содержащую 95,6% С2Н5ОН; кипящую при 78,1 °С. Этиловый спирт широко применяется в пищевой и медицинской промышленности, является компонентом жидкостного ракетного топлива, антифризом и т. д. Особенно широко этанол используется как полупродукт органического синтеза, и, в частности, для получения сложных эфиров, хлороформа, хлораля, ацетальдегида, уксусной кислоты, бутадиена и других продуктов. По объему производства синтетический этиловый спирт занимает первое место среди других органических соединений.
Ранее этиловый спирт получали из пищевого сырья — картофельного крахмала и некоторых зерновых культур, однако этот способ связан с большими затратами пищевого сырья. Кроме того, его получают гидролизом древесины (гидролизный спирт). В настоящее время этанол получают сернокислотной и прямой гидратацией этилена.
При сернокислотном способе получения этанола этилен под давлением 1,5—2,5 МПа поступает в абсорбер барботажного типа, орошаемый 97%-ной серной кислотой. Температура в абсорбере 65—75°С. Серная кислота в этом процессе является катализатором и реагентом.
Этилен взаимодействует с серной кислотой с образованием моноэтилсульфата C2H50S03H и диэтилсульфата (C2H50)2S02

Газы, не поглощенные в абсорбере, проходят водяной и щелочной скрубберы и далее могут быть использованы как топливо.
Этилсульфаты и серная кислота из абсорбера поступают в гидролизер, в который подается вода. В гидролизере при давлении 1 МПа и температуре 70—90 °С происходит гидролиз этил- сульфатов
![]()
Пары спирта и воды далее проходят холодильник, где они конденсируются; конденсат поступает в ректификационную колонну 5 для разгонки и очистки от примесей. Разбавленная кислота (50%) выводится из гидролизера, направляется на концентрирование и снова возвращается в процесс.
При ректификации концентрация этилового спирта достигает 95—96%. По этому способу из 1 т этилена получают 1,2 т этанола и около 100 кг этилового эфира.
Синтез этанола прямой гидратацией этилена, как правило, проводят в паровой фазе в присутствии катализатора — ортофосфорной кислоты (35—40% Н3РО4), которой пропитывают алюмосиликаты, силикагель.
Реакция взаимодействия этилена с водой обратима и протекает с выделением тепла:
![]()
следовательно, процесс желательно проводить при невысоких температурах. Однако степень превращения этилена в этанол лимитируется скоростью реакции и активностью катализатора. На практике процесс ведут при температуре 280—290 °С.
Повышение давления сдвигает равновесие в сторону образования этанола, поэтому в системе поддерживают давление около 7—8 МПа. Выход этанола зависит также от мольного соотношения Н20: С2Н4, времени контакта и объемной скорости.
Прямую гидратацию этилена проводят по циклической схеме. Этилен, сжатый компрессором до 7—8 МПа, смешивается с циркуляционным газом и паром высокого давления, после чего проходит теплообменник и трубчатую печь, где смесь нагревается до 280 °С и направляется в контактный аппарат. При прохождении смеси через катализатор образуются пары спирта. Выходящая из контактного аппарата парогазовая смесь охлаждается в теплообменнике. Сконденсировавшиеся пары воды и спирта отделяются от газа в сборнике, откуда спирт-сырец (15—16% С2Н5ОН) поступает на очистку.
Непрореагировавший этилен проходит водяной холодильник и колонну с насадкой, орошаемую водой для полного извлечения спирта, и поступает на смешение с новой порцией этилена.
Метод прямой гидратации этилена по затратам и простоте обслуживания более выгоден, чем сернокислотный.
Получение синтетического спирта из этилена позволяет существенно сократить расходы пищевого сырья. Так, 1 т этилена, переработанная на этанол позволяет сэкономить 4 т зерна.
Органический синтез на основе ацетилена.
Ацетилен СН ≡ СН — газообразное вещество, температура сжижения —83,5°С. С кислородом и воздухом образует взрывоопасные смеси с очень широким пределом взрываемости, так например, смесь ацетилена с кислородом взрывоопасна в пределах от 2,8 до 78% (об.) С2Н2. Для снижения взрывоопасности смеси в нее вводят инертные газы (Н2, N2).
Ацетилен растворим в воде (в одном объеме Н20 растворяется 1 объем С2Н2), в растворах солей и особенно хорошо в органических веществах, например, в одном объеме ацетона растворяется 23 объема ацетилена.
Химическая активность ацетилена обусловлена наличием в молекуле С2Н2 реакционноспособной тройной связи. В связи с этим ацетилен широко используется в синтезе разнообразных химических соединений - исходных продуктов для получения химических волокон, синтетических каучуков, пластических масс и т. д. Так, из ацетилена получают ацетальдегид, этиловый спирт, бутадиен, этилацетат, хлористый винил, хлоропрен и др. Кроме того, ацетилен нашел применение для получения высоких температур при сварке и резке металлов.
Ацетилен получают из карбида кальция и термическим расщеплением углеводородов. По первому способу сплавлением окиси кальция и углерода в электродуговых печах получают карбид кальция:
![]()
который затем разлагают водой с образованием ацетилена:
![]()
Из 1 кг чистого карбида кальция теоретически образуется 380 л С2Н2, однако, поскольку в техническом карбиде кальция содержатся примеси, выход ацетилена снижается до 230—250 л.
По второму способу ацетилен получают расщеплением углеводородов при высоких температурах

При высокотемпературном расщеплении углеводородов выделяющиеся газы содержат 7—14% (об.) С2Н2, последний извлекают из газов селективными растворителями (вода под давлением, жидкий аммиак, метиловый спирт и др.).
В качестве примера использования ацетилена в органическом синтезе рассмотрим синтез ацетальдегида СН3СНО.
Ацетальдегид (альдегид уксусной кислоты) — бесцветная, легко испаряющаяся жидкость, температура кипения которого 21 °С. Ацетальдегид отличается резким запахом, хорошо смешивается с водой и спиртом; с воздухом образует взрывоопасные смеси (4—57% (об.) СН8СНО).
По масштабам производства ацетальдегид занимает одно из первых мест среди альдегидов, он является промежуточным продуктом органического синтеза. Из него получают уксусную и молочную кислоты, эфиры акриловой кислоты, уксусный ангидрид, кротоновый альдегид, н-бутиловый спирт и др.
По одной из схем очищенный от примесей ацетилен смешивают с циркуляционным газом и непрерывно подают в гидратор , где он нагревается до 80—100°С. Барботируя через катализатор — жидкость, содержащую сульфаты железа и ртути (в 1 л Н20 200 г H2S04, 0,4 г Hg, 40 г окислов железа), ацетилен на 50—60% превращается в ацетальдегид
![]()
Газы, содержащие ацетальдегид, ацетилен и примеси, охлаждаются сначала в холодильнике (здесь частично конденсируются пары воды и конденсат возвращается в гидрататор), а затем в холодильнике, где пары ацетальдегида и воды конденсируются, собираются в сборнике и далее направляются на ректификацию.
Несконденсированные газы, содержащие ацетилен, поступают в колонну, орошаемую водой. Здесь извлекаются остатки ацетальдегида, а непрореагировавший ацетилен вновь возвращается в процесс. Для очистки оборотного газа от окислов углерода и азота часть его (10%) непрерывно отбирается из цикла и направляется на очистку. Выход ацетальдегида составляет около 96%.
Ртуть и ее соединения, входящие в состав, катализатора, ядовиты, поэтому в настоящее время разрабатываются нертутные катализаторы в виде окислов Zn, Mg, Ni, СО, С.
Ацетальдегид широко применяется для получения уксусной кислоты СНзСООН.
Уксусная кислота (безводная) плавится при 16,6°С и кипит при 118 °С. Она растворима во многих органических веществах и смешивается с водой в любых соотношениях. Уксусная кислота находит широкое применение в текстильной и пищевой промышленности, а также является промежуточным продуктом при получении монохлоруксусной кислоты, сложных эфиров, винилацетата и т. д.
Уксусную кислоту вначале получали только сухой перегонкой древесины либо в процессе биологического окисления этилового спирта. В настоящее время ее получают окислением ацетальдегида, жидкофазным окислением углеводородов С3 —С7 и синтезом из метанола и окиси углерода.
Окисление ацетальдегида кислородом воздуха с целью получения уксусной кислоты происходит в присутствии солей марганца (ацетат марганца) при 60—80°С. Образующаяся в качестве промежуточного продукта надуксусная кислота взрывоопасна, поэтому парогазовую смесь разбавляют азотом. Образование СНзСООН идет по следующей схеме:

Синтетическую кислоту очищают от примесей перегонкой. Техническая кислота после перегонки содержит 97—99% СН3СООН, 0,1—0,5% НСООН, 0,5—2% Н20.
Свойства, классификация и методы получения высокомолекулярных соединений и полимерных материалов.
Технологии производства многотоннажных продуктов: поливинилхлорид, полиэтилен, полипропилен, полиэтилентерефталат, полиакрилонитрил, политетрафторэтилен, поликапроамид, полиуретан. Основные свойства и применение. Примеры.
Природные высокомолекулярные соединения: целлюлоза, крахмал, белки. Производство целлюлозы и ее применение.
Эфиры целлюлозы и пластические массы на их основе.
Производство пластических масс на основе полимеров, получаемых цепной полимеризацией.
К этой группе пластмасс относятся полиэтилен, полипропилен, полиизобутилен, полистирол, полимеры и сополимеры хлористого винила, фторпроизводных этилена, полиакрилаты и др. Такие пластмассы выпускаются без наполнителя; они термопластичны, обладают хорошими диэлектрическими свойствами, высокой ударной вязкостью (за исключением полистирола), устойчивы к действию многих агрессивных сред, но большинство из них имеет низкую теплостойкость.
Полиэтилен [—СН2 — СН2—]n насыщенный углеводород парафинового ряда с молекулярной массой (в зависимости от метода получения) от 18000 до 800000. Это роговидный продукт, выпускаемый в виде гранул.
Сырьем для производства полиэтилена служит этилен, получаемый высокотемпературным пиролизом нефтяных фракций или высокотемпературным крекингом пропана и бутана при 800 °С в трубчатых печах. Для полимеризации применяют этилен высокой степени чистоты (99,99% С2Н4), так как присутствие примесей может, привести к обрыву полимерной цепи и снижению массы моля полимера. Особенно опасны примеси в сырье, поступающем на полимеризацию по радикальному механизму.
Для получения чистого этилена газовую смесь пропускают через систему охлаждения, работающую при температуре от —110 до —130 °С и давлении от 0,5 до 5 МПа. При этом все примеси (за исключением ацетилена и олефинов) извлекаются из этилена. Ацетилен и олефины удаляются гидрированием в присутствии кобальтмолибденового катализатора при температуре 250 °С и давлении 1,5 МПа.
В настоящее время полиэтилен получают тремя способами:
полимеризацией этилена при низком давлении (0,5—0,8 МПа) и температуре 70—80 °С в присутствии комплексных катализаторов, состоящих из четыреххлористого титана TiCl и триэтилалюминияА1(С2H5)3;
полимеризацией этилена в растворителе при 130—170 °С и среднем давлении 3,5—4,0 МПа в присутствии окислов металлов переменной валентности (окислов хрома, ванадия и др.);
полимеризацией этилена при высоком давлении (130—250 МПа) и температуре 200—270 °С в присутствии кислорода (0,005— 0,008% в смеси).
В зависимости от методов получения полиэтилена свойства его различны.
Полиэтилен высокого давления получают в присутствии кислорода. Процесс полимеризации протекает по радикальному механизму. Свежий этилен высокой степени чистоты из газгольдера под давлением 0,8—1,1 МПа поступает в смеситель (на схеме не показан) для смешения с кислородом (от 0,005 до 0,008%) и возвратным этиленом, после чего подается в систему компрессоров, где сжимается сначала до 25 МПа, а затем (после очистки от масла) до 15 МПа. Причем, чем выше давление, тем выше скорость полимеризации.
Пройдя систему очистки и смазкоотделитель , этилен поступает в реактор трубчатого типа на полимеризацию. Реактор является аппаратом идеального вытеснения. Он состоит из наклонно расположенных труб диаметром до 25 мм и общей длиной до 300 м и имеет три зоны: зону подогревания этилена до 200 °С; зону полимеризации, где температура поддерживается в пределах 200— 225 °С, и зону охлаждения реакционной массы (110—125 °С). На гревание этилена и охлаждение реакционной массы осуществляется водой. Из реактора образующийся полиэтилен вместе с этиленом, не вступившим в реакцию, через систему редукторов проходит сепаратор и поступает в приемник, где после снижения давления происходит разделение этилена и полиэтилена. Этилен, пройдя ловушку и после промывки, снова возвращается на полимеризацию. Из приемника расплавленный полиэтилен направляется на стабилизацию, окрашивание (если необходимо) и грануляцию. В качестве стабилизатора применяется смесь, состоящая из фенил-наф- тиламина и дифенил-фениленди- амина и др.
Гранулирование осуществляют несколькими методами и, в частности, продавливанием смеси полиэтилена и стабилизатора через фильеру гранулятора. Выходящие жгуты разрезаются вращающимся ножом на гранулы размером 2—3,5 мм. Готовый полиэтилен упаковывают в мешки и поставляют потребителю.
Степень конверсии этилена за одну стадию составляет 8—12%, а при неоднократной циркуляции газа достигает 95—97%.
Являясь термопластичным полимером, полиэтилен не растворяется в органических растворителях, но набухает в них, растворяется при температуре выше 70 °С в хлорированных углеводородах, устойчив к действию концентрированных кислот, щелочей и растворов солей, но разрушается под действием окислителей, особенно при нагревании. Полиэтилен устойчив при нагревании без доступа воздуха до 290 °С, но при температуре 350—400 °С разлагается с образованием жидких и газообразных продуктов.
Полиэтилен перерабатывается в изделия литьем под давлением, экструзией и прессованием; изделия из полиэтилена поддаются сварке. Он используется для изготовления пленки и листов, литьевых изделий, труб, для изоляции кабеля и других изделий, широко применяющихся во многих отраслях народного хозяйства и в быту. Особенно широко применяется полиэтилен для защиты металлических изделий от коррозии.
Поливинилхлорид [—СН2 — СНС1—]n относится к высокомолекулярным галогенопроизводным углеводородам. Получают его лаковым, эмульсионным и блочным способами. Полимеризацию лаковым, эмульсионным и блочным способами. Полимеризацию хлористого винила ведут по радикальному механизму, но она может протекать и по ионному типу. Наиболее распространенным методом получения поливинилхлорида является суспензионная полимеризация хлористого винила в водной среде.
В эмалированный реактор емкостью 10—20 м3, снабженный мешалкой и рубашкой для обогревания или охлаждения смеси реагентов, подается вода, раствор стабилизатора эмульсии (поливиниловый спирт, желатина и др.), раствор инициатора например перекись бензоила и другие компоненты, нерастворимые в воде. После их загрузки реактор продувают азотом и при перемешивании вводят жидкий винилхлорид. Реакционную смесь нагревают до 40—50 °С, подавая в рубашку реактора горячую воду. Процесс полимеризации длится 20—30 ч при температуре 40—80 °С и давлении 0,5—1,4 МПа. В процессе полимеризации давление в реакторе снижается, что указывает на окончание реакции.
Образующуюся суспензию перекачивают в емкость, сюда же уводят раствор щелочи для разрушения эмульгатора, инициатора Н низкомолекулярных продуктов, а затем подают острый пар для нагревания массы до 94—96 °С. Полимер охлаждают, промывают и подают на центрифугу для отделения от раствора. Полученный продукт, содержащий около 25% влаги, поступает в аппарат для сушки в кипящем слое, а затем на рассев и затаривание в мешки.
Поливинилхлорид, полученный этим способом, отличается от любого другого поливинилхлорида более высокой степенью чистоты, лучшими диэлектрическими показателями, высокой водо- и термостойкостью. Это объясняется однородностью его состава (имеет определенную молекулярную массу, что обусловлено поддержанием строго определенной температуры в самих каплях мономере, т.е. как бы в микроблоке).
Технический поливинилхлорид — белый полидисперсный порошок, молекулярная масса его 30000—150000 и степень полимеризации от 100 до 2500. Он не воспламеняется и не горит, нерастворим в воде, спирте, бензине и многих других растворителях, но при нагревании растворяется в хлорированных углеводородах, ацетоне, циклогексаноне и др., устойчив к воздействию сильных и слабых кислот и щелочей, смазочных масел.
На основе поливинилхлорида получают пластические массы двух типов: жесткие, не содержащие пластификаторов (винипласт), и мягкие, содержащие пластификаторы (пластикат).
Винипласт получают из поливинилхлоридной смолы, смешанной при повышенной температуре (160°С) со стабилизаторами (стеаратами кальция, бария, углекислым свинцом и др.) и смазывающими веществами. Из полученной смеси вальцеванием, ка-ландрованием, экструзией, формованием при 150—170 °С получают пленки, листы, трубы, вентили и другие изделия.
Винипласт поддается механической обработке, хорошо сваривается и склеивается. Механические свойства винипласта достаточно высоки.
Винипласт используется для изготовления трубопроводов, вентилей, кранов, барабанов центрифуг, колонн для поглощения окислов азота и других агрессивных газов. Из листового материала готовят крупные емкостные аппараты, сложные фильтры, вентиляционные системы в помещениях с агрессивной средой и т. д.
Пластикат готовят из смеси смолы, наполнителя (каолин), стабилизатора (стеараты и карбонаты кальция, свинца и др.) и пластификатора (фталаты, себацинаты, трикрезилфосфаты и другие малолетучие жидкости и их смеси), вводимого в количестве от 30 до 60% от массы смолы. Пластификаторы улучшают эластические и пластические свойства поливинилхлорида. Из полученной однородной массы вальцеванием, каландрованием или экструзией получают пленки, листы, трубы и различные другие изделия.
Пластифицированный материал обладает эластическими свойствами, но не является эластомером. Он используется для получения пленки, линолеума, приводных ремней, армированных тканью, транспортных лент, в качестве заменителя кожи.
Для защиты от коррозионного разрушения аппаратуры пластикат используется реже, так как обладает меньшей химической стойкостью, чем винипласт.
Полистирол
 представляет
собой твердый аморфный продукт,
молекулярная масса которого 200000—400
000. Обладая ценными техническими
свойствами, полистирол и сополимеры
стирола по объему производства занимают
третье место среди пластмасс, уступая
только полиэтилену и поливинилхлориду.
представляет
собой твердый аморфный продукт,
молекулярная масса которого 200000—400
000. Обладая ценными техническими
свойствами, полистирол и сополимеры
стирола по объему производства занимают
третье место среди пластмасс, уступая
только полиэтилену и поливинилхлориду.
Исходным сырьем для получения полистирола служит стирол С6Н5СН = СН2, образующийся в процессе дегидрирования этилбензола в присутствии катализатора:

Реакционная смесь, содержащая стирол и примеси побочных продуктов, подвергаются разделению. От стирола отделяют непрореагировавшие углеводороды, а затем вымораживают воду.
Полимеризацию стирола проводят блочным, эмульсионным и суспензионным способами. В зависимости от способа получения свойства полистирола различны.
Полимеризацию стирола в блоке (массе) осуществляют по радикальному механизму как в присутствии инициатора (перекись бензоила), так и без него. Чаще полимеризацию проводят без инициатора, только под действием тепла, так как получаемый при этом стирол обладает хорошими диэлектрическими свойствами. В настоящее время применяют непрерывную термическую полимеризацию стирола в реакторах колонного типа без перемешивания и в каскаде реакторов с перемешиванием.
Технологический процесс получения полистирола состоит в следующем. Химически чистый жидкий стирол из хранилища центробежным насосом непрерывно подается в реакторы предварительной полимеризации , представляющие собой цилиндрические аппараты, изготовленные из алюминия и снабженные мешалками и рубашками для нагревания или охлаждения массы в зависимости от условий процесса. В реакторах при 80—82 °С процесс образования полимера проходит частично. После того как содержание полистирола в реакторах достигнет 30%, жидкую смесь сливают в верхнюю часть полимеризационной колонны состоящей из шести секций. Каждая секция снабжена рубашкой и змеевиком, изготовленным из нержавеющей стали, для поддержания в секциях определенной температуры (от 100 до. 200 °С). В нижней части колонны имеется обогреватель. Диаметр колонны 600— 1500 мм, высота 5—11 м. В качестве теплоносителя применяется смесь 26,5% дифенила и 73,5% дифенилоксида, называемая динилом.
По мере движения стирола по колонне сверху вниз заканчивается его полимеризация. Степень превращения стирола и молекулярная масса образующегося полистирола зависят от температуры.
Из реактора и колонны пары стирола поступают в холодильник , где они конденсируются, и стирол возвращается в верхнюю часть полимеризационной колонны. Полимеризацию стирола в реакторах) и в колонне ведут в среде азота во избежание окисления полистирола кислородом воздуха. Расплавленный полистирол из нижней конической части колонны поступает в шнек - пресс и в виде прутков подается на охлаждение, а затем на дальнейшую переработку.
Блочный способ получения полистирола имеет ряд преимуществ перед другими методами: процесс прост в аппаратурном оформлении, непрерывен, а получаемый продукт является самым дешевым. В полистироле отсутствуют примеси, снижающие его свойства, особенно электрические.
Эмульсионную полимеризацию стирола проводят в эмалированных аппаратах или аппаратах, изготовленных из нержавеющей стали (с мешалкой и рубашкой) емкостью 6—15 м3. В реактор заливают стирол, воду, эмульгаторы (натриевые соли сульфокислот), раствор едкого натра и инициаторы (надсернокислый калий, перекись водорода и др.). В течение 30 мин смесь перемешивают и нагревают до 70—90 °С. Полимеризация стирола длится 5—6 ч, в результате чего образуется мелкодисперсная смесь - латекс, который под действием кислой среды, создаваемой кислотами или кислыми солями (например, A12(S04)3), разрушается.
После промывки горячей водой, полистирол отделяют от воды, сушат при 60—70 °С, а затем направляют для разделения на фракции.
Получаемый по этому методу полистирол содержит небольшие количества эмульгатора и имеет высокую дисперсность, поэтому он используется главным образом для производства пенополистирола.
Полимеризацию полистирола можно проводить и по непрерывной схеме.
Изотактический полистирол получают в присутствии триэтил- или триизобутилалюминия и треххлористого титана и др. Образующийся полимер имеет кристаллическую структуру со строго регулярным расположением боковых цепей, например, все группы С6Н5 — расположены с одной стороны, главной цепи макромолекулы:
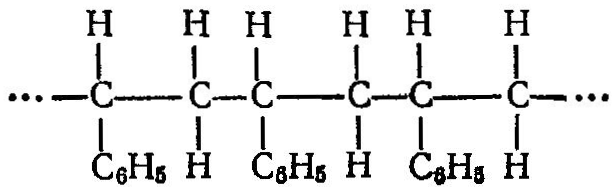
Изотактический полистирол имеет более высокие механические свойства.
Лаковый и суспензионные методы получения полистирола применяются реже.
Полистирол относится к термопластичным полимерам. Он устойчив к воздействию минеральных кислот и щелочей, спиртов, масел; но разрушается азотной кислотой, растворяется в ароматических и хлорированных углеводородах, алифатических эфирах н во многих кетонах. Полистирол поддается всем видам механической обработки и применяется для получения изделий прессованием, литьем под давлением, экструзией. Из полистирола получают нити, пленочные материалы и различного вида фасонные изделия. Особенно широко полистирол используется для изготовления товаров народного потребления.
Производство пластических масс на основе полимеров, получаемых поликонденсацией и ступенчатой полимеризацией.
Фенолоальдегидные смолы и пластмассы на их основе находят широкое применение в технике. В качестве сырья для их получения используют фенолы (крезол, ксилолы, фенол и др.) и альдегиды (формальдегид, фурфурол). Наибольшее применение для получения смол находят фенол и формальдегид.
Фенол представляет собой кристаллическое вещество, плавящееся при 40,9 °С. В основном его получают синтетическим методом и лишь в небольшом количестве (~3,5%) из каменноугольной смолы. Он смешивается в любых соотношениях со спиртом, водой при нагревании свыше 66 °С, растворим в эфире, глицерине, сероуглероде и др.
Смолы, полученные на основе фенола и формальдегида, получили название фенолоформальдегидных. Они находят наибольшее применение из других смол этой группы. В зависимости от соотношения между фенолом и формальдегидом и применяемого катализатора получаемые смолы могут быть термопластичными (новолачные) и термореактивными (резольные).
Новолачные смолы получают в водной среде при конденсации избытка фенола и формальдегида в присутствии кислоты (соляная, щавелевая, серная кислоты) по схеме:
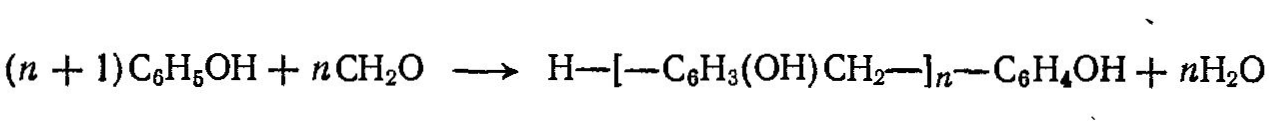
Обычно взаимодействие протекает при мольном соотношении фенола и формальдегида, равном 7:6. Новолаки являются низкомолекулярными соединениями (n = от 4 до 8). При нагревании они плавятся, легко растворяются в спирте. Новолачные смолы применяют для получения пресспорошков, абразивных изделий, газонаполненных материалов. Для перевода этих смол из термопластичного состояния в термореактивное в качестве отвердителя используют уротропин.
Резольные смолы получают из фенола и небольшого избытка формальдегида в присутствии щелочных катализаторов NH4OH, NaOH, Ва(ОН)2.
Процесс образования смолы состоит из двух стадий: реакции фенола с формальдегидом с образованием фенолоспиртов и конденсации фенолоспиртов с образованием резола (смесь полифенолов):

Фенолоспирты реагируют между собой с образованием резолов

Резолы представляют собой смесь линейных и разветвленных полимеров общей формулы
Н—[—С6Н2(ОН) (СН2ОН)СН2—]m[— С6Н3(ОН)СН2—]n—ОН
где n = 2+5, а m+n — 4+10.
Резольная смола является низкомолекулярным соединением (от 400 до 1000). При нагревании смолы происходит дальнейшая конденсация макромолекул, в результате чего образуется резит, представляющий собой неплавкий и нерастворимый полимер следующего строения:
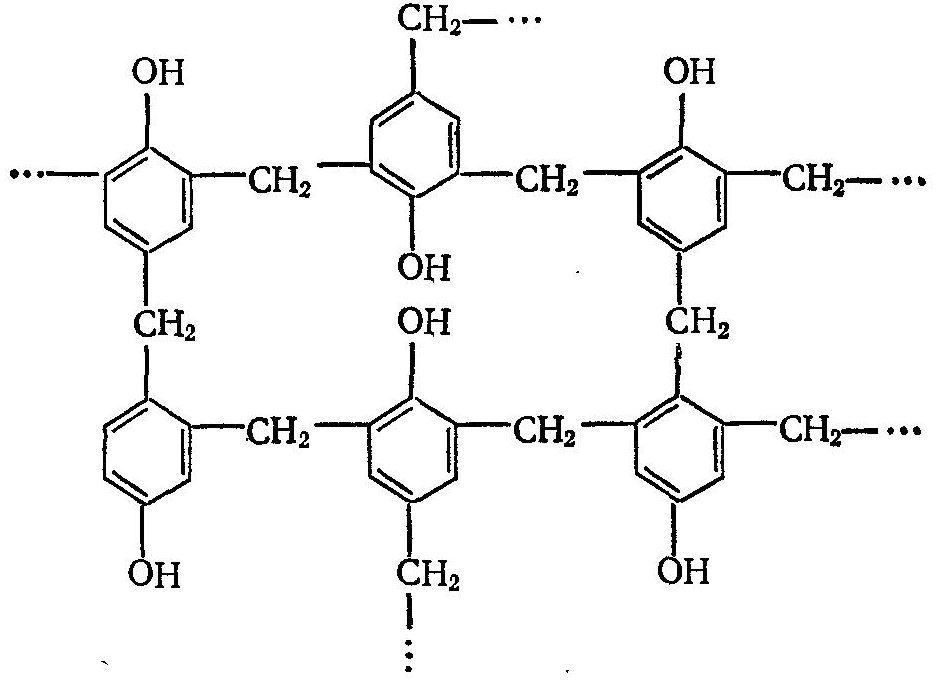
Процессы получения новолачной и резольной смолы практически не отличаются друг от друга. В реактор вводят фенол, формальдегид, различные добавки и катализатор и смесь нагревают в реакторе до 70— 75 °С с помощью пара, подаваемого в рубашку реактора. Поликонденсация фенола с формальдегидом протекает с выделением тепла. Оптимальная температура в реакторе должна быть не выше 80 °С, поэтому по достижении этой температуры отключают подачу пара и ведут охлаждение смеси, подавая в рубашку реактора воду. В процессе поликонденсации пары воды поступают в трубчатый холодильник и конденсируются. Образовавшаяся смола плавится и в жидком состоянии выдавливается из реактора по трубе сжатым воздухом в противень, здесь она затвердевает и измельчается в порошок.
Фенолоформальдегидные смолы находят широкое применение в качестве связующего при получении пресспорошков, волокнистых материалов, слоистых пластиков, поропластов. Кроме того, они используются для получения лаков и клеев.
Пластические массы, получаемые на основе фенолоформальдегидных смол, получили название фенопластов. Литой резит относится к ненаполненным фенопластам, так как он состоит только из одной смолы. Он имеет низкие физико-механические свойства, трудно перерабатывается в изделия, поэтому практического значения не имеет.
Композиционные фенопласты в зависимости от наполнителя делятся на прессовочные, волокнистые и слоистые материалы.
Изделия из пресспорошков. Выпускаемые промышленностью пресспорошки классифицируются в зависимости от назначения, по виду сырья, применяемого для получения смол; по поведению смолы при нагревании. Ассортимент выпускаемых порошков очень велик (примерно 100 марок).
Пресспорошки в зависимости от связующего подразделяются на новолачные и резольные.
Новолачные пресспорошки готовят из смеси твердых фенолоформальдегидных смол, наполнителей (древесная мука, каолин, тальк, слюда, графит, кварц, асбест и др.), отвердителей (уротропина, окиси магния, кальция и др.), смазки (олеиновая, стеариновая кислоты и их соли), красителей и пигментов (мулия, охра, литопон и др.). Получают их вальцеванием и шнековым методом.
Резольные пресспорошки отличаются по составу от новолачных только тем, что при их получении применяются фенолоформальдегидные смолы резольного типа. Пресспорошки перед прессованием таблетируют.
Свойства изделий, получаемых из пресспорошков, зависят от свойств и количества применяемых связующего и наполнителя. Например, тепло- и жаростойкость изделий можно повысить, вводя в пресспорошки кварц, слюду, асбест.
Технологические свойства пресспорошков зависят от типа смолы, рода наполнителя и его содержания, количества отвердителя. Изделия из пресспорошков готовят методом горячего прямого и литьевого прессования при 160—200 °С под давлением и другими специальными методами.
Рассмотрим примеры использования пресспорошков для изготовления изделий.
Изделия общетехнического назначения получают из пресспорошков, содержащих фенолоформальдегидные смолы и древесную муку. К ним относятся ненагруженные армированные и неармированные детали и изделия широкого потребления (розетки, рукоятки, корпуса проигрывателей и др.).
Радиодетали и другие изделия, работающие при высоких температурах, готовят из пресспорошков, содержащих смолы, асбест или слюду. Изделия, устойчивые к действию воды и кислот, готовят из пресспорошков, имеющих в своем составе новолачные смолы, совмещенные с поливинилхлоридом, каучуком и другими полимерными соединениями. В качестве наполнителей применяют кокс, графит, каолин и др.
Волокниты - прессовочные материалы, получаемые на основе волокон различного типа и растворов фенолоформальдегидных или других смол.
Из волокнита (наполнитель — хлопковая целлюлоза) прессуют детали общетехнического назначения, работающие на изгиб, истирание, кручение, а также изделия, обладающие антифрикционными свойствами (переключатели, фланцы, рукоятки, шестерни и т. д.). Изделия из них устойчивы в воде, слабых кислотах и основаниях, но разрушаются при действии сильных кислот и щелочей.
Асбоволокнит готовят прессованием асбеста и других составляющих, пропитанных фенолоформальдегидной или другой смолой. Материал применяют для изготовления деталей электротехнического назначения и изделий, обладающих фрикционными свойствами, высокой теплостойкостью и механической прочностью, например, тормозные колодки экскаваторов, подъемных кранов.
Фаолит получают прессованием асбеста или смеси графита и асбеста, пропитанных фенолоформальдегидной смолой. Он устойчив в растворах соляной кислоты любой концентрации, в 40%-ной серной, в 50%-ной ортофосфорной и уксусной кислотах, в хлорированных углеводородах, но, разрушается иодом, бромом, щелочами, ацетоном, спиртом и кислотами, обладающими окислительными свойствами.
Из фаолита при обычной температуре, без давления готовят крупногабаритные изделия: трубы, ванны, адсорберы, различного вида емкости и т. д., которые затем отверждаются при температуре 60—130°С. Теплостойкость фаолита около 145°С.
Фенопласты, содержащие стеклянное волокно в качестве наполнителя, называются стекловолокнитами. Эти материалы обладают высокой удельной прочностью, жесткостью, устойчивы к вибрационным нагрузкам, к многим химическим реагентам и микроорганизмам, имеют хорошие диэлектрические и теплоизоляционные свойства.
Слоистые пластики — прессматериалы, содержащие листовой наполнитель: хлопчатобумажную ткань (текстолит), бумагу (гетинакс), асбестовую (асботекстолит) или стеклянную (стеклотекстолит) ткань, стеклянный и древесный шпон (древеснослоис- тыепластики ДСП). Получают слоистые материалы горячим прессованием уложенных правильными рядами слоев листового наполнителя, пропитанного резольной смолой. Полученный материал обладает хорошими физико-механическими и химическими свойствами (см. табл. XV. 3).
Текстолит используется для изготовления изделий, обладающих стойкостью к вибрационным нагрузкам; износостойкостью и электроизоляционными свойствами. Из него готовят шестерни, вкладыши, детали, работающие в условиях трения, декоративные и отделочные материалы.
Гетинакс широко применяется в электро- и радиотехнической промышленности и, в частности, в производстве печатных схем для радио и телевизоров, переключателей и т. п.
Стеклотекстолиты выпускаются в виде листов различных размеров длиной до 2,5 м, шириной до 1 м и толщиной 0,5—15 мм. Они широко применяются для изготовления фюзеляжей самолетов, кузовов автомобилей, деталей машин, лодок, судов, самолетов и т. д. Теплостойкость стеклотекстолита 200°С при продолжительной эксплуатации и 300°С при кратковременной работе.
Стекловолокнистый анизотропный материал (СВАМ) готовят горячим прессованием стеклянного шпона с нанесенным на его поверхность связующим (совмещенные фенолформальдегидные смолы с поливинилбутиралем или с эпоксидыми олигомерами). Прессование проводят в гидравлических прессах при температуре 150—160°С и давлении 4 МПа с последующей вытяжкой изделий, продолжительность вытяжки 6 мин на 1 мм толщины получаемого изделия.
СВАМ, подобно фанере, обладает упругими анизотропными свойствами и в зависимости от укладки волокон может иметь высокую прочность вдоль расположения стекловолокон и низкую в поперечном направлении. Из него готовят трубы и другие изделия, устойчивые к действию химических реагентов, детали катеров, лодок, конструкций кораблей, кузовов автомашин, прицепов, цистерн, хранилищ и т. д., а также применяют как электроизоляционный материал (электрощиты, электроаппаратура). СВАМ нашел широкое применение в строительстве: из него готовят плиты перекрытий и несущие панели стен, тепло- и звукоизолирующие строительные элементы, шахтную крепь и кузова шахтных вагонеток и др.
Древесно-слоистые пластики (ДСП) используются для изготовления мебели, спортивных лодок, деталей катеров, вкладышей подшипников, шестерен, опорных рам, фрикционных шкивов, втулок небольшого диаметра и других деталей.
Эпоксидные смолы получают взаимодействием эпоксисоединенин с веществами, содержащими подвижные атомы водорода, или введением эпоксидных групп
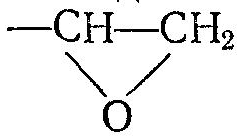
в ненасыщенные соединения под действием надкислот, например, надуксусной кислоты СНзСОООН.
Наиболее широко применяется первый метод получения эпоксидных смол, где в качестве сырья используют мономеры, содержащие эпокси-группы, и многоатомные фенолы (дифенилолпропан, гидрохинон, пирогаллол и др.).
Образование эпоксидной смолы при взаимодействии эпихлоргидрина и дифенилолпропана в присутствии щелочи происходит по схеме

Кроме диглицидного эфира в смеси содержатся полимеры большей молекулярной массы (т. е. с числом звеньев от 2 до 16), которые имеют следующую структуру:

Эпоксидные смолы такого строения имеют линейную структуру, поэтому они плавятся и растворяются в органических растворителях.
Эпоксидные смолы получают и при взаимодействии эпихлоргидрина с аминами (например, с анилином), гликолями (например, этиленгликолем) и др.
По второму методу эпоксидные смолы можно получать при взаимодействии непредельных углеводородов (например, дивинила) с надуксусной кислотой:

Образующиеся соединения могут далее реагировать с мономерами по реакциям, приведенным для первого способа.
Эпоксидные смолы представляют собой олигомеры, содержащие свободные концевые эпокси-группы, которые при взаимодействии с некоторыми веществами (отвердителями) и между собой образуют полимеры сетчатого строения. В качестве отвердителей применяются гексаметилендиамин, этиленполиамин, меламин, смолы, фталевый ангидрид, кислоты и др. Эпоксидные смолы допускают высокую степень наполнения (50%) их различными наполнителями (кварцем, стеклом, тальком, асбестом, графитом и др.). Присутствие наполнителей способствует увеличению твердости и теплостойкости, снижению усадки и стоимости пластмассы, при использовании же армирующих наполнителей в виде волокна и тканей можно получать высокопрочные материалы.
Эпоксидные смолы и компаунды широко применяются для изоляции и герметизации изделий; в машиностроении (изготовление штампов холодной вытяжки, прессформ, литейных моделей и т. п.); для изготовления клеев, исправления дефектов литых изделий, ремонта металлических деталей и трубопроводов и для изготовления различного вида фасонных изделий. Так, из стеклопластиков и СВАМ, полученных из эпоксидных смол, готовят корпуса моторных лодок, разнообразные детали, используемые в авиа-, судо- и ракетостроении и т. д. Обладая высокой адгезией ко многим материалам, прочностью и химической стойкостью к растворителям, кислотам, щелочам и растворам солей, эпоксидные смолы широко используются для защиты металлов, сплавов и других материалов от коррозии.
различного вида фасонных изделий. Так, из стеклопластиков и СВАМ, полученных из эпоксидных смол, готовят корпуса моторных лодок, разнообразные детали, используемые в авиа-, судо- и ракетостроении и т. д. Обладая высокой адгезией ко многим материалам, прочностью и химической стойкостью к растворителям, кислотам, щелочам и растворам солей, эпоксидные смолы широко используются для защиты металлов, сплавов и других материалов от коррозии.
Производство каучука и резино - технических изделий. Основные свойства и применение. Примеры.
Среди большого числа высокомолекулярных соединений в современной технике и технологии каучук находит особенно широкое применение.
Каучук является основным компонентом при изготовлении резиновых, резино-тканных и резино-металлических изделий, используемых в промышленности, сельском хозяйстве, на транспорте и в домашнем обиходе. На основе каучуков получают более 40000 наименований резиновых изделий, к их числу относятся автомобильные и авиационные шины, приводные ремни, потребность в которых исчисляется в десятках миллионов квадратных метров в год, гибкие шланги и рукава, детали машин и механизмов, предметы санитарии н гигиены и т. д. Такое широкое применение резин объясняется тем, что они обладают уникальной способностью к обратным деформациям в сочетании с высокой прочностью, эластичностью, сопротивляемостью к истиранию.
Резины устойчивы к действию многих химических реагентов, что позволяет использовать их для футеровки химической аппаратуры и при изготовлении деталей уплотнений. Они газо- и водонепроницаемы, имеют высокие диэлектрические свойства и являются незаменимым материалом при производстве кабеля, аэростатов, надувных лодок, скафандров и т. п. Новые быстро развивающиеся отрасли техники требуют разработки современных типов каучуков и резин, выдерживающих температуры от —100 до +350 °С, устойчивых к действию окислителей, бензина, масел, растворителей, облучения и т. п.
Сырье и материалы резинового производства
Сырьем для получения резины служат сырой каучук, синтетические латексы и смолы, регенерат, вулканизующие вещества, ускорители вулканизации, активаторы или замедлители вулканизации, красители, пластификаторы, противостарители, активные наполнители, армирующие и вспомогательные материалы. Основным сырьем, определяющим свойства резин, является каучук.
Каучуки являются высокомолекулярными соединениями. Они имеют линейное строение и обладают способностью к обратной деформации в сочетании с высокой прочностью.
Для изготовления резин применяется натуральный и синтетические каучуки.
Натуральный каучук относится к каучукам общего назначения, т. е. к каучукам, применяемым для изготовления резиновых изделий широкого потребления (шин, ремней, обуви и т. д.).
Синтетические каучуки в зависимости от строения макромолекулы подразделяются на органические, элементоорганические и неорганические. Они могут быть гомополярными, т. е. макромолекулы их состоят из звеньев одного мономера, и сополимерными, когда макромолекулы содержат два или несколько мономерных звеньев.
Натуральный каучук до 1932 г. был единственным сырьевым материалом, применяемым для производства резины. Получают натуральный каучук (НК) из млечного сока некоторых каучуконосных растений («Као-чу», т. е. «слезы дерева»), преимущественно из тропического дерева гевеи, из которого выделяют 99% всего мирового каучука. Млечный сок (латекс) дерева гевеи содержит частички каучука (до 30%), взвешенные в воде (до 60%), белковые вещества (2—2,7%), смолы (1,65—3,4%), сахаристые (1,5— 4,2%) и минеральные (0,2—0,7%) вещества. На состав латекса влияют возраст дерева, время года, климатические условия.
При обработке млечного сока на месте его добычи кислотами, например уксусной, происходит коагуляция сока с образованием гелеобразного продукта. Этот продукт пропускают через вальцы, сушат, коптят (для предохранения от загнивания при хранении) и в виде листов, упакованных в кипы, направляют потребителю.

Макромолекулы натурального каучука состоят из элементарных звеньев изопрена; он имеет малую плотность (917—937 кг/м3) и большую молекулярную массу (от 150000 до 500000), что соответствует длине макромолекулы 10000— 40000 А при поперечном сечении 3 А. Такие длинные нитевидные гибкие макромолекулы и определяют физические и механические свойства каучука. Он обладает высокой эластичностью, прочностью, малой гигроскопичностью и теплопроводностью и является превосходным изолятором. Прочность при разрыве его составляет от 1 до 4 МПа, а в вулканизированном состоянии — до 30 МПа.
НК является термопластичным полимером. При нагревании выше 200 °С он разлагается с образованием изопрена и других низкомолекулярных соединений, а при радиационном облучении выделяется водород. Натуральный каучук растворяется в бензине, бензоле, сероуглероде и др. с образованием вязких растворов, которые используются как клеи.
Поскольку в макромолекуле каучука имеются двойные связи, он вступает во взаимодействие с галогенами, тиоспиртами, тиокислотами, кислородом, озоном и др. При взаимодействии с серой и органическими перекисями линейная структура макромолекул нату- рального каучука превращается в сетчатую (процесс вулканизации). Это свойство каучука лежит в основе получения резины.
Натуральный каучук в основном применяется для изготовления резины, причем большая его часть используется для получения автомобильных шин и только около 1 % применяется в обувной промышленности и для получения резинового клея.
Синтетические каучуки (СК) в настоящее время занимают ведущее место (около 2/3 всего производимого в мире каучука) при производстве резины.
В зависимости от применения СК подразделяют на каучуки общего назначения: бутадиеновый (СКВ), бутадиен-стирольный (СКС), бутадиен-метилстирольный (СКМС), изопреновый (СКИ); каучуки специального назначения: бутадиен-нитрильный (СКН), хлоропреновый (наирит), бутилкаучук, тиоколовый, силиконовый (СКТ) и др.
Первый в мире синтетический каучук был получен в СССР в 1932 г., несколько позже каучук ехали получать в Германии (1938 г.) и США (1942 г). Процесс получения синтетического каучука включает две стадии: синтез мономеров и полимеризацию или поликонденсацию мономеров.
Для получения СК и латексов применяют так называемые каучукогенные мономеры: бутадиен, стирол, изопрен, хлоропрен, изобутилен и др.
Натрий-бутадиеновый каучук (СКВ) является первым каучуком, полученным синтетическим путем по методу акад. Лебедева С. В. полимеризацией бутадиена в присутствии металлического натрия. Бутадиен для этой цели получили из этилового спирта в присутствии катализаторов. В настоящее время его получают в основном, дегидрированием бутана.
Натрий-бутадиеновый каучук обладает низкими адгезионными свойствами и эластичностью, характеризуется невысокими прочностными свойствами и морозостойкостью по сравнению с натуральным и другими синтетическими каучуками, поэтому в настоящее время он практически не применяется.
Бутадиен-стирольные каучуки (СКС, СКМС) получают из бутадиена СН2 = СН — СН = СН2 и стирола С6Н5СН = СН2(СКС), бутадиена и метилстирола С6Н5ССН3 = СН2 (СКМС). Процесс сополимеризации приведенных выше мономеров проводят эмульсионным способом по непрерывной схеме.
В зависимости от содержания стирола бутадиен-стирольные каучуки маркируют различными числовыми индексами, например, каучук типа СКС-10, содержит 10% стирола и 90% бутадиена. При увеличении в каучуках стирола или метилстирола ухудшаются клеющая способность, эластические свойства, морозостойкость, но улучшаются показатели прочности.
Вулканизированные каучуки СКС и СКМС имеют низшую прочность, которая резко возрастает (в 10—12 раз) при введении в резиновую смесь газовой сажи. Диэлектрические свойства этих каучуков приближаются к свойствам натурального, а молекулярная масса увеличивается от 10000 до 100000.
Из этой группы каучуков наибольшее применение находят каучуки СКС40/СКС-30, СКМС-10, СКМС-30. Каучуки СКС-30 и СКМС-30 относятся к универсальным каучукам. Они используются для изготовления шин, транспортерных лент, обуви и других резиновых изделий. Каучуки СКС-10 и СКМС-10 обладают высокой прочностью при истирании, твердостью, растворяются в бензине, бензоле и других углеводородах, хорошо смешиваются с различными ингредиентами резиновых смесей. Прочность на разрыв не- наполненных резин на основе этих каучуков невысока. Для повышения механических свойств в состав резин вводят наполнители, например 50 масс, частей сажи. Такие резины имеют прочность на разрыв 20—25 МПа и температуру стеклования от —72 до —77°С.
Синтетический изопреновый каучук (СКИ), полученный впервые в Советском Союзе, находит широкое применение для получения резины. Его готовят полимеризацией изопрена (~15%) в растворе изопентана или другого растворителя непрерывным методом при температуре 18—25 СС в присутствии комплексных катализаторов (металлического лития, тетрахлорида титана, триизобутил- алюминия, триэтилалюминия и др.):

СКИ обладает высокой прочностью и клеющей способностью, сохраняет свои свойства при нагревании до + 100°С. По своему строению, физическим, технологическим, эластическим и эксплуатационным свойствам СКИ близок к НК, поэтому, в отличие от других каучуков общего назначения, он вполне может заменить натуральный каучук при изготовлении резины.
Резины, получаемые из СКИ, набухают в маслах, бензине и других органических веществах, окисляются кислородом воздуха, морозостойки и газонепроницаемы.
Хлоропреновый каучук (наирит) получают эмульсионной полимеризацией хлоропрена:

Процесс проводят в водной среде в присутствии эмульгатора (олеинат натрия). Получаемый латекс коагулирует при взаимодействии с кислотами и солями, после чего гелеобразный продукт промывают, сушат и превращают в листы, блоки, бруски. Средняя молекулярная масса такого каучука — 100000. Наирит не требует специальной пластификации, так как обладает высокой клейкостью. Это упругое, но более жесткое по сравнению с натуральным каучуком вещество.
Прочностные свойства его близки к свойствам натурального каучука. Он нерастворим в углеводородах жиррого ряда, но растворяется в хлорированных и ароматических углеводородах, устойчив к воздействию света, озона, кислорода, огнестоек.
При получении резины каучук вулканизируют в присутствии' окислов цинка, ртути и др. Резины, получаемые на его основе, обладают высокой прочностью от 22 до 35 МПа при относительном удлинении 800—1000%.
Наирит неустойчив при изменении температур, твердеет при хранении, а при нагревании от него отщепляется хлористый водород. Применяется он главным образом в производстве ремней, транспортерных лент, клеев, для изготовления кабеля.
Кремнийорганические (силиконовые) каучуки получают при поликонденсации циклических силоксанов или линейных силоксан- диолов. Полимеры имеют линейное строение, например

где R, R'— метальные, этильные, фенильные, винильные и другие группы.
Кремнийорганические каучуки могут быть высокомолекулярными (молекулярная масса от 500000 до 1000000) и низкомолекулярными от 20000 до 100000. Каучуки озоно-, морозо- и термостойки, но механические их свойства, масло- и нефтестойкость хуже, чем любого другого каучука. В отличие от других видов вулканизацию кремнийорганических каучуков ведут в присутствии органических перекисей (например перекиси бензоила) при нагревании до 200 °С. Силиконовые каучуки используются при получении резин с повышенной морозо- и теплостойкостью, а также для изготовления деталей, работающих на сжатие. Из резины готовят жароупорные прокладки, уплотнения, клапаны, электроизоляцию и т. д.
В настоящее время выпускается несколько видов каучуков: ди- метилсилоксановый СКТ, метилвинилсилоксановый СКТВ, этил- силоксановый СКТЭ, фенилсилоксановый СКТ ФВ, бор- и фосфор- силоксановые, низкомолекулярные каучуки СКТН, СКТН-1 и др.
Резины, изготовленные на основе силиконовых каучуков, начинают разлагаться при температуре 600—700°С, но в течение нескольких секунд они могут выдерживать температуру 3000 °С.
Вспомогательные материалы. Синтетические латексы - сложные коллоидные системы, содержащие до 35% каучуков с частицами размером от 5-10-6 — 5- 10-4см. Они устойчивы в воде благодаря присутствию в системе эмульгатора.
Латексы получают эмульсионной полимеризацией и сополимеризацией. Наибольшее применение находят бутадиен-стирольные, хлоропреновые, бутадиен-нитрильные, бутадиен-винилиденхлоридные латексы. Они широко используются в производстве губчатых изделий, нетканных материалов, тонкостенных изделий, для пропитки волокон, в производстве бумаги, кожи, красок и т. д. Особенно незаменимы латексы при изготовлении изоляционных изделий и как пропиточный материал для тканей, используемых при изготовлении шин и резино-технических изделий, что позволяет усилить прочность корда и тем самым увеличить срок эксплуатации шин.
Синтетические смолы - вводят в резиновую смесь и в пропиточные составы как добавки к каучуку для улучшения обработки резиновой смеси, повышения ее износостойкости и прочности резиновых изделий. Наибольшее применение из полимеров находят поли- изобутилен, полипропилен, поливинилхлорид, фенолоформальдегидные смолы.
Регенерат - материал, получаемый в результате переработки отходов резинового производства, резин, изношенных шин и других изделий. Получают регенерат тепловой обработкой тонко измельченной резины в течение 10—16 ч при 150—200 °С в присутствии пластификаторов и других веществ. В результате нагревания происходит девулканизация резины и материал превращается в пластичную массу.
Регенерат широко применяется в резиновой промышленности, так как он в 3—5 раз дешевле каучука. Кроме того, введение регенерата в резиновую смесь облегчает ее обработку и изготовление изделий, увеличивает химическую стойкость резин и их сопротивление старению.
Армирующие материалы - применяемые при изготовлении резиновых изделий, позволяют им сохранять свои размеры под нагрузкой или при нагревании. При работе вводимый в резиновые изделия каркас из ткани или металла воспринимает всю механическую нагрузку, регулирует деформируемость изделия, а резина придает ему необходимую эластичность. В зависимости от назначения изделий армирующими материалами могут быть стальные тросы и проволока, природные и химические волокна, различные ткани и т. д.
Ингредиенты резиновых смесей. Резина - материал, способный к большим высокоэластичным деформациям. Получают ее из каучука (или регенерата) или из смеси каучука и других веществ, получивших название ингредиентов. Число веществ, входящих в состав резиновой смеси, зависит от условий работы резины и изделий на ее основе и колеблется от 5 до 20.
Как указывалось ранее, макромолекулы каучука имеют линейное или разветвленное строение, поэтому для превращения линейной структуры в пространственную (сетчатую) в резиновую смесь вводят .вулканизующие вещества (серу, окислы и перекиси металлов и др.). которые образуют поперечные мостики между длинными цепями макромолекул (процесс вулканизации). Вулканизация может быть вызвана ядерным облучением, в этом случае вулканизатор не требуется.
Процесс вулканизации можно ускорить введением в резиновую смесь ускорителей вулканизации (полисульфиды, каптакс и др.), которые способствуют также улучшению физико-механических свойств резины. В ряде случаев при получении резины для ускорения или замедления действия ускорителей в смесь вводят активаторы, а при необходимости и замедлители процесса вулканизации.
Механические и другие свойства резины улучшают введением в смесь активных наполнителей (сажи, двуокиси кремния, титана, окиси цинка и др.) в виде тонкоизмельченных порошков, количество которых колеблется от 15 до 100 масс, частей и более на ,100 масс, частей Каучука. Неактивные наполнители (мел, тальк, каолин и др.) незначительно повышают прочностные свойства резины, но они улучшают обрабатываемость сырой резины и снижают ее стоимость.
Для улучшения обрабатываемости сырой резины, равномерного распределения ингредиентов в смеси, повышения ее эластических свойств в состав смеси вводятся мягчители или пластификаторы, которые несколько снижают прочностные, но повышают пластические свойства резины. При использовании каучуков общего назначения в качестве пластификаторов применяются углеводороды (от 5 до 30 масс, частей), органические жирные кислоты (1—2 масс, части), смолы (3—10 масс, частей), а в каучуки специального назначения— эфиры (дибутилфталат) и синтетические смолы (фенолоформальдегидные и др.).
Изделия из каучука и резины под действием кислорода воздуха даже в состоянии покоя стареют, становятся хрупкими и ломкими. Для предотвращения или замедления этого процесса в состав резиновой смеси вводят противостарители (фенолы, ароматические амины и др.). Для придания цвета изделиям из резины применяют наполнитель — коллоидальную кремневую кислоту (белую сажу) или окись цинка и красители. Пористую резину (резину, содержащую ячейки, заполненные газом) получают введением в смесь порообразователей (углекислого аммония, диазосоединений и др.), разлагающихся при нагревании с выделением газов. Кроме перечисленных выше, в изделия добавляют резиновые клеи, смазки, растворители, пудры, (для снижения слипания полуфабрикатов) и др.
Процесс изготовления резиновых изделий состоит из нескольких стадий:
приготовление сырой резиновой смеси из ингредиентов;
изготовление или формование заготовок или изделий из сырой резиновой смеси;
вулканизация изделий;
отделка изделий.
Приготовление резиновой смеси включает операции, связанные с подготовкой сырьевых материалов (развеска, дозировка сырья, прорезинивание тканей, пластикацию каучука под действием тепла и др.) и их смешение.
Смешение составляющих резиновой смеси осуществляют в резиносмесителях, червячных прессах или на вальцах
Резиновая смесь подается в вальцы между двумя валками, укрепленными в станине. Поскольку передний валок вращается медленнее заднего валка, окружные скорости вращения валков различны. При прохождении резиновой смеси через зазор между валками в ней возникают деформации сдвига, что приводит к равномерному смещению ингредиентов.
Для изготовления заготовок, деталей, трубок, прорезиненных тканей и т.д. применяются червячные прессы (шприц-машины), каландры.
Изделия сложного профиля собирают из предварительно заготовленных частей и деталей (прорезиненные ткани, металлические каркасы и т. п.), соединяя их между собой склеиванием или подпрессовкой. Отдельные изделия получают из латексов, например пористые резины (вспенивание латекса), а тонкостенные изделия (перчатки и др.) получают методом окунания формочек в латекс, с последующей его коагуляцией, сушкой и вулканизацией получаемых изделий.
Вулканизация является заключительной стадией изготовления резиновых изделий, основное назначение которой состоит в закреплении полученной формы изделием и придании изделию свойств резины.
Количество вулканизатора, вводимого в резиновую смесь, оказывает сильное влияние на свойства резины.
Большое число резиновых, резино-тканевых и других изделий подвергают вулканизации при температуре 125—180°С в аппаратах, работающих под давлением в атмосфере насыщенного пара, горячего воздуха и др.
Продолжительность вулканизации изделий зависит от температуры, давления, габаритов изделия, состава резиновой смеси, греющей среды, аппаратуры, применяемой при вулканизации. Должен поддерживаться оптимальный режим вулканизации, так как от этого в значительной степени зависят прочностные свойства резины.
Вулканизацию резиновых изделий проводят в аппаратах различного типа, устройство которых зависит от сложности изготовляемых изделий и типа их конструкции. Наибольшее применение находят вулканизационные прессы, автоклавы, камеры, аппараты барабанного типа и другие.
Изделия, полученные после вулканизации, полностью теряют свои пластические свойства, но приобретают эластичность, повышенные прочностные свойства и износоустойчивость и др.
После вулканизации все резиновые изделия подвергаются отделке. При этом устраняются заусенцы, производится зачистка, обточка, шлифовка изделий, а в ряде случаев и их окраска с целью предохранения от старения (автомобильные шины) или для улучшения внешнего вида (галоши, мячи и др.). Все изделия для определения сортности подвергаются осмотру с целью выявления дефектов и выяснения возможности их устранения без изменения качества изделий.
Определение свойств и качества изделий осуществляется лабораторными, стендовыми, эксплуатационными испытаниями. При этом определяются физико-механические свойства, тепло- и морозостойкость, долговечность, сопротивление старению и истиранию.
В настоящее время выпускается большой ассортимент резиновых изделий, свойства и назначение которых определяются в основном свойствами применяемого каучука.
В зависимости от свойств и применения резины их делят на следующие группы:
резины общего назначения (шины, обувь, ремни и др.), эксплуатируемые при интервале минус 50 — плюс 110°С; такие резины изготавливаются на основе каучуков НК, СКВ, СКИ, СКС, СКМС и др.;
теплостойкие резины (детали самолетов, машин и др.), получаемые из силиконовых каучуков и фторкаучуков;
резины, устойчивые к действию низких температур, получаемые из силиконовых и фторкаучуков;
резины, устойчивые в окислительных средах, в растворах кислот, щелочей и солей и т. д.; их готовят на основе наирита, фторкаучуков, бутилкаучуков и др.;
маслостойкие резины, устойчивые к действию нефти и продуктам ее. переработки, получаемые из фторкаучуков, бутадиен- нитрильных и других каучуков.
Наряду с этими резинами находят применение газонаполненные резины, стойкие к воздействию радиации, обладающие высокими диэлектрическими свойствами.
Плазмотехнические технологии. Классификация. Примеры.
При сильном нагревании любого вещества наступает термическая ионизация, когда молекулы газа начинают разлагаться на составляющие их атомы, которые затем превращаются в ионы. Таким образом, плазма — это частично или полностью ионизированный газ, содержащий заряженные частицы (свободные электроны и газовые ионы).
Температура является мощным фактором интенсификации химических процессов, поэтому можно ожидать, что в будущем, по мере совершенствования техники получения высоких температур, плазменные процессы будут находить широкое практическое применение.
Плазму условно разделяют на низкотемпературную (Т=103— 105 К) и высокотемпературную (Т= 106—108 К).
Свойства высокотемпературной плазмы в настоящее время интенсивно исследуются, а промышленные методы ее получения только разрабатываются. Методы получения низкотемпературной плазмы достаточно разработаны, такая плазма уже используется в промышленности для получения отдельных химических продуктов.
Плазменные реакторы, в которых осуществляются химические процессы, состоят из трех основных элементов; плазмотрона, реактора и закалочного устройства.
В плазмотроне образуется плазма, т. е. поток ионизированного газа (Аr, Не, N2 и др.) при высокой температуре, с помощью дугового, высокочастотного или другого способа. Плазма пени ионизации водорода от направляется в реактор, куда подают также исходные реагенты. Из реактора реакционная смесь направляется в закалочное устройство, в котором обеспечивается настолько быстрое охлаждение смеси (ее закалка), что целевая реакция не успевает пройти в обратном направлении, т. е. в сторону образования исходных реагентов.


Высокие скорости плазмохимических процессов (их продолжительность составляет 10-2—10-5 с) позволяют уменьшить размеры промышленной аппаратуры. Например, для осуществления плазмохимического пиролиза метана плазменный реактор производительностью 25000 т/год должен иметь диаметр 15 см и длину 65 см.
Плазмохимические процессы легко управляемы; они хорошо моделируются и оптимизируются. В промышленном и полупромышленном масштабах реализованы многие плазмохимические процессы: получение ацетилена и технического водорода из природного газа; получение ацетилена, этилена и водорода из углеводородов нефти; производство синтез-газа для получения винилхлорида; получение пигментной двуокиси титана и других продуктов химической промышленности.
Рассмотрим в качестве примера плазменный метод получения азотной кислоты на основе атмосферного азота.
Существующие методы производства азотной кислоты окислением аммиака являются громоздкими и связаны с затратой природного газа ценного углеводородного сырья, мировые запасы которого ограничены. Между тем окружающий нас воздух содержит азот и кислород, из которых состоит молекула окиси азота. Поэтому процесс получения окиси азота из воздуха с последующей переработкой ее в азотную кислоту давно привлекает внимание исследователей.
Степень окисления азота по реакции
![]()
может достигать достаточной для практических целей величины при температуре выше 3000 К.
Для промышленных целей важное значение имеет скорость достижения равновесия, так как этим определяется интенсивность процесса. Для рассматриваемой реакции эта скорость резко возрастает при увеличении температуры.
Одна из возможных схем получения окиси азота следующая. Атмосферный воздух, сжатый в компрессоре, подогревается в теплообменнике до 1500—1700 К и поступает в плазменную печь. Полученный нитрозный газ при 3000—3300 К проходит далее в смеситель, где смешивается с циркулирующим нитрозным газом, охлаждается до 1700—1900 К и далее поступает в теплообменник. Здесь газ отдает тепло поступающему воздуху, охлаждается до 1100 К и затем подается в газовую турбину. Часть газа после турбины идет на абсорбцию, а остальное количество компрессором подается в систему в качестве циркуляционного газа.
При получении окиси азота из аммиака общие затраты энергии на производство аммиака и окиси азота составляют около 8 МВт*ч*т-1. Ожидается, что при прямом синтезе окиси азота под давлением 3 МПа, затраты энергии будут также около 8 МВт*ч*т-1, что позволяет сравнивать этот метод с аммиачным. Однако, есть все основания ожидать, что при дальнейшем усовершенствовании метод прямого синтеза будет экономичнее аммиачного за счет более полного использования тепла отходящих газов и интенсификации процесса (при температуре выше 3000 К реакция протекает практически мгновенно).
Радиационно-химические технологии. Классификация. Примеры.
При воздействии на вещества ионизирующих излучений высоких энергий происходят различные химические превращения. Использование этого явления для совершенствования ХТП имеет большое практическое значение, так как в технике получения мощных излучений за последние годы имеются существенные достижения и эта область усиленно развивается. Таким образом, есть все основания ожидать, что радиационно-химические процессы имеют большое будущее.
Ионизирующей способностью обладают как электромагнитные излучения (рентгеновские лучи, γ-лучи и др.), так и заряженные частицы (электроны, протоны и др.).
Процессы, протекающие при облучении вещества, разделяются на три основные стадии. На первой, физической, стадии происходит столкновение заряженной частицы с молекулами вещества, в результате чего химическая энергия частицы передается молекулам, что приводит к изменению их энергетического состояния. При этом возникает большое число «активированных» молекул, нестабильных в состоянии возбуждения.
Вторая стадия состоит в распадении возбужденных (нестабильных) молекул либо во взаимодействии их с другими молекулами. В результате образуются ионы, атомы и радикалы, т. е. промежуточные активные частицы.
На третьей стадии, образовавшиеся активные частицы вступают в химическое взаимодействие с другими окружающими молекулами или друг с другом с образованием конечных химических продуктов.
Реакции активных частиц с молекулами отличаются от реакции невозбужденных молекул друг с другом. Для того чтобы невозбужденные молекулы вступили во взаимодействие, им необходимо сообщить некоторую избыточную энергию ε (энергию активации), что достигается, например, повышением температуры. Реакции радикалов с молекулами требуют преодоления относительно небольшого энергетического барьера (20—40 кДж-моль-1). В результате этого радиационно-химические реакции протекают с большой скоростью даже при низкой температуре; в отличие от обычных химических реакций скорость радиационных процессов мало зависит от температуры.
Радиационно-химический процесс характеризуется радиационным выходом G, равным числу превратившихся (или образовавшихся) молекул вещества на 100 эВ поглощенной энергии. Для обычных реакций выход G составляет от 1 до 20 молекул. При этом энергия расходуется непосредственно на осуществление процесса взаимодействия. Такие процессы имеют ограниченное применение, поскольку требуют больших затрат энергии. В цепных радиационно-химических процессах электромагнитное излучение играет роль инициатора, поэтому радиационный коэффициент достигает большой величины (G — 103—106). Среди процессов, в которых излучение инициирует протекание не цепных реакций, практическое осуществление нашли радиационно-химические процессы сшивания отдельных макромолекул при облучения высокомолекулярных соединений. Так, например, в результате сшивания полиэтилена повышается его термостойкость и прочность, а для каучука обеспечивается его вулканизация. На этой основе разработано радиационно-химическое производство упрочненных и термостойких полимерных пленок, труб, кабельной изоляции, процесс вулканизации резино-технических изделий и др.
К числу интенсивно излучаемых и практически осуществляемых цепных радиационно-химические процессов относятся различные процессы полимеризации, а также синтеза ряда низкомолекулярных соединений. Важное практическое значение приобрели радиационные методы отверждения связующих (полиэфиры и др.); в производстве стеклопластиков и при нанесении лакокрасочных покрытий на металлические, деревянные и пластмассовые изделия. Большой интерес представляют также радиационно-химические процессы модифицирования простых материалов (древесины, бетона, торфа и т. д.) путем пропитки их мономерами (метилметакрилатом, стиролом и др.) и последующей поляризацией этих мономеров с помощью γ-излучения.
Для разработки и внедрения в промышленность экономичных радиационно-химических процессов возникла радиационно-химическая технология, а также радиационно-химическое аппаратуростроение, в разработку теоретических основ которых вложен огромный труд советских ученых.
Биохимические процессы. Классификация. Примеры. Биотехнология.
В природе под воздействием микроорганизмов, а также в присутствии различных природных катализаторов протекают всевозможные биохимические процессы, многие из которых еще до сих пор не изучены и которые не удается воспроизвести в искусственных условиях. Характерным для биохимических процессов является то, что многие из них протекают при атмосферных условиях с очень высоким коэффициентом полезного действия.
В микробиологии - науке о деятельности микроорганизмов - недавно возникло новое направление - техническая микробиология, в которой рассматривается химическое поведение микробов и возможность использования их деятельности в химической промышленности и в различных отраслях техники.
Сейчас техническая микробиология только начинает развиваться, но уже с самого начала перед ней открываются огромные возможности, которые трудно переоценить. С помощью микроорганизмов можно с большой экономией труда и средств производить самые разнообразные продукты. Продуктивность микробиологического синтеза не зависит от географического размещения предприятия, от почвы и климатических условий. Все процессы протекают с минимальным расходом энергии при атмосферном давлении и комнатной температуре. Применение микроорганизмов удешевляет и упрощает производство.
Расчеты показывают, что при воспроизведении лабораторных экспериментов в промышленных условиях бактерии способны в течение нескольких десятков дней выдать «на-гора» несколько сот тысяч тонн продуктов.
За последние годы из стадии лабораторных исследований переданы производству микробиологические процессы, в том числе синтез антибиотиков, витамина B12, аминокислот, гормонов и других биологически активных веществ.
Сейчас в мире не хватает белковых продуктов, и одним из наиболее реальных путей восполнения этого является организация производства белков с помощью микроорганизмов. На основе исследований, проведенных учеными различных стран, были разработаны промышленные биохимические методы получения белка. В настоящее время работают заводы, выпускающие ценный кормовой продукт (используется на птицефабриках) из парафиновой фракции нефти, получаемый с помощью бактерий. На животноводческих фермах применяются биологические корма, содержащие более 15% микробного белка. Весьма перспективным сырьем для получения кормового белка является метан. В нашей стране, богатой природным газом, этот процесс представляет особенно большой интерес.
Области применения биохимических процессов в промышленности весьма разнообразны: от сбраживания углеводородов, получения спиртов и кислот — первого этапа технической микробиологии — до развитой микробиологической промышленности витаминов и ферментов, ферментативных катализаторов и др.
В последние годы стали известны бактериологические способы окисления серы до сернистого ангидрида и серной кислоты. Такие процессы уже находят практическое применение, например для очистки нефти и нефтепродуктов от серы. Бактерии перерабатывают присутствующую в нефтепродуктах серу в сернистый ангидрид, легко удаляемый затем из очищаемых продуктов.
Существуют также бактерии, способствующие восстановлению сернистого ангидрида, сульфатов и других серосодержащих продуктов до элементарной серы. Особый практический интерес представляют результаты промышленных опытов по бактериологическому превращению сернистых соединений, содержащихся в производственных сточных водах, в элементарную серу (в этом случае одновременно с получением серы достигается очистка, сточных вод), а также по разработке микробиологического выщелачивания металлов: алюминия, золота, кадмия, кобальта, меди, мышьяка, никеля, олова, рения, селена, титана, урана, цинка из минералов.
Еще несколько лет тому назад казалась фантастической даже сама идея применения микроорганизмов в качестве активных «производителей» металлов, А сегодня химическая деятельность этих «невидимых металлургов» начинает находить широкое применение.
Полнее всего разработан метод микробиологического выщелачивания меди из различных минералов, в которых медь соединена с серой. Медь вымывается из руды раствором, содержащим сульфат окиси железа, серную кислоту и тионовые бактерии. В результате деятельности бактерий и действия сульфата окиси железа, находящихся в растворе, руда выщелачивается, при этом образуются серная кислота и медный купорос, переходящий в раствор. Этот раствор поступает в цементационную установку, где находятся куски железа. Происходит обменная реакция и образуется сульфат закиси железа, а чистая медь выпадает в осадок.
На одном из рудников построена промышленная установка по бактериальной добыче меди. Бактериальный раствор, подаваемый по трубопроводу в скважину, окисляет металл, и он переходит в раствор, который откачивается на поверхность. Получаемый этим способом металл почти втрое дешевле меди, извлекаемой другими способами. Есть все основания ожидать, что будущее за биохимическим способом получения меди, который со временем позволит исключить доменные и медеплавильные печи.
Очень интересными являются результаты исследований по разработке метода повышения производительности истощаемых нефтяных скважин. В скважину вводится суспензионный раствор, в состав которого входят микроорганизмы и питательная смесь для них. Попав в подземное нефтяное озеро, бактерии начинают быстро размножаться. В результате их жизнедеятельности вырабатывается большое количество газов, повышается давление и скважина оживает.
Мир микробов пока еще изучен гораздо хуже мира животных и растений. Научный поиск полезных бактерий, в сущности, только начинается. Одной из важнейших проблем ближайшего будущего является поиск и направленное выделение микробов, обладающих высокой активностью.
