
- •Исходные положения для расчета реакторов
- •Реакторы идеального вытеснения
- •Реакторы идеального смешения непрерывного действия
- •Реакторы для проведения реакций между газом и твердым веществом (г-т) или жидкостью и твердым веществом (ж-т)
- •Реакторы для проведения реакций в системе газ–жидкость (г-ж) и жидкость–жидкость (ж-ж)
- •63 Технология производства аммиака. Фиксация атмосферного азота. Синтез, транспортировка и хранение аммиака.
УКлассификация технологических процессов: механические и химические технологии: - промышленность неорганических веществ; промышадность органических веществ (включая производство и переработку пищевых продуктов).
Технология делится на механическую и химическую.
Механическая технология изучает процессы, при которых изменяется форма, внешний вид или физические свойства материалов, а химическая технология рассматривает процессы изменения химического состава и свойств материалов. Исходя из этого, можно дать такое определение: химическая технология - наука о способах и процессах химической переработки сырья.
Указанное деление в значительной степени условно, так как при механической переработке материала часто меняются и его химические свойства. Так, например, некоторые металлы долгое время могут находиться на воздухе без заметного изменения. Однако, если их подвергнуть физическому воздействию и тонко измельчить, полученные металлические порошки самопроизвольно загораются на воздухе. Это объясняется тем, что с измельчением вещества увеличивается его поверхностная энергия, а следовательно, повышается химическая активность вещества.
Современное химическое производство включает большое число разнообразных физических и химических операций, которые тесно связаны между собой, поэтому химическая технология изучает совокупность физических и химических процессов и пути их осуществления в промышленном масштабе.
Химические производства можно разделить на две группы: на производства неорганических и органических веществ.
Промышленность неорганических веществ включает:
1) производства основных химических веществ (кислоты, щелочи, соли, удобрения и др.);
2) производство тонких неорганических продуктов (реактивы, редкие элементы, полупроводники, фармацевтические препараты и др.);
3) электрохимические производства (хлор, щелочи, кислород, водород и др.);
4) металлургия (черная, цветная, металлургия благородных и редких металлов и др.);
5) производство силикатов (стекло, цемент, керамика и др.);
6) производство минеральных красок и пигментов.
Промышленность органических веществ включает:
основной (тяжелый) органический синтез (спирты, кислоты, эфиры, переработка СН4, СО, Н2, СгН4 и др.);
производство полупродуктов и красителей;
тонкий органический синтез (фармацевтические препараты, кино-фотореактивы и др.);
производство высокомолекулярных веществ (пластические массы, искусственные и синтетические волокна, каучук и др.);
переработка горючих материалов (нефти, угля, сланцев и др.);
производство пищевых продуктов (сахар, жиры и др.).
Основные группы процессов химических произвадств: механические, гидродинамические, тепловые, диффузионные (массообменные), химические. Примеры.
Основные определения: производительность; интенсивностъ; расходные коэффициенты; степень превращения (конверсия); выход продукта; скорость реакции (процесса). Примеры.
Показателем, характеризующим эффективность работы машин, аппаратов, цехов и заводов в целом, служит производительность.
Производительность - это количество выработанного продукта или переработанного сырья в единицу времени:
П = В/t;
где П - производительность; В - количество продукта; t - время.
Производительность измеряется в килограммах в час (кг/ч), в тоннах в сутки (т/сут) или в кубических метрах в сутки (м3/сут) и т. д. Максимально возможная производительность, называется мощностью.
Для сравнения работы аппаратов и установок различного устройства и размеров, в которых протекают одни и те же химические процессы, используется понятие интенсивность.
Интенсивность - это производительность, отнесенная к. какой-либо величине, характеризующей размеры аппарата к его объему или сечению; она, например, может быть выражена в виде уравнения:
И = П/Vr = В/Vr*t
где Vr - объем аппарата (реактора).
Интенсивность может измеряться количеством продукта, получаемого в течение единицы времени с единицы объема аппарата, например (кг/ч*м3), или с единицы сечения аппарата (т/сут*м2) и т. д.
Расход сырья, воды, энергии и различных реагентов, отнесенный к единице целевого продукта, называют расходным коэффициентом:
β = Q/В
где Q - расход сырья, реагента и др.
Расходные коэффициенты выражают в тоннах на тонну (т/т),. кубических метрах на тонну (м/т), киловатт-часах на тонну (кВт*ч/т) и т. п.
Глубина протекания реакции, от которой зависит степень использования сырья и другие показатели химико-технологического процесса, характеризуется степенью превращения и выходом продукта, а для сложных реакций, кроме того, селективностью.
Степень превращения - это отношение количества реагента, вступившего в реакцию, к его исходному количеству.
Например, для простой необратимой реакции типа А R степень превращения выражается уравнением
XA = NA,0 – NA/ NA,0
где XA степень превращения реагента А;
NA,0; NА—количество исходного реагента А в начале и конце процесса.
Если реакция протекает без изменения объема, то
XА = СA,0 – CA/ CA,0
где СA,0; СА — концентрация исходного реагента А в начале и в конце процесса.
Выход продукта - это отношение количества полученного целевого продукта к его количеству, которое должно быть получено по стехиометрическому уравнению.
Селективностью называется отношение количества целевого продукта к общему количеству получаемых продуктов. Селективность характеризует процессы, в которых протекают сложные параллельные и последовательные реакции с получением нескольких продуктов, что часто встречается на практике
Скорость химической реакции определяется количеством прореагировавшего исходного вещества или количеством полученного целевого продукта в единицу времени в единице объема системы. Скорость реакции зависит от концентрации реагирующих веществ и температуры.
Технико - экономические показатели технологического процесса.
Для химической промышленности, как отрасли крупномасштабного материального производства, имеет значение не только технологии, но и тесно связанный с ней экономический аспект, от которого зависит нормальное функционирование и развитие производства. Этот аспект рассматривает экономика химической промышленности, т.е. наука, изучающая уровень использования всех видов ресурсов химического производства и разрабатывающая на основе его анализа наиболее эффективные пути и методы его организации и развития. Важнейшим критерием, характеризующим совершенство химического производства, является его экономическая эффективность. Она зависит от мощности технологических установок и от научно-технического уровня технологического процесса. Технико- экономический уровень производства определяется совокупностью технико-экономических показателей:
расходный коэффициент по сырью и энергии, выход готового продукта и степень превращения сырья,
селективность процесса, производительность, интенсивность работы аппарата, качество продукта,
себестоимость продукта. ТЭП зависят от ряда факторов, характеризующих состояние производства:
возраст предприятия (физический и моральный износ), техническое состояние оборудования, степень автоматизации производства, квалификация кадров, уровень организации труда, прогрессивность
используемой технологии. ТЭП отражает возможности предприятия выпускать продукцию заданного качества и в заданном количестве. Они являются критериями, позволяющими установить
экономическую целесообразность данного производства и его рентабельность. ТЭП используется для оценки текущего состояния производства, его планирования и обновления техники.
Расходным коэффициентом (РК) называется количество сырья или энергии каждого вида, затраченное на производства единицы массы или объема готовой продукции. По сырью расходный коэффициент (РК) выражается в т/т, нм3/нм3,, по энергии в кВт*ч/т, кВт*ч/ нм3.
Выход готового продукта определяется как отношение массы полученного продукта к массе сырья, затраченного на его производство. Для одностадийного процесса, протекающего по схеме А--В,
выход равен = mB/mA. Для многостадийного процесса А---- В---- Д суммарный выход равен
произведению выходов каждой стадии
ηЕ = η А* ηВ *ηС
Степенью превращения сырья называется отношение массы сырья, вступившего в химическое превращение за время к исходной массе
Ха = ma0 – ma /ma0
ma -количество сырья, не вступившего в реакцию превращения за определенное время.
Выход продукта и степень превращения выражаются в долях единиц или %.
Селективностью называется отношение массы целевого продукта к общей массе продуктов, полученных в данном производстве или к массе превращенного сырья за время τ. Селективность характеризует преобладание одного из направлений процесса, превращение сырья приводит к образованию нескольких конечных продуктов. Выход продукта, степень превращения сырья и селективность характеризуют глубину протекания химического процесса, его полноту и направленность в сторону образования целевого продукта.
Производительностью называется количество произведенного целевого продукта или переработанного для его получения сырья в единицу времени
П = m/ τ
m- количество продукта, произведенного за определенное время.
Производительность выражается в кг/ч, нм3/сутки, т/год.
Интенсивностью аппарата называется его производительность, отнесенная к единице величины, характеризующей размеры рабочей части аппарата, его реакционный объем или площади сечения.
И = П/V или И = П/S
Интенсивность – критерий эффективности работы аппарата. Выражается в кг/м3 или кг/м3.
Качеством продукта называется совокупность технических, эксплуатационных, экономических и др. свойств, обуславливающих его пригодность для удовлетворения производственных потребностей в соответствии с его назначением.
Сырье. Классификация сырья.
Химическая промышленность характеризуется высокой материалоемкостью производства. На 1 т готовой химической продукции расходуется, как правило, несколько тонн сырья и материалов, отсюда следует, что себестоимость химической продукции в значительной мере определяется качеством сырья, способами и стоимостью его получения и подготовки, расходами на перевозку. В химической промышленности затраты на сырье в себестоимости продукции составляют 60-70%, а в нефтехимической промышленности - более 70%.
От вида и качества сырья существенно зависит полнота использования производственных мощностей различных подотраслей химической промышленности, а также уровень производительности труда, продолжительность полезной работы оборудования, затраты труда на изготовление готовой продукции. Свойства сырья, содержание в нем полезных и вредных компонентов в значительной мере определяют применяемую технологию его обработки; от степени совершенства технологии в свою очередь зависит производительность труда.
Большая материалоемкость и крупнотоннажность химического производства обусловливают соответственно и высокие капиталовложения в химическую промышленность, поэтому выбор и подготовка сырьевых баз, технико-экономические показатели сырья являются важными условиями рационального размещения и эффективного развития химической промышленности.
Классификация сырья
Виды сырья весьма разнообразны, их можно разделить на следующие группы: минеральное сырье, растительное и животное сырье. В качестве сырья в ряде процессов используются воздух и вода.
Минеральное сырье - это полезные ископаемые, добываемые из земных недр; их делят на рудное, нерудное и горючее минеральное сырье.
Рудное сырье - это горные породы, из которых экономически выгодно получать металлы. При переработке некоторых видов рудного сырья наряду с металлами получают и химические продукты. Так, например, одновременно с медью, цинком, никелем при переработке сульфидных руд получают и серную кислоту.
Нерудное сырье - горные породы, используемые в производстве химических, строительных и других неметаллических материалов. К этому виду сырья относятся породы, содержащие серу, фосфаты, природные калийные соли, поваренную соль, песок, гравий, глины и др. Это сырье используется в производстве удобрений, солей, кислот, щелочей, цемента, стекла, керамических изделий и др.
Горючее минеральное сырье включает угли, нефть, торф, горючие сланцы, природный и попутный газы и др., служащие источником получения разнообразнейших продуктов. Так, при переработке угля получают сырье для производства красителей, лекарственных препаратов, химических волокон, пластических масс, удобрений и т. п.
Нефть - углеводородное сырье для получения различных видов топлив (бензина, керосина и др.), а также всевозможных синтетических материалов (волокон, каучуков, пластических масс, моющих средств и др.).
Природный газ является дешевым и весьма ценным сырьем. Он служит сырьем для получения продуктов тяжелого органического синтеза, удобрений, пластических масс, синтетических каучуков, химических волокон, фармацевтических препаратов, лаков и др.
Растительное и животное сырье подразделяется на пищевое и техническое. К пищевому сырью относятся продукты сельского, лесного и рыбного хозяйства, которые используются для пищевых целей (картофель, сахарная свекла, хлебные злаки, пищевые жиры и т. п.). Химическая и другие отрасли промышленности потребляют техническое растительное и животное сырье, непригодное для пищевых целей, которое, однако, может быть переработано в продукты или материалы бытового и промышленного потребления. К этому виду сырья относятся хлопок, солома, лен, конопля, китовый и тресковый жиры, кости животных и др.
Воздух и вода являются самым дешевым и доступным сырьем. Воздух - практически неисчерпаемый источник дешевого азота и кислорода. Вода не только служит источником непосредственного получения из нее водорода и кислорода, но и участвует в разнообразных химических процессах, а также применяется для растворения твердых, жидких и газообразных веществ.
Сырьевые ресурсы. Замена пищевого сырья непищевым, растительного минеральным.
Экономический потенциал любой страны в современных условиях в большой степени определяется природными ресурсами полезных ископаемых, масштабами и качественной характеристикой их месторождений, а также уровнем развития сырьевых отраслей промышленности.
Сырьевые ресурсы современной химической промышленности очень разнообразны, причем с развитием техники, организацией новых производств и внедрением более эффективных методов производства сырьевая база отрасли постоянно расширяется за счет открытия новых месторождений, освоения новых видов сырья и более полного использования всех его компонентов.
По степени экономической эффективности использования запасы минерального сырья делятся на две группы балансовые и забалансовые. К балансовым относятся запасы полезных ископаемых, которые по своему качеству соответствуют требованиям промышленности и по условиям залегания могут быть добыты и переработаны в настоящее время экономически эффективными способами. Запасы сырья, характеризующиеся низким содержанием полезного вещества, присутствием неблагоприятных сопутствующих компонентов и сложными условиями залегания, вследствие чего они при современном состоянии техники и экономикн. не могут эффективно эксплуатироваться, относятся к забалансовым. Забалансовые запасы подлежат отдельному учету и представляют интерес как объект перспективного промышленного освоения.
От степени изученности месторождений запасы полезных ископаемых подразделяются на категории А, В и С.
В категорию А включаются детально разведанные, опробованные и подготовленные для эксплуатации запасы. Данные о запасах по категории А служат для обоснования производственного планирования объема добычи.
По категории В учитывают установленные геологоразведочными работами, запасы сырья, качество которых проверено лишь лабораторными исследованиями. Данные о запасах категории В используются для разработки проектных заданий.
К категории С относятся запасы, определяемые на основе геологического изучения по естественным обнаружениям и по данным геофизической разведки с частичным опробованием качества сырья. Сведения о запасах по категории С являются предварительными и служат для обоснования перспективных планов развития промышленности н ассигнований на последующие геологоразведочные работы.
Сумма запасов по категориям А + В + С образует промышленные запасы. На их основе производится расчет обеспеченности планируемого производства. данной химической продукции запасами сырья. При определении этой обеспеченности в основном принимают во внимание балансовые запасы промышленных, категорий с учетом наличия в них необходимого количества полезных ископаемых категорий А и В.
Рациональное и комплексное использование сырья.
Рациональное использование сырья позволяет повысить экономическую эффективность производства, так как стоимость сырья составляет основную долю в себестоимости химической продукции. В связи с этим стремятся использовать возможно более дешевое сырье, особенно местное сырье, для которого не требуются дальние перевозки. Например, в качестве углеводородного сырья все шире применяют нефть и природный газ, относительная стоимость которых значительно ниже стоимости угля. Этим объясняются существенно более высокие темпы добычи нефти и газа по сравнению с углем:
При выборе источника сырья необходимо также учитывать современные и перспективные условия его получения, в том числе и местные условия. Так, например, этиловый спирт можно получать из пищевого сырья, древесины (гидролизный спирт), из отходов целлюлозного производства (сульфитный спирт) и синтетическим способом. Себестоимость гидролизного спирта ниже себестоимости пищевого спирта на 40%, а сульфитного и синтетического на 75%. Трудовые затраты на производство 1 т спирта из зерна и картофеля составляют 160-280 чел/ч, а из нефтехимического сырья 10 чел/ч. Удельные капитальные вложения при замене пищевого сырья синтетическим снижаются на 400 руб/т годовой мощности.
Экономическая обоснованность выбора сырьевой базы для химического производства особенно наглядна в азотной промышленности. С переходом на использование природного газа снизилась себестоимость аммиака по сравнению с ранее использовавшимися видами сырья. Существенное значение выбора рационального вида сырья можно проследить также на примере производства синтетического каучука. Раньше (до пятидесятых годов) сырьем для получения СК служил этиловый спирт, получаемый из пищевых продуктов (зерна, картофеля и др.). Стоимость его была высокой, а размеры выработки не всегда обеспечивали потребность.
Сырье, стоимость которого составляла 75-80% общих затрат на производство, определяло рентабельность промышленности синтетического каучука и уровень цен на этот важнейший продукт. Поэтому снижению расхода этилового спирта и его замене на более дешевое сырье в промышленности синтетического каучука всегда уделялось большое внимание. В настоящее время у нас и за рубежом основным сырьем для получения СК служит бутадиен. Например, в США удельный вес СК из бутадиена составляет 80%, в Канаде 75%.
Для выработки бутадиена в Советском Союзе в качестве исходного сырья широко используют бутан и этиловый спирт. В дальнейшем по мере развития нефтедобывающей промышленности и переработки нефти ресурсы бутана будут увеличиваться и доля его в сырьевом балансе будет постоянно возрастать. Это объясняется доступностью сырья, его низкой стоимостью и Относительно простой схемой переработки. В настоящее время на всех вновь строящихся заводах СК предусматривается получение бутадиена из бутана.
Комплексная переработка сырья имеет большое народнохозяйственное значение еще и потому, что при этом исключается накопление отходов, хранение или вывоз которых обычно сопряжены с дополнительными затратами. Например, водный раствор хлористого кальция, являющийся отходом в производстве соды, в настоящее время не используется, его заливают в огромные котло- ваны. Стоимость таких котлованов высока, так как они должны быть герметичными и исключать утечку хлористого кальция (попадая в почву, он вымывается подпочвенными водами и разносится на большие расстояния, отравляя все живое).
Отходом сернокислотных заводов является огарок, образующийся при обжиге колчедана. Огарок еще не нашел применения,
хотя в нем содержится около 50% железа, а также некоторое количество меди, цинка, золота, серебра и других ценных металлов.
Важное значение комплексной переработки природного сырья вытекает также из того, что содержание некоторых необходимых для промышленности веществ в земной коре очень мало. Так, на основе результатов специальных исследований были рассчитаны запасы различных простых веществ в земной коре на глубине до 16 км. В зависимости от запасов вещества могут быть расположены в последовательный ряд от большего содержания к меньшему.
Только для нескольких элементов имеется соответствие между запасами и потреблением. Однако для углерода, например, этого соответствия нет, углерод по потребности находится на первом месте, а по запасам только на одиннадцатом, его в земной коре только 0,35%. Соответствия нет и для серы, а Сu, Pb, Mn, Zn в приведенном ряде запасов вообще отсутствуют (Сu занимает 26, a Zn — 24 место). Перечисленные элементы составляют 99,5% земной коры, а остальные элементы только 0,5% земной коры.
В качестве примера комплексной переработки сырья можно привести переработку апатитовой руды.
Обогащение сырья.
Применение концентрированного сырья упрощает и удешевляет его переработку, а также позволяет получать продукты более высокого качества. Потребляемое в химической промышленности сырье обычно недостаточно концентрированное, поэтому перед употреблением его в большинстве случаев обогащают, в результате чего концентрация в нем основного вещества увеличивается.
Обогащение полезных ископаемых, как правило, сложный и дорогостоящий процесс. Однако, несмотря на дополнительные затраты, связанные с обогащением, оно обеспечивает значительный народнохозяйственный эффект, определяемый: возможностью расширения сырьевой базы и обеспечения современного многотоннажного производства химической продукции за счет комплексного использования сырья и вовлечения в эксплуатацию бедных по содержанию полезных минералов и руд; более полным использованием оборудования на химических предприятиях за счет переработки высококонцентрированного обогащенного сырья; существенным улучшением качества готовой химической продукции и значительной экономией транспортных средств вследствие уменьшения перевозок, приходящихся на долю пустой породы.
Если обогащению подвергают твердые материалы (например, горные породы), то полученный обогащенный продукт называют концентратом, а отходы с меньшим содержанием полезного продукта и повышенным содержанием породы называют хвостами. В тех случаях, когда в сырье содержится несколько полезных составляющих, его делят на отдельные части (фракции), обогащенные тем или иным компонентом, т. е. из сложного сырья получают несколько концентратов, что позволяет более полно (комплексно) использовать сырье.
Методы обогащения твердых материалов весьма разнообразны, они основаны на различии физических и химических свойств веществ, входящих в состав сырья, например, прочности, плотности, твердости, растворимости, температур плавления и возгонки, магнитной проницаемости и др.
Рассеивание (грохочение) основано на том, что минералы, входящие в состав сырья, имеют различную прочность, поэтому при дроблении менее прочные (хрупкие) минералы Дробятся на более мелкие зерна, чем прочные (вязкие) материалы. Если после измельчения такое сырье просеять через сита с отверстия различного размера, то можно получить фракции, обогащенные тем или иным минералом.
Гравитационное разделение основано на различии скоростей осаждения (падения) частиц в жидкости или газе в зависимости от плотности или крупности этих частиц. Если осаждение производят в жидкости (чаще всего в воде), его называют мокрым гравитационным обогащением; если осаждение ведут в газе (чаще всего в воздухе), его называют сухим гравитационным обогащением.
Магнитная сепарация применяется для отделения магнитно восприимчивых материалов от немагнитных, а также для удаления стальных предметов, случайно попавших в руду; магнитный железняк от пустой породы.
Флотационный метод обогащения основан на различной смачиваемости зерен отдельных минералов водой. Частицы несмачиваемого (гидрофобного) минерала не преодолевают силы поверхностного натяжения воды и остаются на ее поверхности. Частички смачиваемого (гидрофильного) материала обволакиваются пленкой жидкости и опускаются на дно аппарата. Несмачиваемый минерал снимают с поверхности жидкости, отделяя от руды.
Для проведения флотации применяют технологические приемы, в частности создают условия неодинаковой смачиваемости водой зерен минералов.
Природные минералы в большинстве случаев хорошо смачиваются водой, поэтому для их разделения флотацией в суспензию вводятся специальные реагенты собиратели, снижающие смачиваемость отдельных природных минералов.
В тех случаях, когда необходимо, наоборот, затруднить всплывание частиц отдельных минералов, в суспензию вводят подавители (щелочи, соли щелочных металлов и др.). Эти вещества увеличивают гидрофильность частиц минералов, что затрудняет их всплывание и способствует осаждению частиц на дно.
Флотационный метод обогащения получил широкое промышленное применение благодаря тому, что применение различных флотореагентов, добавляемых в малых количествах (100 г на 1 т породы), позволило обогащать и разделять на фракции самое разнообразное (практически любое) сырье.
Жидкие растворы различных веществ концентрируют упариванием растворителя, вымораживанием, выделением примесей в осадок или в газовую фазу. Так, например, упариванием воды из растворов получают минеральные соли, щелочи, кислоты и др., а путем вымораживания обычно концентрируют природные рассолы в зимнее время.
Газовые смеси разделяют на компоненты последовательной конденсацией, т. е. переводят их в жидкое состояние при постепенном понижении температуры и сжатии. Этот метод основан на различии температур конденсации компонентов газовой смеси. В других случаях вначале газовую смесь превращают в жидкость, а затем последовательным испарением ее разделяют на индивидуальные компоненты.
Разделение газовых смесей осуществляют также поглощением отдельных газов жидкостями (абсорбция) или твердыми веществами (адсорбция) с последующим выделением их из сорбентов в концентрированном виде.
Методы концентрирования жидких растворов и разделение газовых смесей широко применяются в настоящее время в химической промышленности.
Вода в промышленности. Виды и качество потребляемой воды.
Вода широко используется в химической промышленности, редким исключением являются процессы, в которых не участвует вода. В одних случаях вода служит сырьем и реагентом, непосредственно участвующим в основных химических реакциях, а в других вода употребляется как растворитель, теплоноситель или охладитель, а также для других самых разнообразных физических операций.
В перспективе природная вода может использоваться как источник промышленного сырья. В воде морей и океанов содержатся почти все элементарные вещества периодической системы элементов, но в небольших количествах. Так, например, в воде содержится в виде различных солей.
Если учесть, что общая масса воды на земном шаре велика и составляет 1,4*1018 т, то содержание различных веществ в воде выражается внушительными цифрами.
Основным источником промышленного водоснабжения в нашей стране являются речные воды. Однако территориальное распределение их крайне неравномерно.
В районах с дефицитным водоснабжением уже сейчас для нормальной эксплуатации и расширения многих химических предприятий и комплексов требуется проводить весьма сложные и дорогостоящие мероприятия по регулированию и переброске стока на большие расстояния и использовать подземные воды. Все это сопряжено со значительными дополнительными материальными и денежными затратами и в связи с этим с ухудшением технико-экономических показателей производства химической продукции.
Развитие химической промышленности вызывает огромный рост потребности в воде (современные химические предприятия расходуют большое количество воды, измеряемое миллионами кубических метров в сутки).
Так, например, современный завод капронового волокна расходует столько же воды, сколько потребляет ее город с населением 120 тыс. человек. Специализированный завод пластмасс, включающий производство мономеров, по потреблению воды эквивалентен городу с населением 400 тыс. человек. Мощный современный электрохимический комбинат по производству продуктов хлор органического синтеза потребляет столько же воды, сколько город с населением 800 тыс. человек. Наряду с этим химические предприятия сбрасывают большие количества сильно загрязненных вод.
Таким образом, рациональное комплексное использование водных ресурсов в условиях быстро развивающейся химической промышленности и других отраслей народного хозяйства становится крупной технологической, технической и экономической задачей.
Технологический аспект в решении водной проблемы заключается в новом подходе к разработке технологической схемы. Рациональное водопотребление должно быть обязательным в каждом технологическом процессе. Необходимы создание процессов, требующих минимальных расходов свежей воды, разработка научно обоснованных норм ее расхода в химических производствах и совершенствование технологических процессов в направлении возможно полного использования отходов производства, что снизит потребность в очистных сооружениях. Насколько это важно, можно судить по тому, что в настоящее время затраты на строительство очистных сооружений составляют примерно 20% стоимости химических предприятий.
В зависимости от назначения потребляемая вода условно подразделяется на промышленную и питьевую; в каждой из них содержание примесей регламентируется соответствующим ГОСТ.
Питьевая вода в первую очередь освобождается от бактерий; к ней предъявляются особые требования в отношении вкуса, цвета, запаха.
Промышленные воды не должны содержать примесей больше допустимой нормы, которая устанавливается в зависимости от производства, на котором используется вода. Вода для прямоточных паровых котлов не должна содержать двуокись углерода и кислород, вызывающих коррозионное разрушение труб, и может содержать не более 0,2-0,3 мг/л сухого остатка. Соли в паровых котлах, отлагаясь на внутренней поверхности труб в виде накипи, снижают теплопроводность металла; происходит перегрев труб и преждевременный их износ.
Повышенные требования в отношении чистоты предъявляются к воде в производстве полупроводников, люминофоров и некоторых других материалов.
Качество воды характеризуется следующими показателями: жесткостью, общим солесодержанием, прозрачностью, окисляемостью и реакцией воды.
Жесткость воды - различают временную, постоянную и общую жесткость. Временная (устранимая) жесткость обусловлена наличием в воде бикарбонатов кальция и магния. Эти соли сравнительно легко удаляются из воды при кипячении, так как при этом они переходят в нерастворимые углекислые соли и выпадают в виде плотного осадка:
(Са, Mg) (НСО3) —> (Са, Mg)C03 + Н20 + С02
Постоянная жесткость воды обусловлена присутствием в воде хлоридов, сульфатов, нитратов кальция и магния. Эти соли при кипячении не удаляются из воды.
Сумма временной и постоянной жесткости дает общую жесткость, измеряемую в миллиграмм*эквивалентах ионов кальция или магния, содержащихся в виде солей в 1 л воды. Жесткость воды равна единице, если в 1 л ее содержится 1 мг*экв ионов кальция, что соответствует 20,04 мг кальция или 12,16 кг магния.
По жесткости (в мг*экв/л) природные воды подразделяют на очень мягкую (0-1,5), мягкую (1,5-3), среднюю (3-6), жесткую (6-10) и очень жесткую (более 10).
Общее солесодержание, или сухой остаток - масса вещества, остающаяся после испарения воды и высушивания полученного остатка при 105-110 °С. Сухой остаток измеряется в миллиграммах на 1 л воды (мг/л).
Прозрачность воды измеряется толщиной слоя воды, через который можно различать визуально или с помощью фотоэлемента изображение креста или определенного шрифта.
Окисляемость воды определяется числом миллиграммов перманганата калия, израсходованного при кипячении 1 л воды с избытком КМnO4 в течение 10 мин.
Реакция воды, т. е. ее кислотность или щелочность, характеризуется концентрацией водородных ионов или величиной рН. При рН = 6,5-7,5 вода считается нейтральной, при рН < 6,5 воду называют кислой, при рН > 7,5 - щелочной.
Очистка воды.
В поступающей воде содержатся самые разнообразные примеси: грубодисперсные и коллоидные частицы различные силикаты, гидратированная кремниевая кислота, в ней также растворены газы и соли: бикарбонаты, сульфаты, хлориды, нитраты кальция, магния, калия, натрия и др. Очистка воды включает следующие операции: осветление, обеззараживание, умягчение, дегазацию и дистилляцию.
Осветление воды производится с целью удаления механических примесей, оно достигается отстаиванием воды в бетонированных резервуарах большой емкости (отстойниках) с последующим фильтрованием на песчаных фильтрах. Для осаждения коллоидных примесей в отстойники вводят коагулянты - сульфаты железа или алюминия.
Коагулянты гидролизуются в воде с образованием аморфных осадков гидроокисей железа или алюминия, которые адсорбируют коллоидные примеси и увлекают их на дно резервуара. В конечном счете реакция протекает по уравнению:
Al2(S04)3 + 6Н20 = 3H2S04 + 2A1(0H)3
Гидроокись алюминия образуется также при взаимодействии сульфата алюминия с присутствующими в воде бикарбонатами кальция и магния:
AI2(SO,)3 + ЗСа(НС03)2 = 3CaSO4 + 6С02 + 2А1(ОН)3
Таким образом, одновременно с удалением коллоидных примесей снижается и содержание солей временной жесткости.
Обеззараживание воды - удаление из нее микроорганизмов и бактерий путем хлорирования, озонирования или кипячения.
В настоящее время для хлорирования воды используют хлор, гипохлорит кальция и др. При обработке воды гипохлоритом кальция протекает реакция6
Са(СlO)2 + С02 + Н20 = СаС03 + 2НС1O
НС1O = HCl + O
Атомарный кислород обладает сильными окислительными свойствами, поэтому убивает микроорганизмы и окисляет органические примеси.
В последние годы обеззараживание питьевой воды производят преимущественно с помощью озона, который получают путем воздействия тихого электрического разряда на воздух или на воздух, обогащенный кислородом. При обработке воды озон разлагается с выделением атомарного кислорода.
При обработке воды хлором вода приобретает запах хлора, при озонировании запах отсутствует, что является существенным достоинством метода.
Вода обеззараживается также обработкой ионами серебра и при воздействии ультрафиолетовых лучей и ультразвуковых колебаний.
Умягчение воды состоит в полном или частичном удалении из нее солей кальция и магния. Если из воды удаляются также катионы и анионы, т. е. удаляются все содержащиеся в ней соли, этот процесс называют обессоливанием воды. Умягчение и обессоливание воды являются основными процессами подготовки воды.
Способы умягчения подразделяются на физические, химические и физико-химические.
Физические способы предусматривают термическую обработку воды, или кипячение, дистилляцию и вымораживание. Химические способы умягчения воды заключаются в обработке ее растворами химических соединений. Наибольшее промышленное применение получили известково-содовый и фосфатный способы умягчения.
Известково-содовый способ заключается в обработке воды сначала известковым молоком, а затем содой, при этом кальциевые соли превращаются в нерастворимый карбонат кальция, магниевые соли в гидроокись и карбонат магния:
Са(НС03)2 + Са(ОН)2 = 2Н2О + 2СаС03
Mg(HC03) + 2Са(ОН)3 = Mg(OH)2 + 2Н2О + СаС03
СаС12 + Na2C03 = 2NaCl + СаС03
MgS04 + 2Na2C03 = Na2S04 + MgC03
Известково-содовый способ является наиболее распространенным и дешевым, но при этом достигается лишь сравнительно грубое умягчение воды (примерно до 0,3 мг*экв/л).
Фосфатный способ состоит в обработке воды фосфатом натрия:
3Са(НС03)2 + 2Na3P04 = 6NaHC03 + Ca3(P04)2
3СаС12 + 2Na3P04 = 6NaCl + Са3(Р04)2
Растворимость фосфатов кальция и магния в воде ничтожно мала, это определяет высокую эффективность фосфатного способа (содержание солей снижается примерно до 0,03 мг*экв/л).
Фосфатный способ достаточно дорогой способ умягчения, поэтому применяется главным образом в комбинированных схемах, в которых основная масса солеи удаляется из воды известковым молоком или содой, а доумягчение осуществляется с помощью фосфатов.
Из физико-химических способов наиболее широкое практическое применение находят ионообменные способы, основанные на свойстве некоторых труднорастворимых твердых веществ, так называемых ионитов, обменивать свои ионы на ионы солей, растворенных в воде.
Иониты подразделяются на катиониты и аниониты. Катиониты содержат подвижные катионы натрия или водорода и соответственно называются Na-катионитами и Н-катионитами. Аниониты содержат подвижную гидро- ксильную группу (ОН-анионита- ми).
В качестве Na-катионитов применяются алюмосиликаты: глауконит, цеолит, пермутит и др.; в качестве Н-катионитов применяются сульфированный уголь и другие вещества; к ОН-анионитам относятся искусственные смолы сложного состава, например карбамидные.
Процессы очистки воды способом ионного обмена можно представить следующим образом.
Катионный обмен с использованием алюмосиликата состава Na20 • А1203 • 2Si02 • Н20 протекает по уравнению:
Na20[Kaт] + СаС12 = СаО[Кат] + 2МаС1
где [Кат] — неучаствующая в обмене часть молекулы (Na20 • А1203 • 2Si02 • Н20).
В случае применения Н-катионита процесс протекает следующим образом:
Н2[Кат] + CaS04 = Са[Кат] + H2S04
Н2[Кат] +Са(НС03)2 = Са[Кат] + 2Н20 + 2С02=
С течением времени катиониты истощаются, их регенерируют промывкой раствором NaCl или кислотой.
Анионный обмен можно представить в виде
2[Ah]ОH + H2S04 = [Ah]2S04 + 2Н20
Для регенерации анионита его промывают щелочью:
[Ah]2S04 + 2NaOH = Na2S04 + 2[Ан]ОН
К преимуществам ионитового способа по сравнению с известково-содовым относятся компактность и простота аппаратурного оформления, более глубокое умягчение воды (до 0,035 + +0,07 мг-экв-л-1), простота обслуживания и контроля и самое основное дешевизна.
Дегазация - удаление из воды растворенных газов производится химическим и физическим способами. При химическом способе газы взаимодействуют с химическими соединениями и удаляются из воды. Например, двуокись углерода удаляют из воды при пропускании через фильтр, заполненный гашеной известью, либо добавляют к воде известковое молоко. В обоих случаях образующийся СаС03 выпадает в осадок.
Для удаления кислорода воду пропускают через фильтр, заполненный железными опилками или стружками; кислород взаимодействует с железом, образующаяся нерастворимая в воде окись железа выпадает в осадок.
Физические способы удаления газов заключаются в аэрации или нагревании воды в вакууме.
Полная очистка воды (обессоливание), а также дегазация и обезвреживание воды достигаются ее перегонкой, т. е. дистилляцией.
Понятие жесткости воды. Способы умягчения воды.
Жесткость воды - различают временную, постоянную и общую жесткость. Временная (устранимая) жесткость обусловлена наличием в воде бикарбонатов кальция и магния. Эти соли сравнительно легко удаляются из воды при кипячении, так как при этом они переходят в нерастворимые углекислые соли и выпадают в виде плотного осадка
(Са, Mg) (НСО3)→ (Са, Mg)CО3 + Н2О + СО2
Постоянная жесткость воды обусловлена присутствием в воде хлоридов, сульфатов, нитратов кальция и магния. Эти соли при кипячении не удаляются из воды.
Сумма временной и постоянной жесткости дает общую жесткость, измеряемую в миллиграмм-эквивалентах ионов кальция или магния, содержащихся в виде солей в 1 л воды. Жесткость воды равна единице, если в 1 л ее содержится 1 мг-экв ионов кальция, что соответствует 20,04 мг кальция или 12,16 кг магния.
По жесткости (в мг-экв •л-1) природные воды подразделяют на очень мягкую (0—1,5), мягкую (1,5—3), среднюю (3—6), жесткую (6—10) и очень жесткую (более 10).
Умягчение воды состоит в полном или частичном удалении из нее солей кальция и магния. Если из воды удаляются также катионы и анионы, т. е. удаляются все содержащиеся в ней соли, этот процесс называют обессоливанием воды. Умягчение и обессоливание воды являются основными процессами подготовки воды.
Способы умягчения подразделяются на физические, химические и физико-химические.
Физические способы предусматривают термическую обработку воды, или кипячение, дистилляцию и вымораживание. Химические способы умягчения воды заключаются в обработке ее растворами химических соединений. Наибольшее промышленное применение получили известково-содовый и фосфатный способы умягчения.
Известково-содовый способ заключается в обработке воды сначала известковым молоком, а затем содой, при этом кальциевые соли превращаются в нерастворимый карбонат кальция, магниевые соли в гидроокись и карбонат магния:
Са(НС03)2 + Са(ОН)2 = 2Н2О + 2СаС03
Mg(HC03) + 2Са(ОН)3 = Mg(OH)2 + 2Н2О + СаС03
СаС12 + Na2C03 = 2NaCl + СаС03
MgS04 + 2Na2C03 = Na2S04 + MgC03
Известково-содовый способ является наиболее распространенным и дешевым, но при этом достигается лишь сравнительно грубое умягчение воды (примерно до 0,3 мг*экв/л).
Фосфатный способ состоит в обработке воды фосфатом натрия:
3Са(НС03)2 + 2Na3P04 = 6NaHC03 + Ca3(P04)2
3СаС12 + 2Na3P04 = 6NaCl + Са3(Р04)2
Растворимость фосфатов кальция и магния в воде ничтожно мала, это определяет высокую эффективность фосфатного способа (содержание солей снижается примерно до 0,03 мг*экв/л).
Фосфатный способ достаточно дорогой способ умягчения, поэтому применяется главным образом в комбинированных схемах, в которых основная масса солеи удаляется из воды известковым молоком или содой, а доумягчение осуществляется с помощью фосфатов.
Из физико-химических способов наиболее широкое практическое применение находят ионообменные способы, основанные на свойстве некоторых труднорастворимых твердых веществ, так называемых ионитов, обменивать свои ионы на ионы солей, растворенных в воде.
Иониты подразделяются на катиониты и аниониты. Катиониты содержат подвижные катионы натрия или водорода и соответственно называются Na-катионитами и Н-катионитами. Аниониты содержат подвижную гидро- ксильную группу (ОН-анионита- ми).
В качестве Na-катионитов применяются алюмосиликаты: глауконит, цеолит, пермутит и др.; в качестве Н-катионитов применяются сульфированный уголь и другие вещества; к ОН-анионитам относятся искусственные смолы сложного состава, например карбамидные.
Процессы очистки воды способом ионного обмена можно представить следующим образом.
Катионный обмен с использованием алюмосиликата состава Na20 • А1203 • 2Si02 • Н20 протекает по уравнению:
Na20[Kaт] + СаС12 = СаО[Кат] + 2МаС1
где [Кат] — неучаствующая в обмене часть молекулы (Na20 • А1203 • 2Si02 • Н20).
В случае применения Н-катионита процесс протекает следующим образом:
Н2[Кат] + CaS04 = Са[Кат] + H2S04
Н2[Кат] +Са(НС03)2 = Са[Кат] + 2Н20 + 2С02=
С течением времени катиониты истощаются, их регенерируют промывкой раствором NaCl или кислотой.
Анионный обмен можно представить в виде
2[Ah]ОH + H2S04 = [Ah]2S04 + 2Н20
Для регенерации анионита его промывают щелочью:
[Ah]2S04 + 2NaOH = Na2S04 + 2[Ан]ОН
К преимуществам ионитового способа по сравнению с известково-содовым относятся компактность и простота аппаратурного оформления, более глубокое умягчение воды (до 0,035 + +0,07 мг-экв-л-1), простота обслуживания и контроля и самое основное дешевизна.
Энергия. Виды энергии.
Все химические процессы протекают с изменением энергии; выделением или ее поглощением, поэтому при оформлении химико - технологического процесса должно быть предусмотрено использование выделяющейся энергии для повышения экономичности процесса или подвод энергии, необходимой для осуществления данного процесса. Значительная доля энергии затрачивается на проведение различных вспомогательных операций; транспортирование материалов, их дробление или фильтрование, сжатие газов и др.
В химической промышленности применяются разнообразные виды энергии: электрическая, тепловая, ядерная энергия, химическая и энергия света. •
Электрическая энергия применяется прежде всего для приведения в движение электродвигателей, широко используемых при проведении различных физических операций: дробления, смешения, перекачивания (насосы, вентиляторы, компрессоры) и т. п. Электрическая энергия расходуется также для проведения электрохимических и электромагнитных процессов.
Электрическую энергию производят гидроэлектростанции, тепловые и атомные электростанции. В последнее время успешно ведутся работы по непосредственному превращению тепловой энергии в электрическую.
Тепловая энергия в химической промышленности применяется, во-первых, для осуществления разнообразных физических процессов, не сопровождающихся химическими реакциями: плавление, сушка, выпаривание, дистилляция и др., во-вторых, для нагревания реагентов при проведении химических реакций.
Источником тепловой энергии обычно служит разнообразное топливо, при сжигании которого образуются топочные газы. Эти газы могут быть непосредственно использованы в качестве теплоносителей или же для получения водяного пара, перегретой воды и других теплоносителей. Для получения тепла используется также электрическая энергия.
Атомная энергия применяется для производства электрической энергии на атомных электростанциях.
Химическая энергия выделяется обычно в виде тепла при проведении разнообразных экзотермических реакций. Использование этой энергии имеет большое практическое значение, особенно в производстве многотоннажных химических продуктов. Тепло, выделяющееся при протекании химического процесса, может быть использовано для получения водяного пара или превращено в электроэнергию. Химическая энергия преобразуется в энергию электрическую также в гальванических элементах и аккумуляторах. Эти источники энергии представляют большой интерес, так как они обладают высоким коэффициентом полезного действия.
Световая энергия находит все более широкое применение в химической промышленности для проведения разнообразных фотохимических реакций: синтеза хлористого водорода из элементарных веществ, при галоидировании органических соединений и Других процессов.
Вторичные энергетические ресурсы представляют собой энергетические отходы или побочные продукты производства: отходящие газы, горячие жидкости, пар и др. Полноценное использование этого вида энергии имеет большое экономическое значение, так как влияет на снижение себестоимости готовой продукции.
Источники энергии.
Химическая промышленность является одной из самых энергоемких отраслей индустрии. Хотя производимая продукция составляет 5,7% общего объема производства промышленной продукции, количество потребляемой в химической промышленности электроэнергии равно примерно 12%.
Ценность различных источников энергии определяется ее количеством, которое может быть получено при использовании этих источников.
Для снабжения химической промышленности энергией могут быть использованы различные энергетические установки. Так, тепловую энергию в виде пара и горячей воды можно получать от ТЭЦ или котельных установок, электрическую энергию от конденсационных тепловых электростанций (КЭС), гидростанций (ГЭС), а также от ТЭЦ и атомных электростанций (АЭС).
В целом химическая промышленность потребляет за год тепловой энергии (в эквиваленте) больше, чем электрической. Подсчитано, что более 90% всех потребляемых энергоресурсов в химическом производстве получают сжиганием различных видов топлива (углей, природного газа, мазута, торфа, горючих сланцев) и около 10% приходится на долю гидроэнергии. Все это характеризует химическую промышленность с энергетической точки зрения как отрасль, которой необходимы в первую очередь источники дешевого топлива.
В целях наиболее экономного использования топлива для промышленных и других нужд в стране все шире осуществляется централизованное теплоснабжение как предприятий, так и городов, причем ведущая роль в этом принадлежит теплофикации, т. е. отпуску тепла в виде пара или горячей воды от теплоэлектроцентралей.
Большое значение для химической промышленности имеет природный газ, поскольку он может быть использован не только для энергетических нужд, но и в качестве сырья для получения самых разнообразных продуктов.
Экономические показатели производства электроэнергии зависят от типа электростанции (тепловые, гидравлические, атомные), их мощности и района размещения. На тепловых электростанциях себестоимость электрической и тепловой энергии в основном зависит от затрат на топливо, составляющих 60-70% всех издержек производства. Себестоимость электроэнергии на твердом топливе значительно выше, чем на газообразном; соответствующие удельные капитальные вложения в электростанции и топливную базу примерно в 1,4 раза больше.
В развитии энергетики в последние годы произошли коренные изменения, направленные на дальнейшее ускорение технического прогресса в этой отрасли. В теплоэнергетике начато строительство крупных электростанций с блоками большой единичной мощности. Расчеты показывают, что сооружение электростанций, оснащенных блоками по 800 МВт, обеспечивает по сравнению с 300-тысячными блоками экономию капитальных вложений в размере около 10%, удельный расход топлива уменьшается на 3-4%, а удельная численность эксплуатационного персонала почти в 3 раза.
Мировые запасы урана и тория обладают энергией, превосходящей во много раз потенциальную энергию разведанных запасов угля, нефти и природного газа вместе взятых. Поэтому чрезвычайно важное значение имеет использование атомной энергии в промышленных целях.
За годы, прошедшие со времени пуска в опытную эксплуатацию первой в мире атомной электростанции (АЭС) в г. Обнинске под Москвой (июнь 1954 г.), были сооружены и вошли в эксплуатацию ряд крупных атомных электростанций мощностью до 1 млн. кВт.
Так как источники топлива на базе углерода ограничены, использование атомной энергии стало ключевой проблемой для большинства стран.
Источники химической энергии (выделяющейся в виде тепла при протекании реакции) приобретают большое практическое значение в химической промышленности. В последние годы создаются энерготехнологические химические производства, в которых одновременно с химическими продуктами получают товарную энергию, выдаваемую потребителям в виде энергетического пара или электроэнергии. При этом вся потребность в энергии самого химического производства полностью покрывается за счет использования энергии химических реакций. Например, при получении 1 т серной кислоты из серы выделяется 5 МДж тепла, а общая потребность в электроэнергии в процессе получения 1 т серной кислоты составляет около 100 кВ*ч или 0,36 МДж, т. е. всего лишь около 7% выделяющегося тепла химических процессов. В настоящее время уже освоены такие энерготехнологические системы при производстве серной кислоты, аммиака и др.
В дальнейшем большое значение приобретут такие источники энергии, как солнечная, энергия ветра, приливов и отливов, тепла земных недр.
Рациональное использование энергии. Принцип организации энергосберегающих технологий и проблемы минимизации водопотребления.
Химические предприятия потребляют большие количества энергии, поэтому энергетические затраты существенно влияют на технико-экономические показатели процессов. Критерием экономичного использования энергии служит коэффициент использования энергии ηэ, определяемый по уравнению:
ηэ = Wт/Wпр*100%
где Wт и Wпр соответственно количество энергии, затрачиваемое теоретически и практически на получение единицы продукта.
Во многих производствах этот коэффициент очень низкий, что свидетельствует о непроизводительном расходе энергии. Поэтому большое практическое значение имеют мероприятия, направленные на повышение ηэ.
Из всех видов потребляемой в химической промышленности энергии первое место принадлежит тепловой энергии. Степень использования тепла в химико-технологическом процессе определяется тепловым коэффициентом полезного действия η, выражаемым уравнением:
ηэ = Qт/Qnp*100%
где Qт и Qnp — соответственно количество тепла, теоретически н практически затрачиваемое на осуществление химической реакции.
Использование вторичных энергетических ресурсов (отходов) повышает коэффициент использования энергии. Энергетические отходы могут быть использованы в химической и других отраслях промышленности для выработки электрической и тепловой энергии в утилизационных установках; отработанный пар и горячая вода обычно расходуются непосредственно (без преобразования в другие энергоносители) для отопления и горячего водоснабжения.
Особенно большое значение в химической промышленности имеет утилизация тепла продуктов реакции, выходящих из реакционных аппаратов, для предварительного нагревания материалов, поступающих в эти же аппараты. Такой нагрев осуществляют в аппаратах, называемых регенераторами, рекуператорами, теплообменниками. Реагенты поступают в теплообменник, где нагреваются за счет тепла горячих продуктов, выходящих из реакционного аппарата, и затем подаются в реактор. По этой схеме теплообмен между горячими и холодными продуктами происходит через стенки трубок теплообменника, аппараты такого типа называют рекуператорами (теплообменниками).
Регенераторы также применяются для утилизации тепла газов; они представляют собой периодически действующие камеры, заполненные насадкой (обычно насадкой служат решетки из кирпича). Для создания непрерывного процесса необходимо иметь по крайней мере два регенератора. При организации такой периодической работы регенераторов обеспечивается постоянный подогрев холодного газа за счет тепла отходящего горячего газа.
Тепло газообразных продуктов реакции и отходящих газов часто используют для производства пара в так называемых котлах утилизаторах.
Тепло отходящих продуктов на химических заводах может быть также использовано для сушки, выпаривания, дистилляции и других процессов.
Топливо. Топливно - энергетическая проблема
Методы переработки твердого топлива.
Методы переработки жидких топлив.
Экологические аспекты технологических процессов. Примеры.
Утилизация и обезвреживание твердых отходов. Реакторы биологической очистки.
Обезвреживание сточных вод и отходящих газов.
Обезвреживание сточных вод. Производственные и бытовые сточные воды загрязнены различными органическими и неорганическими примесями, которые при сливе в водоемы отравляют их. Существует законодательство предусматривающее строгую санитарную охрану естественных водоемов, поэтому спуск промышленных сточных вод в водоемы производится в соответствии с санитарными правилами, в которых определено предельно допустимое содержание веществ в сточных водах.
Если концентрация примесей в сточных водах превышает предельно допустимое содержание, такие воды подвергают специальной очистке. При этом содержащиеся в воде примеси либо разрушаются, либо переходят в безвредную форму, либо их извлекают для последующего использования в качестве сырья.
Многие отечественные химические комбинаты имеют очистные установки, на которых достигается настолько высокая степень очистки сточной воды, что ее можно вновь возвратить в производство. В результате создается замкнутый цикл по воде, свежая вода поступает в процесс только в таком количестве, чтобы восполнить ее потери, неизбежные при любом производстве.
Очистка сточных вод химических предприятий и последующее их использование является крупной народнохозяйственной проблемой. Поскольку количество промышленных сточных вод все время растет, чистая вода превращается в один из дефицитных видов природных богатств, особенно в районах, где широко развита химическая промышленность.
Создание надежных способов очистки загрязненных промышленных стоков является весьма сложной проблемой и далека от решения многих производств. Основное направление работ по существенному улучшению очистки промышленных сточных вод является сооружение очистных сооружений на каждом промышленном предприятии, что позволит резко уменьшить или даже полностью ликвидировать сброс сточных вод после их очистки в реки и озера.
Внедрение оборотного цикла водоснабжения, замкнутой системы водопотребления с минимальным добавлением свежей воды является одним из наиболее рациональных направлений использования воды в промышленности. Отработанная вода после очистки и извлечения из нее полезных веществ должна возвращаться на предприятие для повторного использования.
Таким образом, внедрение системы водооборота в химических производствах может привести не только к резкому уменьшению вредных для водоемов сточных вод, но позволит усовершенствовать технологию производства, улучшить технико-экономические показатели.
Способы обезвреживания сточных вод подразделяются на механические, физико-химические, химические и биологические.
Механические способы включают отстаивание и фильтрацию; эти способы используются для удаления взвешенных частиц; к физико-химическим способам относятся аэрация, адсорбция, экстракция, выделение примесей в осадок и др.; химические способы основаны на разрушении вредных примесей, их нейтрализации, осаждении различными реагентами и др.; биологические способы обезвреживания применяются, главным образом, для очистки сточных вод населенных пунктов с помощью некоторых микроорганизмов.
Вода, применяемая в качестве хладоагента, обычно не изменяется по составу, а только нагревается, поэтому после использования такую воду охлаждают в специальных водоемах или в градирнях, а затем возвращают обратно на производство (оборотная вода).
В последние годы особенно остро поставлена проблема обезвреживания сточных вод, так как одновременно с развитием промышленности возрастает и объем сточных вод. При этом в отдельных случаях сильно загрязненные сточные воды, попадая в реки, губят все живое и создают антисанитарные условия жизни.
Кроме работ по очистке производственных сточных вод, большое значение имеют проводимые в химической промышленности мероприятия по замене водяного охлаждения воздушным. Его широкое внедрение позволит отказаться от эксплуатации многих водооборотных циклов и существенно снизить расход свежей воды. Созданы и разрабатываются проекты многих других химических производств с использованием воздушного охлаждения.
Обезвреживание отходящих газов. Содержание вредных примесей в отходящих газах должно быть таким, чтобы после смешения этих газов с атмосферным воздухом концентрация вредных примесей в приземном слое воздуха не превышала предельно допустимой концентрации (ПДК).
Отходящие газы обычно выводятся в атмосферу через трубы, по выходе из которой эти газы смешиваются с атмосферным воздухом и концентрация вредных примесей в воздухе становится более низкой, чем в отходящих газах. Естественно, что чем выше труба, тем больше будут разбавлены отходящие газы воздухом и соответственно, тем ниже будет концентрация вредных примесей в приземном слое воздуха.
Если высота трубы слишком большая и, следовательно, очень дорогая, отходящие газы подвергают специальной очистке, а затем уже выводят в атмосферу через трубу соответствующей высоты.
Таким образом, выбор пути достижения ПДК определяется экономическими соображениями - ПДК должны быть обеспечены при минимальных затратах, что достигается либо установкой достаточно высокой трубы, либо специальной очисткой отходящих газов.
Однако технико-экономический анализ и опыт эксплуатации показывают, что в большинстве случаев наиболее экономичный путь состоит в том, чтобы основной технологический процесс проводился при условиях, обеспечивающих низкое содержание вредных примесей в отходящих газах. При этом отпадает необходимость в специальной очистке отходящих газов. Способы очистки зависят от состава, свойств и концентрации вредных примесей в отходящих газах. Эти способы весьма разнообразны, наиболее часто применяется абсорбция и адсорбция примесей различными реагентами и адсорбентами.
Технические условия, отраслевые, государственные международные стандарты. Примеры.
Физико-химические закономерности технологических процессов.
Классификация химических реакций: простые, сложные. Вероятность протекания химических реакций. Селективность процесса.
Цепные и ступенчатые реакции. Цепные разветвленные и не разветвленные. Примеры. Способы регулирования скоростей и конверсии в цепных реакциях.
Модели цепных процессов. Примеры. Ступенчатые реакции. Поликондесационное равновесие. Способы регулирования скоростей н конверсия ступенчатых реакций. Примеры.
Кинетика химико - технологических процессов. Понятие о порядке реакций. Прямые и обратные реакций. Равновесие в технологических процессах. Примеры.
Понятие о микро и макрокинетике.
Процессы, протекающие в жидкостях и в газах, обычно рассматриваются с двух точек зрения процесс взаимодействия отдельных молекул на микроуровне и процесс взаимодействия агрегатов молекул - на макроуровне.
В системе на микроуровне жидкость представляет собой свободные индивидуальные молекулы, движущиеся в различных направлениях, сталкивающиеся и смешивающиеся со всеми другими молекулами данной жидкости; в системе на макроуровне жидкость представляет собой совокупность большого числа небольших глобул, т. е. групп молекул, как бы заключенных в оболочку. Предполагается, что эта внешняя оболочка химически инертна и единственное назначение ее состоит в том, чтобы сохранить условно Снятую индивидуальность каждой глобулы.
Весьма условно потоки жидкости в микро- и макро состоянии показаны на рис. Особенности микро- и макро состояния можно также проследить при смешении жидкостей: чем выше вязкость смешивающихся жидкостей, тем ярче проявляются в ней признаки макро состояния. В качестве примера представим себе сосуд с мешалкой, в котором весьма интенсивно перемешивается
Поток идеализированных жидкостей в микро- и макро состояниях:
1 — жидкость в микро состоянии; 2—жидкость в макро состоянии.
жидкость с малой вязкостью (вода). В эту жидкость вливают другую жидкость тоже малой вязкости (этиловый спирт). Эти жидкости хорошо перемешиваются и смесь быстро становится однородной; условно можно принять, что смешение происходит на микроуровне. Если в тот же сосуд вместо этилового спирта вливать очень вязкую жидкость (например, глицерин), а интенсивность перемешивания снизить (уменьшить частоту вращения мешалки), глицерин разобьется на отдельные капли (глобулы) и жидкость не скоро станет однородной. Условно можно принять, что смешение происходит на макроуровне. В микросостоянии жидкость не обладает никакими свойствами, обусловленными присутствием глобул молекул и, наоборот, свойства жидкости, находящейся в макросостоянии, в значительной степени определяются наличием глобул. Реальная смесь в той или иной степени проявляет промежуточные свойства, которые зависят от свойств жидкости и от системы, в которой происходит смешение. Все вопросы, изучаемые в курсе физической химии, химическое равновесие, кинетика химических реакций и др. рассматриваются на микроуровне, т. е. на уровне отдельных молекул. Такой подход позволяет проанализировать влияние различных факторов в идеализированных условиях. В промышленных условиях при оформлении подавляющего большинства химических процессов необходимо учитывать многие сопутствующие физические процессы, связанные с макро состоянием системы и накладывающиеся на основной химический процесс. Важнейшими из них являются: а) диффузия исходных реагентов в зону реакции и продуктов реакции из зоны реакции, б) выделение и распределение тепла. На оба эти процесса сильное влияние оказывают аэрогидродинамические условия (т. е. характер движения газа или жидкости), поскольку от них зависят конвективный перенос тепла и диффузия вещества.Таким образом, при изучении реального химико-технологического процесса необходимо учитывать влияние диффузии, теплопередачи и конвекции, т. е. процесс следует рассматривать на макроуровне.
Влияние различных факторов на скорость химических процессов, протекающих на микроуровне.
Факторы влияющие на состояние равновесия. Принципы Ле - Шателье.
Типы технологических процессов.
На практике чаще всего используется классификация химических реакций по фазовому признаку, соответственно различают гомогенные и гетерогенные реакции. По этому же признаку наиболее часто подразделяют химические процессы и реакторы, в которых эти процессы осуществляются.
В гомогенных системах все реагирующие вещества находятся водной какой-либо фазе: газовой (г), жидкой (ж) или твердой (т). В гетерогенных системах реагирующие вещества находятся в разных фазах: газ - жидкость (г - ж), газ - твердое (г - т), жидкость - твердое (ж - т), две несмешивающиеся жидкости (ж - ж) и две твердые фазы (т - т). Наиболее часто в промышленных процессах встречаются системы г - ж, г - т и ж - т. Иногда в промышленных процессах участвуют три или четыре фазы, например г - ж - т, г - ж - ж, г - ж - т - т.
Обычно за отдельные фазы принимают только основные компоненты и не учитывают наличие малых количеств примесей. Так, например, в системах ж - ж и ж - т часто содержится газовая фаза, поскольку процессы проводятся в присутствии воздуха или других газов, или же в присутствии паров, так как жидкие компоненты частично испаряются. Но газовую фазу учитывают только в том случае, если она оказывает существенное влияние на процесс.
Некоторые процессы начинаются в гомогенной среде, а затем в результате появления новой фазы система переходит в гетерогенную. Например, при получении полистирола к жидкому стиролу добавляют перекись бензоила и нагревают, при этом происходит полимеризация стирола с образованием новой фазы - твердого полистирола.
Скорость реакции в гомогенных системах более высокая, чем в гетерогенных, так как в первом случае реакции протекают на уровне отдельных молекул (так называемый микроуровень). Поэтому в практических условиях обычно стремятся перевести гетерогенный процесс в гомогенный (путем плавления или растворения твердых реагирующих веществ, абсорбции или конденсации газов).
Гомогенные процессы. Скорость гомогенных процессов.
Строго гомогенные процессы, т. е. процессы, протекающие в одной фазе, встречаются в промышленности сравнительно редко, так как любое вещество содержит следы различных примесей, находящихся в другой фазе. Например, в 1 мл чистого горного возду содержится около 1000 взвешенных частиц, а в 1 мл дистиллированной воды до 20000 частиц. Поскольку следы инородных примесей часто активно влияют на ход процесса как катализаторы или ингибиторы, большинство процессов лишь условно можно отнести к гомогенным.
Число таких условно гомогенных процессов велико в технологии и неорганических, и органических веществ. Например, окисление сероводорода и паров серы кислородом воздуха в производстве серной кислоты
2H2S + ЗО2 = 2S02 + 2Н2О + Q
S + 02= 802 + Q
протекает в гомогенной газовой фазе, несмотря на наличие в воздухе большого числа твердых частиц. К числу гомогенных процессов относят также окисление окиси азота до двуокиси азота кислородом воздуха в производстве азотной кислоты и многие другие.
2NO + О2 = 2N02 + Q
Особенно многочисленны и разнообразны гомогенные процессы в газовой фазе, осуществляемые в технологии органических веществ. Примером этому может служить сжигание всевозможных видов газообразного топлива и, в частности, природного газа. Процесс сжигания различного жидкого топлива также в большинстве случаев является гомогенным процессом, так как всякое жидкое топливо предварительно испаряется, а образовавшиеся пары затем окисляются кислородом воздуха.
В технологии органических веществ сущность многих гомогенных процессов в газовой фазе состоит в том, что газообразные исходные вещества или пары, полученные испарением жидкости, обрабатываются тем или иным газообразным компонентом: хлором, сернистым ангидридом, окислами азота и др., при этом обычно протекают параллельные и последовательные реакции.
Например, при термическом воздействии хлора на метан при 250-400 °С получают ряд соединений:
СН4 + Сl2 = НСl + CH3Cl (хлористый метил)
СН3С1 + Сl2 = НС1 + CH2Cl2 (хлористый метилен)
СН2С12 + С12 = НС1 + СНСl3 (хлороформ)
СНС13 + Cl2 = НС1 + ССl4 (четыреххлористый углерод).
Из большого числа процессов, идущих в жидкой фазе, к гомогенным можно отнести процессы нейтрализации водных растворов кислот водными растворами щелочей. Например, при взаимодействии аммиачной воды и серной кислоты в коксохимическом производстве получают сульфат аммония
2NH4OH + H2S04 = (NH4)2S04 + 2Н20
К гомогенным реакциям относятся также некоторые обменные реакции, проходящие в растворах
KCl + NaN03 = NaCl + KNO3
В жидкой фазе получают простые и смешанные эфиры из спиртов, например при разложении этилсульфата метиловым спиртом:
C2H50S020H + СН3ОН = С2Н5ОСН3+ H2S04
В гомогенной среде осуществляют такой важный процесс, как получение адипиновой кислоты и многие другие.
3С6Н11ОН + 8HNO3 = 3С6Н10О4 + 7Н20 + 8NO
Скорость гомогенных процессов
Гомогенные процессы в большинстве случаев протекают в кинетической области, т. е. общая скорость процесса определяется скоростью химической реакции и подчиняется закономерностям, установленным для процессов, протекающих на микроуровне. Скорости гомогенных процессов, в основе которых лежат простые необратимые реакции первого и второго порядков (A→R и 2A→R) выражаются уравнениями:
dXA/dτn=1 = k(1-XA)
dXA/dτn=2 = kCA,0(1-XA)2
из которых следует, что для повышения скорости необходимо увеличивать значения k (путем повышения температуры или применения катализатора) и СА,0. Так как на практике в большинстве случаев гомогенные реакции являются сложными (параллельными или последовательными), то в зависимости от значения констант скоростей этих реакций концентрация продуктов реакций будет изменяться во времени различно. При этом, чем выше порядок реакции, тем большее влияние оказывает концентрация исходного реагента на скорость соответствующей реакции. Например, при наличии двух параллельных реакций первого и второго порядков увеличение С А, 0 в два раза изменяет соотношение скоростей этих реакций в 4 раза.
После интегрирования приведенных выше уравнений в пределах изменения ХА от 0 до ХА находим:
τn=1 = 2,3/k*lg*(1-XA,0)/1-XA
τn=2 = XA -XA,0/kCA,0(1-XA)*(1-XA,0)
Если XA,0 = 0, то
τn=1 = 2,3/k*lg*1/(1-XA,0)
τn=2 = XA,0/kCA,0(1-XA)
Полученные уравнения (а) - (г) позволяют определить время τ необходимое для достижения заданной конечной степени превращения ХА. Из этих уравнений следует, что константа скорости реакции первого порядка измеряется в ч-1, а реакции второго порядка - в м3 • кмоль-1 • ч-1.
Гомогенный процесс на макроуровне протекает в том случае, когда на химическую реакцию накладываются другие физические или физико-химические процессы. Например, при взаимодействии двух жидких исходных реагентов или их растворов скорость гомогенного процесса зависит от условий и скорости перемешивания жидкостей; если химическое взаимодействие протекает при подогреве, то скорость гомогенного процесса будет зависеть также от способа подвода тепла.
Гетерогенные процессы. Скорость гетерогенных процессов. Коэффициент скорости процесса.
Большинство химико-технологических процессов относятся к гетерогенным; при этом огромное разнообразие гетерогенных процессов затрудняет их классификацию.
Механизм гетерогенных процессов сложнее гомогенных, так как реагирующие вещества находятся в разных фазах и подвод их к поверхности раздела фаз, где происходит химическое взаимодействие, а также массообмен между фазами осуществляются в результате молекулярной и конвективной диффузии, которые накладываются на основной химический процесс. Усложнение вносят также процессы теплообмена и процессы, обусловленные особенностями гидродинамики потока. Только с учетом всех факторов, влияющих на технологический процесс, можно установить условия, обеспечивающие максимальную его интенсивность, и управлять этим процессом.
Примером гетерогенного процесса может служить процесс горения угля, который складывается из пяти стадий: внешняя диффузия 02 (через пограничный газовый слой); внутренняя диффузия 02 (через слой золы); химическая реакция; внутренняя диффузия СОг (через слой золы); внешняя диффузия СО2 (через пограничный слой газа).
Горение угля сравнительно простой пример; на практике обычно протекают более сложные процессы. Однако в любом гетерогенном химическом процессе можно выделить три основных одновременно протекающих процесса:
диффузия реагентов к границе раздела фаз;
химическая реакция;
диффузия продуктов реакции из зоны реакции.
Скорость гетерогенных процессов
Для установления оптимальных параметров гетерогенных процессов и их аппаратурного оформления и проектирования необходимо прежде всего изучить статику (т. е. равновесие) и кинетику (т. е. скорость) этих процессов.
Равновесие в гетерогенных системах зависит от температуры, давления и концентрации как исходных реагентов, так и продуктов реакции, скорость же взаимодействия реагентов, находящихся в разных фазах, зависит не только от скорости химической реакции, но и от многих других факторов (как любой процесс, протекающий на макроуровне). Поэтому в общем виде скорость гетерогенного процесса выражается следующим уравнением:
r = KF ∆С
где r - скорость гетерогенного процесса;
К - коэффициент скорости процесса;
F - поверхность контакта фаз;
∆С - движущая сила процесса.
Коэффициент скорости процесса
Коэффициент включает в себя многие факторы, влияющие на скорость гетерогенного процесса. В большинстве практических случаев влияние этих факторов неодинаково. Так, например, химический процесс обычно состоит из нескольких стадий, а его общая скорость определяется скоростью наиболее медленной (лимитирующей) стадии. Поэтому для интенсификации процесса необходимо прежде всего определить, какая из стадий является наиболее медленной, и ускорить ее. Такими наиболее медленными стадиями, каждая из которых может тормозить весь процесс, являются:
1 химическая реакция;
2 диффузия;
3 одновременно химическая реакция и диффузия.
В первом случае, скорость диффузии велика по сравнению со скоростью химической реакции; тогда говорят, что процесс протекает в кинетической области. Во втором случае, скорость химической реакции значительно больше скорости диффузии - процесс протекает в диффузионной области (во внешне или внутридиффузионной). В третьем случае, скорости отдельных стадий соизмеримы, тогда говорят, что процесс протекает в переходной (смешанной) области.
После установления лимитирующей стадии процесса принимают меры, обеспечивающие повышение скорости этой стадии. Так, если процесс протекает в кинетической области, создают условия, ускоряющие химическую реакцию; если процесс протекает в диффузионной области, то ускоряют процесс диффузии; если же процесс протекает в переходной области, то создают условия, повышающие и скорость химической реакции, и скорость диффузии. Для установления лимитирующей стадии процесса существует несколько приемов. Рассмотрим наиболее важные из них.
Температура оказывает сильное влияние на скорость химических реакций. Так при увеличении температуры на 10°С скорость химической реакции в некоторых случаях возрастает в 2—3 раза.
Скорость диффузии газов зависит от температуры в значительно меньшей степени, приближенно эта зависимость выражается уравнением:
D = аТ2
где D - коэффициент диффузии;
а - постоянный коэффициент.
Из уравнения следует, что при повышении температуры на 100С скорость диффузии увеличивается всего на 3-5%. Это разное влияние температуры используют для определения лимитирующей стадии процесса.
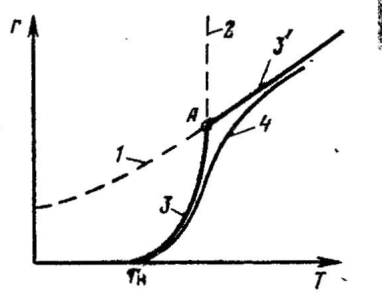
На рисунке кривая 1 отражает температурную зависимость скорости диффузии исходного реагента в зону реакции (rф). Кривая 2 отражает функциональную зависимость скорости химической реакции от температуры в соответствии с уравнением Аррениуса (rх.р.). Общая скорость отражена на рисунке двумя отрезками кривых 3 и 3'. Кривая 3 берет свое начало при температуре Тн, когда процесс химического взаимодействия начинает протекать с заметной скоростью. Затем наблюдается резкий подъем кривой. В точке А, где пересекаются кривые 1 и 2, скорость химической реакции и скорость диффузии равны rф = rх.р. = r. В дальнейшем величина r равна rф. Общая скорость процесса не может превышать самую низкую составляющую ее скорость rф ≥ r ≤ rх.р. Кривая 4 построена по опытным данным. Лимитирующая стадия гетерогенного процесса может быть установлена опытным путем. Так, если опыт показывает, что повышение температуры оказывает сильное влияние на скорость процесса, то процесс протекает в кинетической области (рис. III.3, область1). Если при дальнейшем повышении температуры ее влияние на скорость общего процесса уменьшается, значит процесс перешел в переходную область (рис. III.3, область2). Если же далее при повышении температуры общая скорость процесса практически не изменяется, значит процесс протекает в диффузионной области (рис. III. 3, область3).
Движущая сила процесса.
Движущая сила процесса выражается уравнением
∆С = Сп.ф - Са.р.
Где Сп.ф - концентрация исходного вещества в передающей фазе;
Са.р - концентрация исходного вещества в той же фазе в зоне реакции.
Из уравнения следует, что существуют два способа повышения ∆С: за счет увеличения Сп.ф и снижения Са.р.
Движущая сила процесса возрастает, если увеличить концентрацию исходных реагентов в передающей фазе (Сп.ф.) или повысить давление, а так же если выводить продукты реакции из сферы взаимодействия.
Увеличение давления является эффективным способом повышения ∆С, особенно для системы г - ж, так как в этом случае
∆С = рг - р*
где рг - парциальное давление исходного газообразного реагента в газовой фазе;
р* - равновесное давление исходного реагента у поверхности жидкости.
При повышении давления процесса рг увеличивается, а р* остается постоянным, следовательно, при увеличении давления растет также ∆С
![]()
Вывод продуктов из сферы реакции также является эффективным способом увеличения движущей силы и широко используется в самых разнообразных производств венных процессах. При выводе продуктов реакции из зоны реакции уменьшается объем реакционной смеси, а Сг (или рг) соответственно увеличивается.
Рост ∆С за счет снижения р* на практике осуществляется редко. Для систем г - ж это достигается путем уменьшения температуры так как одновременно понижается равновесное Давление вещества над жидкостью (р*). Однако практические возможности для использования этого приема ограничены, поскольку при понижении температуры сильно уменьшается константа скорости реакции (уравнение Аррениуса) и общая скорость процесса.
По мере протекания реакции концентрация Сг уменьшается, соответственно снижается движущая сила ∆С, а также уменьшается общая скорость процесса, поэтому на практике в целях поддержания высокой скорости процесса его ведут при достаточно большом значении ∆С, ограничивая время пребывания реакционной смеси в реакторе некоторым оптимальным значением τопт.
Каталитические процессы. Классификация.
Каталитические процессы в настоящее время составляют основу химической технологии, причем область их применения расширяется: около 90% новых производств, освоенных за последние годы химической промышленностью, основаны на взаимодействии, протекающем в присутствии катализаторов.
Под катализом понимают изменение скорости химических реакций под воздействием веществ - катализаторов, которые, участвуя в процессе, остаются после его окончания химически неизменными. Катализ называется положительным, если катализатор ускоряет реакции, и отрицательным, если скорость реакции под воздействием катализатора снижается.
Применение катализаторов облегчает практическое осуществление многих химических реакций; скорость некоторых из них увеличивается в тысячи и даже миллионы раз.. Очень многие промышленные процессы удалось осуществить только благодаря применению катализаторов.
К числу каталитических процессов относятся важнейшие крупнотоннажные производства, например такие, как получение водорода, аммиака, серной и азотной кислот и многих других важнейших химических продуктов. Особенно велико и разнообразно применение катализа в технологии органических веществ и в производстве высокомолекулярных соединений.
Отрицательный катализ применяется значительно реже: катализаторы, замедляющие скорость процесса называют также ингибиторами.
Катализаторами могут быть вещества, находящиеся в любом яз трех агрегатных состояний. К твердым катализаторам можно отнести металлы и их оксиды, например Fe при синтезе аммиака, Pt при окислении аммиака, V2O5 при окислении S02, AI2O3 при крекинге нефтепродуктов и др.
Жидкими катализаторами служат обычно кислоты и основания, например, H2S04 и Н3РО4 применяются при алкилировании ароматических углеводородов, при изомеризации н-бутилена в изобутилен и др.
Примером газообразных катализаторов может служить BF3 в процессах полимеразиции некоторых углеводородов.
Каталитические процессы можно разделить на две группы: гомогенные и гетерогенные. В гомогенно-каталитических реакциях реагирующие вещества и катализатор составляют одну фазу, а в гетерогенно-каталитических реакциях - разные фазы. В особую группу выделены микрогетерогенные и ферментативные каталитические процессы. Микрогетерогенный катализ происходит в жидкой фазе с участием коллоидных частиц металлов в качестве катализаторов. Ферментативный катализ наблюдается в биологических системах с участием сложных комплексов (часто белковой природы), называемых ферментами.
Учение о катализе представляет очень интересную и увлекательную область знаний, имеющую исключительно большое практическое значение. В настоящее время в мире проводятся очень широкие и глубокие исследования в области изучения каталитических процессов; этим заняты десятки тысяч ученых.
Общие закономерности каталитических процессов.
Каталитические реакции подчиняются общим законам химии и термодинамики, но имеют при этом свои особенности, так как в них всегда участвует один дополнительный компонент - катализатор. Действие катализаторов принципиально отличается от действия других факторов, способствующих интенсификации химических реакций, например, температуры, давления, радиационного воздействия и др. Повышение температуры может ускорять реакцию вследствие увеличения энергетического уровня реагирующих молекул, т. е. их активации за счет вводимого извне тепла. При этом изменяется внутренняя энергия системы и смещается положение равновесия. Катализатор же не влияет ни на равновесие химической реакции, ни на все другие термодинамические характеристики реакций. Изменяя в равной степени скорость прямой и обратной реакций, катализатор способствует повышению скорости достижения равновесия при данных условиях.
Теория каталитических процессов относится к числу сложных и недостаточно полно изученных областей современной физической Химии. В настоящее время еще нет общей теории, позволяющей предвидеть каталитическое действие различных веществ на ту или иную химическую реакцию. Существует несколько теорий, объясняющих механизм действия катализаторов, из которых наиболее распространенной теорией, служащей основой современных представлений о катализе, является теория промежуточных соединений.
Согласно этой теории, медленную реакцию между исходными веществами можно заменить двумя или несколькими более быстрыми реакциями' с участием катализатора, который образует с исходными веществами промежуточные непрочные соединения. Ускоряющее действие катализатора состоит в понижении энергии активации реакций образующихся промежуточных соединений, что оказывает очень сильное влияние на скорость реакции, поскольку в уравнение Аррениуса:
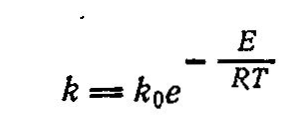
энергия активации Е входит в показатель степени.
При практическом применении большое значение имеет технологическая характеристика промышленных катализаторов (активность, температура зажигания, производительность, селективность, отравляемость, прочность и др.).
Наиболее важной характеристикой катализаторов является их активность, т. е. мера ускоряющего действия катализатора по отношению к данной реакции. Активность определяется уравнением:
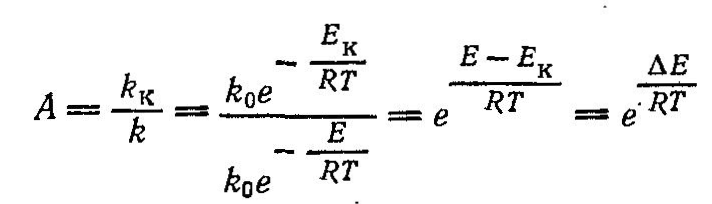
где А - активность катализатора;
k, kk - константы скорости реакцнн без катализатора и в присутствии катализатора;
∆Е - снижение энергии активации под действием катализатора:
![]()
Е, ЕК - энергия активации реакции без катализатора и в присутствии катализатора.
Температурой зажигания катализатора называют минимальную температуру реагирующей смеси, при которой процесс начинает протекать с достаточной для практических целей скоростью. Чем активнее катализатор, тем ниже температура зажигания, что особенно важно при проведении экзотермических обратимых реакций, так как при этом соответственно повышается степень превращения.
Отравление катализатора - это частичная или полная потеря его активности в результате действия посторонних примесей контактных ядов. Отравление может быть обратимым и необратимым. При обратимом отравлении примеси снижают активность катализатора временно, пока они присутствуют в зоне катализа; по удалении ядов катализатор восстанавливает свою прежнюю активность. При необратимом отравлении активность катализатора не восстанавливается и после удаления контактных ядов из зоны реакции.
Активность твердого катализатора может снижаться также вследствие уменьшения активной поверхности катализатора под воздействием, например, высоких температур, при осаждении на поверхности катализатора продуктов реакции или пыли, механического разрушения катализатора и по многим другим причинам.
Важной особенностью катализаторов является их избирательность (селективность) по отношению к определенным реакциям. В сложных реакциях (параллельных и последовательных), где термодинамически возможно образование нескольких продуктов, катализатор позволяет ускорить только одну целевую реакцию; естественно, что это имеет большое практическое значение.
Для сложной реакции типа
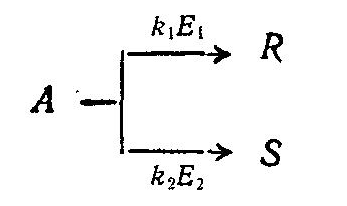
селективность выражается уравнением:
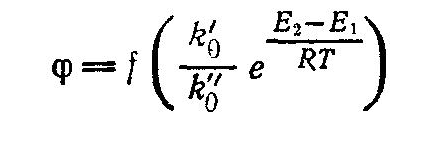
Из этого уравнения видно, что при некоторой заданной температуре Т путем подбора соответствующего катализатора можно изменять разность Е2 – Е1 и, таким образом, создавать возможности для получения только или главным образом целевого продукта.
Особенно сильно селективность проявляется в сложных органических реакциях. Следовательно, применяя соответствующий катализатор, из одного и того же сырья можно получить различные целевые продукты.В присутствии катализатора обычно снижается порядок реакции, причем, чем активнее катализатор, тем этот эффект сказывается сильнее, т. е. тем ниже порядок реакции. В связи с этим, кинетика каталитических реакций обычно описывается уравнениями, найденными эмпирически, и формальный порядок таких каталитических реакций будет выражаться как в виде целого, так и дробного числа. В гомогенно-каталитических реакциях скорость процесса зависит от концентрации не только реагирующих веществ, но и катализатора. Основным недостатком гомогенного катализа является трудность выделения катализатора из конечной продукционной смеси, в результате чего часть катализатора теряется, а целевой продукт загрязняется. Однако в последнее время ведутся обширные исследования в области высокоактивных катализаторов гомогенного катализа, которые, присутствуя в малых дозах, вызывают цепные реакции. Поскольку количество вводимого катализатора невелико, после реакции он не извлекается из реакционной смеси, а остается в целевом продукте, не снижая качества получаемого целевого продукта.
Большой интерес к гомогенному катализу объясняется главным образом тем, что при подборе соответствующих катализаторов интенсивность гомогенных процессов очень высока. Это объясняется тем, что гомогенные реакции протекают на микроуровне (на уровне отдельных молекул), когда вероятность столкновения молекул реагирующих веществ с молекулами катализатора весьма значительная.
Гетерогенный катализ.
Большинство известных промышленных каталитических реакций - это реакции между газообразными реагентами на твердых катализаторах. Изменение реакционного пути происходит в этом случае благодаря образованию промежуточных непрочных продуктов взаимодействия реагирующих веществ с катализатором.
В общем случае процесс гетерогенного катализа на твердых пористых катализаторах складывается из нескольких элементарных стадий (рис):

1 внешняя диффузия реагирующих веществ из ядра потока к поверхности зерен катализатора (через пограничный слой газа);
2 внутренняя диффузия реагентов в порах зерна катализатора;
3 активированная адсорбция веществ на поверхности катализатора с образованием поверхностных непрочных химических соединений активированных комплексов;
4 перегруппировка атомов с образованием поверхностных комплексов продукт - катализатор;
5 десорбция продукта с поверхности;
6 внутренняя диффузия продукта в порах зерна катализатора;
7 внешняя диффузия продукта реакции от поверхности зерна катализатора в ядро потока (через пограничный слой газа).
В отличие от некаталитического гетерогенного процесса, протекающего в системе г-т, в данном случае появляются дополнительные промежуточные стадии, в частности, активированная адсорбция молекул исходных веществ на поверхности катализатора (стадия III). При этом желательно, чтобы твердые катализаторы имели большую легко доступную поверхность, что достигается уменьшением размера зерен и увеличением их пористости. В ряде случаев внутренняя поверхность таких катализаторов достигает десятков и даже сотен квадратных метров на 1 см3 катализатора. При наличии пористого катализатора реакция протекает как на внешней, так и на внутренней поверхности гранул катализатора. Часто внутренняя поверхность в тысячи раз превышает внешнюю поверхность, в этом случае влияние последней на процесс невелико. Так как при гетерогенном катализе процесс протекает главным образом на внутренней поверхности катализатора, то для описания большинства каталитических процессов более подходит квазигомогенная модель, а не модель частицы с невзаимодействующим ядром
В настоящее время установлено, что не вся поверхность катализатора однородна, поэтому катализ осуществляется только на так называемых активных центрах.
Кинетика гетерогенно - каталитической реакции.
В общем случае, суммарное уравнение скорости всего процесса гетерогенного катализа должно включать описание каждой из его стадий. Но точно так же, как и при протекании гетерогенного некаталитического процесса, не все его стадии оказывают равное влияние на скорость катализа. В большинстве случаев одна из стадий является наиболее медленной, лимитирующей процесс; она и определяет его скорость, поэтому для изыскания путей интенсификации такого процесса важно прежде всего установить лимитирующую стадию.
Из анализа гетерогенных некаталитических процессов известно, что если наиболее медленной стадией, лимитирующей общую скорость, является диффузионный перенос газообразного вещества через пограничный слой газа, т. е., если процесс протекает во внешнедиффузионной области, эффективным средством его ускорения служит увеличение скорости газового потока. На этом основан наиболее часто применяемый экспериментальный метод определения влияния диффузии на скорость каталитического процесса.
Для этой цели проводят серию опытов по определению скорости каталитической реакции при различной скорости потока реакционной смеси, но при постоянном отношении объема катализатора к объему смеси VK/Vr = const, или VK/fw = const (здесь VK — объем катализатора; Vr - объем реакционной газовой смеси; f - площадь сечения контактной трубки; w - линейная скорость газового потока).
При увеличении w (что достигается уменьшением f) скорость реакции - rA = dXA/dτ будет возрастать только до тех пор, пока процесс протекает во внешнедиффузионной области (рис. IV. 3).
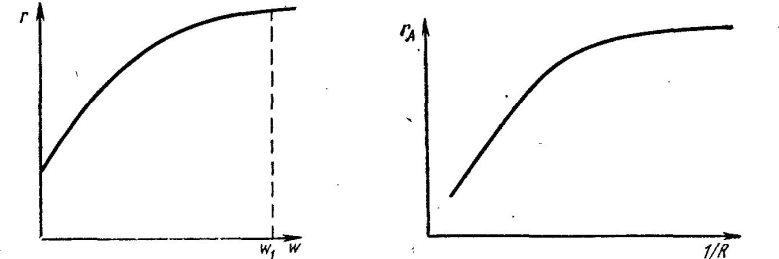
![]()
На участке кривой от w = 0 до w = w1 скорость потока оказывает влияние на скорость реакции и, следовательно, процесс протекает во внешнедиффузионной области.
Влияние
внутренней диффузии исследуют путем
проведения серии опытов при скорости
потока
w
>
w1
(в
области, где, внешняя диффузия уже не
оказывает влияния на общую скорость
процесса). Опыты проводят на зернах
катализатора различного размера,
результаты опытов выражают в виде
графической зависимости
![]() .
На графике эта зависимость имеет такой
же характер, что и для некаталитических
процессов в системе г-т (рис. IV. 4).
.
На графике эта зависимость имеет такой
же характер, что и для некаталитических
процессов в системе г-т (рис. IV. 4).
Активное действие катализатора обусловлено прежде всего предварительной адсорбцией реагирующих веществ на поверхности катализатора, что оказывает большое влияние на скорость гетерогенного катализа.
Адсорбция является самопроизвольным процессом, поэтому она сопровождается убылью энергии системы и связана с выделением тепла. Существует два вида адсорбции физическая и химическая (последняя называется также активированной адсорбцией, или хемосорбцией). Процесс катализа связан с хемосорбцией, но хемо- сорбция может быть обратимой и необратимой. Естественно, что в процессе катализа хемосорбция должна быть обратимой, так как активные центры должны непрерывно возобновлять свою функциональную деятельность по отношению к реагентам. Необратимая адсорбция вызывает отравление катализатора.
С целью установления функциональной зависимости скорости гетерогенного катализа от различных факторов проводят всесторонние исследования, что позволяет определить влияние различных показателей на скорость адсорбции и десорбции реагентов поверхностью катализатора, а также на скорость протекания других стадий, определяющих каталитический процесс в целом. Полученные при этом данные используют для составления теоретических уравнений, позволяющих установить общие закономерности в идеальных условиях.
Для практических целей обычно применяют эмпирические уравнения, которые получают путем тщательного изучения влияния различных факторов на скорость конкретного каталитического процесса в условиях, близких к производственным. При этом идеа-лизированные модели служат отправной точкой для наиболее эффективного анализа экспериментальных данных.
Нахождение кинетических уравнений и определение оптимальных параметров является главной целью научных исследований в области каталитических процессов, так как эти данные используются затем для расчета каталитических реакторов.
Температура оказывает весьма существенное влияние на каталитические процессы, так как при повышении температуры увеличивается константа скорости реакции и одновременно изменяется константа равновесия. Для процессов, проходящих в кинетической области, повышение температуры всегда способствует приближению процесса к состоянию равновесия. Но, как известно, для обратимых реакций равновесная степень превращения X* при повышении Т уменьшается для экзотермических реакций и увеличивается для эндотермических реакций. Поэтому закономерности, отражающие суммарную скорость реакции и действительную степень превращения для экзотермических и эндотермических реакций, совершенно различны. При этом наблюдается такая же функциональная зависимость X = f(Т), как и для некаталитических процессов.
Время контакта (время соприкосновения) реагирующих веществ с катализатором также является важной технологической характеристикой каталитического процесса, так как оно определяет его интенсивность. При расчете реакторов время контакта определяют по уравнению:
τ = Vk/V
где τ - время контакта;
Vk - объем катализатора;
V - объем реакционной смеси, проходящей через катализатор в единицу времени.
Величина, обратная времени контакта, называется объемной скоростью и выражается уравнением
S = 1/τ
где S — объемная скорость (объем реакционной смеси, проходящей через единицу объема катализатора в единицу времени), м3 (газа) • м-3 (катализ.) • с-1 = с-1.
При увеличении объемной скорости обычно снижается степень превращения, однако при этом возрастает интенсивность работы аппарата, т. е. увеличивается количество целевого продукта, получаемого с единицы объема катализатора в единицу времени. Это объясняется тем, что при увеличении скорости потока реагирующая система в большей мере удалена от равновесия, процесс протекает в области высоких скоростей за счет большой движущей силы ∆С = Рг - Рт.
Интенсивность катализатора выражают в виде уравнения:
G = pzS
где G - производительность катализатора, кг/ч*м3
р - плотность реагента при нормальных условиях, кг/м3
z - мольная доля целевого продукта в газовой смеси;
S - объемная скорость, ч-1.
Из уравнения видно, что при увеличении объемной скорости производительность катализатора возрастает. Однако возможности для увеличения S ограничены, так как при этом степень превращения ХА уменьшается (снижается концентрация целевого продукта, что затрудняет выделение его из реакционной смеси), возрастает расход энергии и нарушается автотермичность экзотермической реакции вследствие относительного увеличения объема реакционной смеси.
Применение давления является одним из способов повышения степени превращения при промышленном осуществлении обратимых каталитических реакций, проходящих с уменьшением объема. Давление становится решающим фактором, когда активность катализатора и величина X* низкие.
Свойства и приготовление твердых катализаторов.
Промышленные твердые катализаторы обычно не являются индивидуальными веществами. Они представляют собой, за редким исключением, сложную смесь, называемую контактной массой. В контактной массе одни вещества являются собственно катализаторами, другие - носителями, а третьи служат активаторами.
Носители - термостойкие, инертные, пористые вещества, на которые осаждением или другими способами наносят катализатор. Применение носителей улучшает свойства катализаторов и удешевляет их. В качестве носителей применяют пемзу, асбест, сили-кагель и другие пористые вещества.
Активаторы или промоторы - вещества, повышающие активность основного катализатора, например, окислы щелочных металлов увеличивают активность железных катализаторов в синтезе аммиака и ванадиевых катализаторов при окислении двуокиси серы.
Механизм действия активатора может быть самым различным: они могут образовывать химические соединения, твердые растворы, могут изменять электрофизические свойства поверхности и т. д. Активаторы могут также увеличивать активность катализатора, развивая и стабилизируя его поверхность. Последние называются структурными.
Качество катализаторов характеризуют следующими основными показателями: активностью; избирательностью действия; устойчивостью к ядам и термостойкостью; механической прочностью; доступностью и дешевизной; теплопроводностью, которая должна быть возможно более высокой.
Катализатор обычно готовят в виде зерен, таблеток, гранул. Иногда катализаторы применяют в виде тончайших сеток, изготовленных из металлов или сплавов.
Наиболее часто катализаторы изготавливают следующим образом:
1 осаждением гидроокисей или карбонатов (из растворов их солей) на носителе с последующим формованием и прокаливанием;
2 совместным прессованием всех компонентов катализатора с вяжущим веществом;
3 сплавлением нескольких веществ;
4 пропиткой пористого носителя раствором, содержащим катализатор и активатор.
Значение и области применения катализа.
Аппаратурное оформление каталитических процессов
Исходные данные для расчета реакторов. Материальный и энергетический баланс. Законы сохранения массы вещества и энергии.
Исходные положения для расчета реакторов
Разработка реакторов начинается:
С исследования гидродинамической модели процесса как основы его математического описания.
Далее изучают кинетику химических реакций,
процессы массопередачи,
процессы теплопередачи.
Чем глубже изучена кинетика реакций, тем надежнее предсказания результатов протекания соответствующих процессов.
Кинетические уравнения, записанные в дифференциальной форме, интегрируют по объему реактора. При этом часто возникают трудности, поскольку состав и температура реакционной смеси могут различаться в разных точках реакционного пространства в зависимости от термодинамических характеристик реакций, также от скорости теплообмена с окружающей средой. Кроме того, характер движения жидкости в аппарате, определяемый реальной геометрией реактора, будет влиять на перераспределение вещества и тепла в реакторе.
Поэтому для выбора конструкции и определения размеров любого реактора необходимо принимать во внимание большое число различных факторов и прежде всего располагать следующими данными:
Величинами, характеризующими скорость протекания химических реакций, а также скорость массопередачи и теплопередачи.
Внешними ограничениями, накладываемыми технологическим оборудованием, такими, как: модель реактора, которая определяет его гидродинамическую характеристику и скорость процессов переноса вещества и тепла.
Производительность установки (цеха), степень превращения реагентов, концентрацию реагентов и температурный режим устанавливают из ряда теоретических предпосылок.
Нужно учитывать также ряд общих требований к реакторам, которые должны обеспечить:
Высокую производительность единицы реакционного объема.
Высокую селективность для сложного процесса.
Низкие энергетические затраты.
Простоту обслуживания, дешевизну в изготовлении и выполнение требований техники безопасности.
Надежность регулирования и устойчивость технологического режима.
Низкую стоимость продукции.
Приведенные требования несколько противоречивы, поэтому при расчете и конструировании реакторов стремятся найти решения, обеспечивающие в конечном счете общую экономичность процесса.
Одним из важнейших показателей, отражающих совершенство химического реактора, является его интенсивность, которая характеризуется количеством целевого продукта, получаемого в единицу времени при заданных условиях с единицы объема (площади) аппарата. Интенсивность аппарата тем выше, чем меньшее время затрачивают на получение заданного количества продукта.
Поэтому, главной задачей при изучении процессов, протекающих в реакторах любого типа, является установление функциональной зависимости времени пребывания реагентов в реакторе от различных факторов:
|
|
(1.1) |
|
где x – заданная степень превращения реагента; С0 – начальная концентрация реагента; r – скорость химической реакции. | |
Уравнение, связывающее четыре названные величины, называется характеристическим уравнением реактора.
Исходным уравнением для получения характеристического уравнения реактора любого типа является материальный баланс, составленный по одному из компонентов реакционной смеси. Составим материальный баланс по исходному веществу А при проведении простой необратимой реакции:
|
А→R |
(1.2) |
В общем виде уравнение материального баланса записывается так:
|
|
(1.3) |
|
где ВАприх. – количество вещества А, поступающее в единицу времени в тот реакционный объем, для которого составляется баланс; ВАрасх. – количество вещества А, расходуемое в единицу времени в реакционном объеме.
| |
Учитывая, что поступившее в реактор вещество А расходуется в трех направлениях, можно записать
|
|
(1.4) |
|
где ВАхр – количество вещества А, вступающее в реакционном объеме в химическую реакцию в единицу времени; ВАст. – сток вещества А (количество вещества А, выходящее из реакционного объема в единицу времени); ВАнак. – накопление вещества А (количество вещества А, остающееся в реакционном объеме в неизменном виде в единицу времени).
| |
С учетом уравнения (1.4) уравнение (1.3) записывается в виде
|
|
(1.5) |
Разность между количеством вещества А, поступающим в единицу времени в реактор (ВАприх.) и выходящим из него (ВАст) – это количество вещества А, переносимое конвективным потоком (ВАконв):.
|
|
(1.6) |
Принимая это во внимание, уравнение (1.5) можно записать еще в одной форме:
|
|
(1.7) |
В каждом конкретном случае уравнение материального баланса принимает различную форму. Он может составляться для единицы объема реакционной массы либо для реактора в целом. При этом можно рассчитывать материальные потоки, проходящие через объем за единицу времени, а можно относить эти потоки к молю одного из исходных реагентов.
Так, в общем случае, когда состав, температура и другие параметры непостоянны в различных точках реактора или непостоянны во времени, материальный баланс составляют в дифференциальной форме для элементарного объема реактора. В результате получают уравнение конвективного массообмена (А.Г.Касаткин. Основные процессы и аппараты химической технологии, – М: Химия, 1973.), дополненное членом rA, учитывающим протекание химической реакции. Составленное по исходному реагенту А, оно имеет вид:
|
|
(1.8) |
|
где CA – концентрация вещества А в реакционной смеси; х, y, z – пространственные координаты; Д – коэффициент молекулярной и турбулентной диффузии; rA – скорость химической реакции.
| |
Левая часть уравнения (1.8) отражает общее изменение концентрации исходного вещества во времени в элементарном объеме, для которого составляется материальный баланс. Это накопление вещества А. Левой части уравнения соответствует величина ВАнак. в уравнении баланса (1.7).
Первая группа членов правой части уравнения (1.8) – произведения составляющих скорости потока вдоль осей координат на градиенты концентраций – отражает изменение концентрации А в элементарном объеме вследствие переноса его вместе с самой средой в направлении, совпадающем с направлением общего потока.
Вторая группа членов правой части уравнения (1.8) – произведение Д на сумму вторых производных от концентрации по x, y, z – отражает изменение концентрации А в элементарном объеме в результате переноса его путем диффузии.
Суммарному переносу вещества в движущейся среде конвективным переносом и диффузией соответствует в уравнении (1.7) величине ВАконв (суммарный перенос вещества называют конвективным массообменном или конвективной диффузией).
И, наконец, член rA показывает изменение концентрации А в элементарном объеме за счет химической реакции. Ему в уравнении (1.7) соответствует величина ВАхр.
В зависимости от типа реактора и режима его работы дифференциальное уравнение материального баланса (1.8) упрощается и решение его значительно облегчается.
В том случае, когда параметры процесса постоянны по всему объему реактора и во времени, нет необходимости составлять баланс в дифференциальной форме. Баланс составляют в конечных величинах, беря разность значений параметров на входе в реактор и выходе из него.
Все процессы, протекающие в химических реакторах, делят на:
стационарные (установившиеся),
нестационарные (неустановившиеся).
К первым относят процессы, при которых не происходит изменения во времени параметров процесса (например, концентрации А, температуры и т.д.), поэтому в таких реакторах отсутствует накопление вещества (или тепла) и производная от параметра во времени равна нулю. Так, при стационарном режиме для компонента А:
|
|
(1.9) |
При нестационарных режимах параметры непостоянны во времени и всегда имеется накопление вещества (тепла):
|
|
(1.10) |
Как уже отмечалось, уравнение материального баланса является исходным при расчете реактора любого типа. Вместе с тем оно не позволяет учитывать тепловой режим в реакторе и влияние температуры на статику и кинетику процесса.
Поэтому при выборе оптимального режима в реакторе, разработке методов его поддержания, расчета реакторов с теплообменной аппаратурой материальный баланс реактора должен решаться совместно с тепловым балансом.
Тепловой баланс, так же как и материальный, может быть составлен в различной форме. Связующим звеном при совместном решении уравнений материального и теплового баланса служит кинетическое уравнение реакции, а также уравнение Аррениуса. Далее будут показаны методы расчета реакторов различных типов. Для этого предварительно дается классификация реакторов.
Классификация реакторов по гидродинамическому режиму. Уравнение материального баланса реакторов.
При классификации реакторов принимают во внимание следующие признаки:
Характер протекающей в реакторе операции.
Режим движения реакционной среды.
Тепловой режим.
Фазовое состояние реагентов.
По первому признаку этой классификации реакторы делятся на периодические, непрерывные и полунепрерывные.
Реакторы с непрерывной подачей реагентов делят, в свою очередь, по характеру движения реакционной среды (по гидродинамической обстановке в реакторе) на реакторы идеального вытеснения, реакторы идеального смешения. Классификация реакторов по тепловому режиму будет дана ниже.
Обычно изучают реакторы в два этапа: вначале при работе их в изотермических условиях, когда температура реакционной смеси постоянна, а затем с учетом изменения температуры реакционной смеси.
Исходным уравнением для получения характеристического уравнения реактора любого типа является материальный баланс, составленный по одному из компонентов реакционной смеси. Составим материальный баланс по исходному веществу А при проведении простой необратимой реакции:
|
А→R |
(1.2) |
В общем виде уравнение материального баланса записывается так:
|
|
(1.3) |
|
где ВАприх. – количество вещества А, поступающее в единицу времени в тот реакционный объем, для которого составляется баланс; ВАрасх. – количество вещества А, расходуемое в единицу времени в реакционном объеме.
| |
Учитывая, что поступившее в реактор вещество А расходуется в трех направлениях, можно записать
|
|
(1.4) |
|
где ВАхр – количество вещества А, вступающее в реакционном объеме в химическую реакцию в единицу времени; ВАст. – сток вещества А (количество вещества А, выходящее из реакционного объема в единицу времени); ВАнак. – накопление вещества А (количество вещества А, остающееся в реакционном объеме в неизменном виде в единицу времени).
| |
С учетом уравнения (1.4) уравнение (1.3) записывается в виде
|
|
(1.5) |
Разность между количеством вещества А, поступающим в единицу времени в реактор (ВАприх.) и выходящим из него (ВАст) – это количество вещества А, переносимое конвективным потоком (ВАконв):.
|
|
(1.6) |
Принимая это во внимание, уравнение (1.5) можно записать еще в одной форме:
|
|
(1.7) |
В каждом конкретном случае уравнение материального баланса принимает различную форму. Он может составляться для единицы объема реакционной массы либо для реактора в целом. При этом можно рассчитывать материальные потоки, проходящие через объем за единицу времени, а можно относить эти потоки к молю одного из исходных реагентов.
Так, в общем случае, когда состав, температура и другие параметры непостоянны в различных точках реактора или непостоянны во времени, материальный баланс составляют в дифференциальной форме для элементарного объема реактора. В результате получают уравнение конвективного массообмена (А.Г.Касаткин. Основные процессы и аппараты химической технологии, – М: Химия, 1973.), дополненное членом rA, учитывающим протекание химической реакции. Составленное по исходному реагенту А, оно имеет вид:
|
|
(1.8) |
|
где CA – концентрация вещества А в реакционной смеси; х, y, z – пространственные координаты; Д – коэффициент молекулярной и турбулентной диффузии; rA – скорость химической реакции.
| |
Левая часть уравнения (1.8) отражает общее изменение концентрации исходного вещества во времени в элементарном объеме, для которого составляется материальный баланс. Это накопление вещества А. Левой части уравнения соответствует величина ВАнак. в уравнении баланса (1.7).
Первая группа членов правой части уравнения (1.8) – произведения составляющих скорости потока вдоль осей координат на градиенты концентраций – отражает изменение концентрации А в элементарном объеме вследствие переноса его вместе с самой средой в направлении, совпадающем с направлением общего потока.
Вторая группа членов правой части уравнения (1.8) – произведение Д на сумму вторых производных от концентрации по x, y, z – отражает изменение концентрации А в элементарном объеме в результате переноса его путем диффузии.
Суммарному переносу вещества в движущейся среде конвективным переносом и диффузией соответствует в уравнении (1.7) величине ВАконв (суммарный перенос вещества называют конвективным массообменном или конвективной диффузией).
И, наконец, член rA показывает изменение концентрации А в элементарном объеме за счет химической реакции. Ему в уравнении (1.7) соответствует величина ВАхр.
В зависимости от типа реактора и режима его работы дифференциальное уравнение материального баланса (1.8) упрощается и решение его значительно облегчается.
В том случае, когда параметры процесса постоянны по всему объему реактора и во времени, нет необходимости составлять баланс в дифференциальной форме. Баланс составляют в конечных величинах, беря разность значений параметров на входе в реактор и выходе из него.
Все процессы, протекающие в химических реакторах, делят на:
стационарные (установившиеся),
нестационарные (неустановившиеся).
К первым относят процессы, при которых не происходит изменения во времени параметров процесса (например, концентрации А, температуры и т.д.), поэтому в таких реакторах отсутствует накопление вещества (или тепла) и производная от параметра во времени равна нулю. Так, при стационарном режиме для компонента А:
|
|
(1.9) |
При нестационарных режимах параметры непостоянны во времени и всегда имеется накопление вещества (тепла):
|
|
(1.10) |
Как уже отмечалось, уравнение материального баланса является исходным при расчете реактора любого типа. Вместе с тем оно не позволяет учитывать тепловой режим в реакторе и влияние температуры на статику и кинетику процесса.
Поэтому при выборе оптимального режима в реакторе, разработке методов его поддержания, расчета реакторов с теплообменной аппаратурой материальный баланс реактора должен решаться совместно с тепловым балансом.
Тепловой баланс, так же как и материальный, может быть составлен в различной форме. Связующим звеном при совместном решении уравнений материального и теплового баланса служит кинетическое уравнение реакции, а также уравнение Аррениуса. Далее будут показаны методы расчета реакторов различных типов. Для этого предварительно дается классификация реакторов.
Периодические реакторы. Реактор идеального смешения периодический.
Реакторы периодические характеризуются одновременной и одноразовой загрузкой реагентов. При этом процесс складывается из трех стадий:
загрузки сырья;
его обработки (химического превращения);
выгрузки продукта.
После проведения этих операций они повторяются вновь, т.е. работа реактора осуществляется циклически.
Время
одного цикла, проводимого в периодическом
реакторе, определяется по уравнению
|
|
(2.2) |
|
где τn – полное время цикла; – рабочее время (затрачиваемое на проведение химической реакции); в – вспомогательное время (затрачиваемое на загрузку реагентов и выгрузку продукта).
| |
Реактор идеального смешения периодический – РИС-П – это реактор периодического действия с мешалкой (рис.2.1). Перемешивание в таком реакторе настолько интенсивное, что в каждый данный момент времени концентрация реагентов одинакова по всему объему реактора и меняется лишь во времени, по мере протекания химической реакции.
Периодические процессы по своей природе всегда являются нестационарными, т.к. в них за счет химической реакции происходит изменение во времени параметров процесса, например, концентрации веществ, участвующих в реакции, т.е. имеет место накопление вещества.
Для расчета периодического реактора надо знать его характеристическое уравнение, позволяющее определить рабочее время , необходимое для достижения заданной концентрации вещества CAo и известной кинетике процесса (т.е. известной зависимости скорости химической реакции – rA от концентрации реагентов и температуры).
|
|
|
NAo – начальное количество исходного вещества А в реакционной смеси (при загрузке в реактор); CAo – начальная концентрация вещества А в реакционной смеси; xAo – начальная степень превращения вещества А; NA, CA, xA – то же, в конце процесса; – время; y – пространственная координата (координата места). |
|
Рис. 2.1 – Реактор идеального смешения периодического действия (РИС-П) |
|
|
Исходным соотношением для получения характеристического уравнения реактора, как уже говорилось, является уравнение (1.8) материального баланса в дифференциальной форме (дифференциальное уравнение конвективного массообмена).
В РИС-П все параметры (в том числе и концентрация реагента А – СА) одинаковы по всему объему реактора в любой момент времени (так как реакционная смесь интенсивно перемешивается).
Производная любого порядка от концентрации по x, y, z равна нулю, и поэтому можно записать:
|
|
(2.3) |
|
|
(2.4) |
С учетом полученных значений уравнение (1.8) упрощается и может быть записано не в частных производных, а в виде обыкновенного дифференциального уравнения:
|
|
(2.5) |
При
выражении скорости реакции по исходному
веществу А:
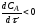 .
.
Поэтому,
перед
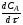 и rA
ставят знак минус, чтобы скорость
являлась положительной величиной.
и rA
ставят знак минус, чтобы скорость
являлась положительной величиной.
Изменение концентрации исходного вещества А во времени и по объему для реакции, протекающей в периодическом реакторе идеального смешения, показано на рисунке 2.2.
|
|
|
а – по времени; б – по месту |
|
Рис. 2.2 – Распределение концентрации реагента А в РИС-П |
|
|
Текущую концентрацию реагента А рассчитывают по уравнению
|
|
(2.6) |
Все реакции протекают либо без изменения, либо с изменением объема реакционной смеси. Для реакций первого типа (V=const) текущая концентрация реагента А равна
|
|
(2.7) |
Подставив полученное значение для CA в уравнение (2.5), находим:
|
|
(2.8) |
или
|
|
(2.9) |
Интегрируя уравнение (2.9) в пределах изменения времени от 0 до и степени превращения от 0 до хА, получаем характеристическое уравнение РИС периодического действия для условий, когда объем реакционной смеси не изменяется в течение процесса:
|
|
(2.10) |
Рассмотрим некоторые частные случаи этого уравнения.
Для необратимой реакции n-го порядка скорость реакции выражается уравнением:
|
|
(2.11) |
Подставив полученное значение для (-rA) в уравнение (2.10) и учитывая, что константа скорости, k, – величина постоянная в изотермических условиях, получим
|
|
(2.12) |
Для необратимой реакции нулевого порядка
|
|
(2.13) |
Поэтому, из уравнения (2.10) следует
|
|
(2.14) |
Для необратимой реакции первого порядка
|
|
(2.15) |
Поэтому подстановкой этого значения в уравнение (2.10) получаем:
|
|
(2.16) |
или
|
|
(2.17) |
В
тех случаях, когда интегрирование
уравнения (2.10) связано с трудностями,
определение времени
производят методом графического
интегрирования. Для этого строят
графическую зависимость
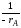 отxА
и вычисляют площадь под кривой между
начальным xAo
и конечным xA
значениями степени превращения. Для
xAo=0
искомая площадь выражается уравнением
(рис. 2.3):
отxА
и вычисляют площадь под кривой между
начальным xAo
и конечным xA
значениями степени превращения. Для
xAo=0
искомая площадь выражается уравнением
(рис. 2.3):
|
|
(2.18) |
Подставив полученное значение для S в уравнение (2.10), находим:
|
|
(2.19) |
Приведенная на рисунке 2.1. схема РИС-П является одновременно схемой физической модели этого реактора. Если изготовить такой реактор в малом масштабе (модель промышленного реактора), а затем включить его в работу с поддержанием соответствующего технологического режима, то, исследовав такую модель, можно получить основные данные, необходимые для проектирования промышленных реакторов.
|
|
|
Рис. 2.3 – Графический расчет РИС – П |
|
|
Исследование состоит в том, что опытные данные представляют в форме зависимостей безразмерных комплексов, составленных комбинацией различных физических величин и линейных размеров. Такая форма представления опытных данных позволяет распространить найденные зависимости на группу подобных между собой явлений, характеризующих постоянством определяющих безразмерных комплексов или критериев подобия (Рейнольдса, Фруда, Архимеда, Пекла, Прандтля, Куссельта и др.). Поэтому, физическое моделирование сводится к воспроизведению постоянства определяющих критериев подобия в модели и в объекте.
Математической моделью РИС-П является его характеристическое уравнение (2.10). Исходя из этого уравнения, представляется возможным определить размеры реактора, а также исследовать эту модель с точки зрения определения оптимальных значений всех параметров, входящих в характеристическое уравнение.
Исследование математической модели обычно проводят на электронно-вычислительной машине (ЭВМ), обладающей большими возможностями в отношении проведения вычислительных операций. Во многих случаях на основе результатов таких исследований представляется возможным вести проектирование промышленного реактора без проведения исследований на опытной установке, при условии достаточно полного изучения кинетики процесса в лабораторных условиях.
Реакторы непрерывные. Реактор идеального вытеснения. Реактор идеального смешения непрерывный.
В реакторах непрерывного действия (проточные реакторы) питание их реагентами и отвод продуктов реакции осуществляется непрерывно.
Если в периодическом реакторе можно непосредственно (по часам) измерять продолжительность реакции (т.к. там показатели процесса меняются во времени), то в реакторе непрерывного действия это сделать невозможно – там при установившемся режиме параметры не меняются со временем. Поэтому для непрерывных реакторов удобней пользоваться понятием условного времени пребывания реагентов в системе (времени контакта), которое определяется по уравнению:
|
|
(2.20) |
|
где – время пребывания; Vr – объем реактора; Vo – объем реакционной смеси, поступающей в реактор в единицу времени (объемный расход реагентов), измеренный при определенных условиях.
| |
Поскольку
|
|
(2.21) |
|
где ВАо – мольный расход реагентов, | |
выражение для τ может иметь вид:
|
|
(2.22) |
Проточные реакторы отличаются различным характером перемещения в них вещества (гидродинамической обстановкой). По этому признаку непрерывные реакторы разделяют на реакторы идеального вытеснения и реакторы идеального смешения.

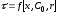 ,
,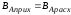 ,
,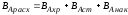 ,
,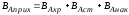
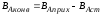
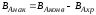
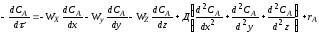 ,
,
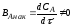
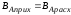 ,
,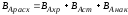 ,
,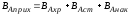
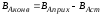
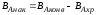
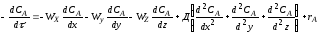 ,
,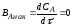
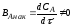
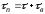 ,
,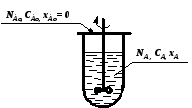
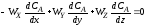 ,
,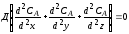
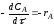

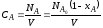
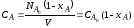
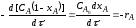
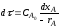
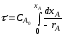
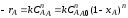
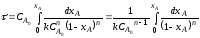
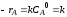
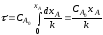
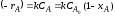
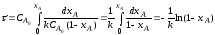
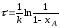
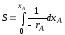
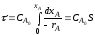
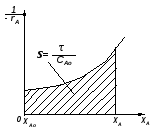
 ,
,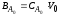 ,
,