
-
Изменение концентраций веществ и скоростей в ходе реакции
В ходе гомогенной реакции
![]()
концентрации
реагентов
![]() и
и
![]() уменьшаются, а концентрации продуктов
уменьшаются, а концентрации продуктов
![]() и
и
![]() увеличиваются по сравнению с первоначальными
значениями
увеличиваются по сравнению с первоначальными
значениями
![]() и в некоторый момент времени
и в некоторый момент времени
![]() равны:
равны:
|
для реагентов |
для продуктов |
||
|
|
(13) |
|
(14) |
Как
правило, в начальный момент времени
концентрации продуктов реакции
![]() равны нулю (
равны нулю (![]() ).
).
Изменения
концентраций
![]() для каждого вещества-участника реакции
связаны со стехиометрическими
коэффициентами в уравнении реакции:
для каждого вещества-участника реакции
связаны со стехиометрическими
коэффициентами в уравнении реакции:
![]() (15)
(15)
В
соответствии с вышеизложенным различают
скорости реакции:
![]() – начальную и
– начальную и
![]() – в любой момент времени.
– в любой момент времени.
Таблица 2
|
Скорость |
Реакции |
|
|
прямая |
обратная |
|
|
начальная,
|
|
|
|
в
момент
|
|
|
Используя уравнения (13 – 15) и таблицу 2, можно рассчитать концентрации и скорости реакций в любой момент времени.
Пример 3. Начальные концентрации реагентов газофазной реакции
![]()
равны
(моль/л):
![]() ;
;
![]() .
Рассчитать: а) во сколько раз по сравнению
с первоначальной изменится скорость
прямой реакции в тот момент, когда
прореагирует 20% сероуглерода. б) скорость
обратной реакции в этот момент времени,
если
.
Рассчитать: а) во сколько раз по сравнению
с первоначальной изменится скорость
прямой реакции в тот момент, когда
прореагирует 20% сероуглерода. б) скорость
обратной реакции в этот момент времени,
если
![]() моль-2·л2·с-1.
моль-2·л2·с-1.
Решение. Для ответа на поставленные в задаче вопросы необходимо рассчитать:
![]()
![]()
![]()
с0, сτ и Δс связаны между собой соотношениями:
![]()
![]()
![]() ,
,
а
т.к
![]()
![]() ,
,
то
![]() .
.
Задача сводится в основном к определению изменения концентраций веществ, участвующих в реакции.
Для наглядности внесем исходные данные в таблицу.
Таблица 3
|
|
|
|||
|
|
1 |
3 |
1 |
2 |
|
|
0,2 |
0,2 |
0 |
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
По мере определения указанных в таблице величин будем вносить их значения в таблицу. Значения обозначаем *.
или:
По
условию задачи прореагировало 20%
![]() .
Чтобы определить
.
Чтобы определить
![]() ,
составляем пропорцию:
,
составляем пропорцию:
с0(CS2) = 0,2 моль/л – 100%
Δс(CS2) – 20%,
откуда
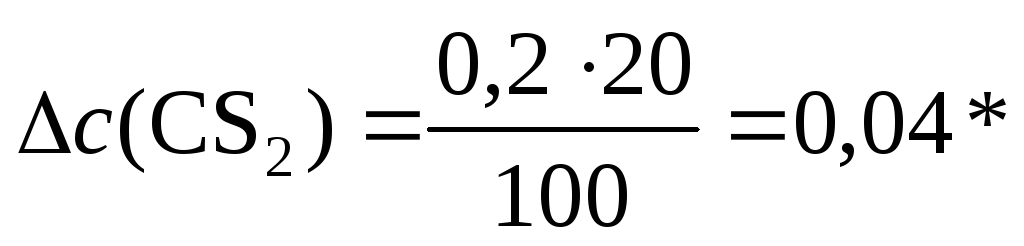 моль/л.
моль/л.
Находим
![]() - изменение концентрации реагентов и
продуктов в ходе реакции, используя
соотношение (15), записываем.
- изменение концентрации реагентов и
продуктов в ходе реакции, используя
соотношение (15), записываем.
![]() ,
,
откуда:
![]() моль/л;
моль/л;
![]() моль/л;
моль/л;
![]() моль/л.
моль/л.
Вычисляем
концентрации реагентов и продуктов в
момент времени
![]() :
:
Реагенты:
![]() моль/л.
моль/л.
![]() моль/л.
моль/л.
Продукты:
![]() моль/л.
моль/л.
![]() моль/л.
моль/л.
Ниже представлен окончательный вариант таблицы 3 с результатами расчетов.
Таблица 4
|
|
||||
|
|
1 |
3 |
1 |
2 |
|
|
0,2 |
0,2 |
0 |
0 |
|
|
0,04 |
0,12 |
0,04 |
0,08 |
|
|
0,16 |
0,08 |
0,04 |
0,08 |
|
|
0,04 |
|
|
|
а)
Вычисляем, во сколько раз изменится
скорость прямой реакции в момент времени
![]() по сравнению с первоначальной.
по сравнению с первоначальной.
 .
.
Итак, скорость прямой реакции уменьшится в 19,53 раза.
б) Рассчитаем скорость обратной реакции
![]()
![]()
![]() .
.
Пример 4. Начальная концентрация оксида азота (I) в реакции
![]()
составляет
0,7 моль/л, константа скорости прямой
реакции
![]() .
Определить скорость прямой реакции в
тот момент времени, когда образовалось
0,3 моль/л диоксида углерода; массовую
долю прореагировавшего оксида азота
(I), а также концентрацию образовавшегося
азота в этот момент.
.
Определить скорость прямой реакции в
тот момент времени, когда образовалось
0,3 моль/л диоксида углерода; массовую
долю прореагировавшего оксида азота
(I), а также концентрацию образовавшегося
азота в этот момент.
Решение.
Для решения задачи необходимо: а)
рассчитать скорость прямой гетерогенной
реакции в момент
![]() :
:
![]() ;
б) концентрацию продукта реакции (
;
б) концентрацию продукта реакции (![]() )
в момент
)
в момент
![]() :
:
![]() ;
в) массовую долю прореагировавшего
диоксида углерода (
;
в) массовую долю прореагировавшего
диоксида углерода (![]() ).
).
![]()
По условию задачи
![]() моль/л;
моль/л;
![]() моль/л.
моль/л.
Тогда, пользуясь соотношением (15), запишем:
![]() ,
,
определяем:
а)
![]() моль/л;
моль/л;
![]()
![]() моль/л;
моль/л;
![]() моль/л;
моль/л;
![]() моль/л.
моль/л.
Результаты расчетов представим в виде таблицы 5.
Таблица 5
|
С(ТВ.) + 2N2O(Г) = СО2 (Г) + 2N2 (Г) |
||||
|
|
1 |
2 |
1 |
2 |
|
|
– |
0,7 |
0 |
0 |
|
|
– |
0,6 |
0,3 |
0,6 |
|
|
– |
0,1 |
0,3 |
0,6 |
|
|
– |
|
|
|
б) скорость прямой реакции в момент времени τ:
![]()
![]() .
.
в) массовая доля прореагировавшего N2O:
![]() .
.
Пример 5. Константа скорости гомогенной реакции
![]()
равна
![]() .
Через некоторое время от начала реакции
в реакционной смеси обнаружено 20 % от
первоначального количества HJ,
0,2 моль/л
.
Через некоторое время от начала реакции
в реакционной смеси обнаружено 20 % от
первоначального количества HJ,
0,2 моль/л
![]() и 0,4 моль/л
и 0,4 моль/л
![]() .
Рассчитать концентрацию
.
Рассчитать концентрацию
![]() в этот момент и начальную скорость
прямой реакции.
в этот момент и начальную скорость
прямой реакции.
Решение.
Известна концентрация одного из продуктов
реакции –
![]() ,
что позволяет вычислить изменение
концентрации
,
что позволяет вычислить изменение
концентрации
![]() к моменту времени
к моменту времени
![]() :
:
![]() моль/л;
моль/л;
![]() моль/л.
моль/л.
Тогда, пользуясь соотношением (15)
![]() ,
,
определяем:
![]() (моль/л);
(моль/л);
![]() (моль/л);
(моль/л);
![]() (моль/л).
(моль/л).
Искомая
концентрация
![]() в момент времени
в момент времени
![]() :
:
![]() моль/л;
моль/л;
Находим начальные концентрации реагентов.
Поскольку
![]() ,
то
,
то
![]() моль/л.
моль/л.
О
втором реагенте (![]() )
известно, что в реакционной смеси
обнаружено (
)
известно, что в реакционной смеси
обнаружено (![]() )
20 % от первоначального количества;
значит, прореагировало (
)
20 % от первоначального количества;
значит, прореагировало (![]() )
80 %. Составляем пропорцию:
)
80 %. Составляем пропорцию:
С0(HI) – 100%
Δc(HI) = 0,4 моль/л – 80%
откуда
![]() (моль/л).
(моль/л).
Начальную скорость прямой реакции рассчитываем по закону действующих масс:
![]()
![]() .
.
Результаты расчетов представим в виде таблицы 6.
Таблица 6
|
|
|
|||
|
|
2 |
1 |
1 |
2 |
|
|
0,5 |
0,4 |
0 |
0 |
|
|
0,4 |
0,2 |
0,2 |
0,4 |
|
|
0,1 |
0,2 |
0,2 |
0,4 |
|
|
|
|
|
0,2 |
Пример 6. В результате протекания реакции
![]()
в
реакционном сосуде объемом 5 л к некоторому
моменту времени образовалось 71 г
![]() ,
осталось 0,4 моль
,
осталось 0,4 моль
![]() ,
а хлора прореагировало в 2 раза больше,
чем осталось. Рассчитать концентрацию
образовавшегося кислорода и скорость
прямой реакции, если
,
а хлора прореагировало в 2 раза больше,
чем осталось. Рассчитать концентрацию
образовавшегося кислорода и скорость
прямой реакции, если
![]() .
.
Решение. Вычислим концентрацию продуктов реакции:
![]() моль/л.
моль/л.
Поскольку
![]() моль/л,
моль/л,
![]() моль/л.
моль/л.
Тогда, пользуясь соотношением (15) записываем:
![]() ,
,
определяем:
![]() моль/л;
моль/л;
![]() моль/л;
моль/л;
![]() моль/л.
моль/л.
Искомая
концентрация кислорода в момент времени
![]() :
:
![]() моль/л.
моль/л.
Находим
начальные концентрации реагентов. Для
этого сначала определяем концентрацию
воды в момент времени
![]() :
:
![]() моль/л,
моль/л,
Поскольку
![]() ,
то начальная концентрация воды
,
то начальная концентрация воды
![]() моль/л.
моль/л.
По условию задачи, хлора прореагировало в 2 раза больше, чем осталось:
![]() ,
,
откуда
концентрация хлора в момент времени
![]() :
:
![]() моль/л.
моль/л.
Учитывая,
что
![]() ,
определяем начальную концентрацию
хлора:
,
определяем начальную концентрацию
хлора:
![]() моль/л.
Рассчитываем скорость прямой реакции
в начальный момент времени:
моль/л.
Рассчитываем скорость прямой реакции
в начальный момент времени:
![]()
![]() ;
;
скорость
прямой реакции в момент времени
![]() :
:
![]()
![]() .
.
Результаты расчетов представим в виде таблицы 7.
Таблица 7
|
|
||||
|
|
2 |
2 |
4 |
1 |
|
|
0,3 |
0,28 |
0 |
0 |
|
|
0,2 |
0,2 |
0,4 |
0,1 |
|
|
0,1 |
0,08 |
0,4 |
0,1 |
|
|
|
|
0,1 |
|
